Оксид меди (I) или оксид меди (I ) — неорганическое соединение с формулой Cu2O . Это один из основных оксидов меди , другой — оксид меди (II) или оксид меди (CuO). Соединение может иметь желтый или красный цвет в зависимости от размера частиц. [2] Оксид меди встречается в виде минерала куприта . Он входит в состав некоторых противообрастающих красок, но также имеет и другие применения, в том числе те, в которых используются его свойства полупроводника .
Оксид меди(I) может быть получен несколькими способами. [3] Наиболее просто он получается путем окисления металлической меди:
Добавки, такие как вода и кислоты, влияют на скорость, а также на дальнейшее окисление до оксидов меди(II). Он также производится в коммерческих целях путем восстановления растворов меди(II) диоксидом серы .
Альтернативно, его можно получить путем восстановления ацетата меди(II) гидразином : [ 4]
Водные растворы хлорида меди реагируют с основанием, давая тот же материал. Во всех случаях цвет оксида меди очень чувствителен к деталям процедуры. Cu 2 O разлагается до оксида меди(II) во влажном воздухе.
Образование оксида меди (I) лежит в основе реакции Фелинга и реакции Бенедикта на восстановление сахаров . Эти сахара восстанавливают щелочной раствор соли меди(II), давая ярко-красный осадок Cu2O .
Она образуется на посеребренных медных деталях, подверженных воздействию влаги, когда слой серебра пористый или поврежден. Этот вид коррозии известен как красная чума .
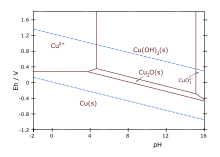
Как и все соединения меди(I), оксид меди диамагнитен . Он нелегко гидратируется до гидроксида меди .
Оксид меди(I) растворяется в концентрированном растворе аммиака с образованием бесцветного комплекса [Cu(NH 3 ) 2 ] + , который легко окисляется на воздухе до синего [Cu(NH 3 ) 4 (H 2 O) 2 ] 2+ .
Закись меди взаимодействует с кислотами. Соляная кислота дает хлоридный комплекс CuCl−
2. Серная кислота и азотная кислота производят сульфат меди (II) и нитрат меди (II) соответственно. [5]

С точки зрения их координационных сфер, медные центры 2-координированы, а оксиды являются тетраэдрическими . Таким образом, структура в некотором смысле напоминает основные полиморфы SiO 2 , но решетки оксида меди взаимопроникают. Cu 2 O кристаллизуется в кубической структуре с постоянной решетки a l = 4,2696 Å. Атомы меди располагаются в ГЦК- подрешетке, атомы кислорода в ОЦК- подрешетке. Одна подрешетка смещена на четверть диагонали тела. Пространственная группа - Pn 3 m, которая включает точечную группу с полной октаэдрической симметрией.
Преобладающее применение оксида меди – в качестве компонента противообрастающих красок. [3]
Оксид меди также широко используется в качестве пигмента и фунгицида .
Выпрямительные диоды на основе этого материала использовались в промышленности еще в 1924 году, задолго до того, как кремний стал стандартом. Оксид меди (I) также отвечает за розовый цвет в положительном тесте Бенедикта . В истории физики полупроводников Cu 2 O является одним из наиболее изученных материалов. Многие применения полупроводников были впервые продемонстрированы на этом материале:
Самые низкие экситоны в Cu2O чрезвычайно долгоживущие; формы линий поглощения были продемонстрированы с шириной линии в невольтах , что является самым узким объемным экситонным резонансом, когда-либо наблюдавшимся. [9] Связанные с ними квадрупольные поляритоны имеют низкую групповую скорость , приближающуюся к скорости звука. Таким образом, свет движется почти так же медленно, как звук в этой среде, что приводит к высокой плотности поляритонов. Еще одной необычной особенностью экситонов основного состояния является то, что все механизмы первичного рассеяния известны количественно. [10] Cu2O был первым веществом, для которого удалось установить полностью свободную от параметров модель расширения ширины линии поглощения под воздействием температуры , что позволило вывести соответствующий коэффициент поглощения . С использованием Cu2O можно показать , что соотношения Крамерса–Кронига неприменимы к поляритонам. [11]
В декабре 2021 года Toshiba представила прозрачный тонкопленочный солнечный элемент из оксида меди (Cu 2 O) . Ячейка достигла эффективности преобразования энергии 8,4% , что является самой высокой эффективностью, когда-либо зарегистрированной для любого элемента этого типа по состоянию на 2021 год. Ячейки могут использоваться для приложений на высотных платформах и электромобилях . [12]
Примером природного оксида меди (I,II) является минерал парамелаконит , Cu 4 O 3 или CuЯ
2CuII
2О 3 . [13] [14]