
Вариация числа копий ( CNV ) — это явление, при котором участки генома повторяются, а количество повторов в геноме варьируется у разных людей. [1] Вариация числа копий — это тип структурной вариации : в частности, это тип события дупликации или делеции , которое затрагивает значительное количество пар оснований. [2] Примерно две трети всего человеческого генома могут состоять из повторов [3], а 4,8–9,5% человеческого генома можно классифицировать как вариации числа копий. [4] У млекопитающих вариации числа копий играют важную роль в создании необходимых вариаций в популяции, а также фенотипа заболевания. [1]
Вариации количества копий обычно можно разделить на две основные группы: короткие повторы и длинные повторы. Однако между этими двумя группами нет четких границ, и классификация зависит от природы интересующих локусов . Короткие повторы включают в себя в основном динуклеотидные повторы (два повторяющихся нуклеотида, например ACACAC...) и тринуклеотидные повторы. К длинным повторам относятся повторы целых генов. Эта классификация, основанная на размере повторов, является наиболее очевидным типом классификации, поскольку размер является важным фактором при изучении типов механизмов, которые, скорее всего, привели к возникновению повторов [5] , отсюда и вероятное влияние этих повторов на фенотип.
Одним из наиболее известных примеров изменения числа коротких копий является тринуклеотидный повтор пар оснований CAG в гене хантингтина, ответственном за неврологическое расстройство – болезнь Хантингтона . [6] В данном конкретном случае, если тринуклеотид CAG повторяется более 36 раз при расширении тринуклеотидного повтора , у человека, скорее всего, разовьется болезнь Хантингтона, и она, вероятно, будет унаследована его или ее потомством. [6] Число повторов тринуклеотида CAG обратно коррелирует с возрастом начала болезни Хантингтона. [7] Часто полагают, что эти типы коротких повторов возникают из-за ошибок в активности полимеразы во время репликации , включая проскальзывание полимеразы, переключение матрицы и переключение вилки, которые будут подробно обсуждаться позже. Короткий размер повтора этих вариаций числа копий приводит к ошибкам в полимеразе, поскольку эти повторяющиеся области склонны к неправильному распознаванию полимеразой, и реплицированные области могут реплицироваться снова, что приводит к образованию дополнительных копий повтора. [8] Кроме того, если эти тринуклеотидные повторы находятся в одной и той же рамке считывания в кодирующей части гена, это может привести к образованию длинной цепи одной и той же аминокислоты , возможно, создавая белковые агрегаты в клетке, [7] и если эти короткие повторы попадают в некодирующую часть гена, это может влиять на экспрессию и регуляцию гена . С другой стороны, в геноме реже выявляется переменное число повторов целых генов. Одним из примеров полного повтора гена является ген альфа-амилазы 1 ( AMY1 ), который кодирует альфа-амилазу, число копий которой значительно варьируется между разными популяциями с разным рационом питания. [9] Хотя конкретный механизм, который позволяет гену AMY1 увеличивать или уменьшать количество копий, все еще остается предметом споров, некоторые гипотезы предполагают, что негомологичное соединение концов или опосредованное микрогомологией соединение концов , вероятно, ответственно за эти процессы в целом. повторяется. [9] Повторы целых генов оказывают немедленное влияние на экспрессию этого конкретного гена, и тот факт, что изменение числа копий гена AMY1 связано с диетой, является замечательным примером недавней эволюционной адаптации человека. [9]Хотя это общие группы, в которые группируются вариации числа копий, точное количество пар оснований, на которые влияют вариации числа копий, зависит от конкретных представляющих интерес локусов. В настоящее время, используя данные всех зарегистрированных вариантов количества копий, средний размер варианта количества копий составляет около 118 КБ, а медианный размер — около 18 КБ. [10]
Что касается структурной архитектуры вариаций числа копий, исследования предложили и определили «горячие точки» в геноме, где вариации числа копий в четыре раза богаче. [2] Эти области «горячих точек» были определены как области, содержащие длинные повторы, которые на 90–100% схожи, известные как сегментные дупликации , тандемные или вкрапленные, и, что наиболее важно, эти области «горячих точек» имеют повышенную скорость хромосомных перестроек . [2] Считалось, что эти крупномасштабные хромосомные перестройки приводят к нормальным вариациям и генетическим заболеваниям , включая вариации числа копий. [1] Более того, эти горячие точки изменения числа копий одинаковы во многих популяциях на разных континентах, а это означает, что эти горячие точки были либо независимо приобретены всеми популяциями и передавались из поколения в поколение, либо они были приобретены на ранней стадии эволюции человека до того, как популяции разделились. последнее кажется более вероятным. [1] Наконец, в геноме, по-видимому, не происходит пространственных смещений в отношении местоположения, в котором вариации числа копий распределены наиболее плотно. [1] Хотя первоначально с помощью флуоресцентной гибридизации in situ и микросателлитного анализа было обнаружено, что повторы числа копий локализованы в областях с высокой повторяемостью, таких как теломеры , центромеры и гетерохроматин , [11] недавние полногеномные исследования пришли к иному выводу. [2] А именно, субтеломерные регионы и перицентромерные регионы являются местом нахождения большинства горячих точек хромосомных перестроек, и в этом регионе не наблюдается значительного увеличения вариаций числа копий. [2] Более того, в этих регионах «горячих точек» хромосомных перестроек не наблюдается уменьшения количества генов, что опять же означает, что существует минимальная пространственная предвзятость геномного расположения вариаций числа копий. [2]
Первоначально считалось, что вариация числа копий занимает чрезвычайно небольшую и незначительную часть генома, согласно цитогенетическим наблюдениям. [12] Вариации числа копий обычно были связаны только с небольшими тандемными повторами или конкретными генетическими нарушениями, [13] поэтому первоначально вариации числа копий исследовались только с точки зрения конкретных локусов. Однако технологические разработки привели к увеличению числа высокоточных способов выявления и изучения вариаций количества копий. Вариации числа копий первоначально изучались с помощью цитогенетических методов, которые позволяют наблюдать физическую структуру хромосомы. [12] Одним из таких методов является флуоресцентная гибридизация in situ (FISH), которая включает в себя вставку флуоресцентных зондов, для связывания которых требуется высокая степень комплементарности в геноме. [10] Сравнительная геномная гибридизация также широко использовалась для обнаружения изменений числа копий путем визуализации флуорофора и последующего сравнения длины хромосом. [10] Одним из основных недостатков этих ранних методов является то, что геномное разрешение относительно низкое и могут быть обнаружены только большие повторы, такие как повторы целого гена. [ нужна цитата ]
Недавние достижения в области геномных технологий привели к появлению многих важных методов, которые имеют чрезвычайно высокое геномное разрешение, и в результате сообщается об увеличении числа вариаций числа копий в геноме. [10] Первоначально эти достижения включали использование массива бактериальных искусственных хромосом (BAC) с интервалами около 1 мегабазы по всему гену. [14] BAC также могут обнаруживать вариации числа копий в горячих точках перестройки, что позволяет обнаруживать 119 новых вариаций числа копий. [2] Высокопроизводительное геномное секвенирование произвело революцию в области геномики человека, и были проведены исследования in silico для обнаружения вариаций числа копий в геноме. [2] Эталонные последовательности сравнивали с другими представляющими интерес последовательностями с использованием фосмид , строго контролируя размер фосмидных клонов до 40 т.п.н. [15] Считывание концов секвенирования предоставит достаточную информацию для выравнивания эталонной последовательности с интересующей последовательностью, и любые несовпадения легко заметны, таким образом, можно сделать вывод, что это вариации количества копий внутри этой области клона. [15] Этот тип метода обнаружения обеспечивает высокое геномное разрешение и точное расположение повтора в геноме, а также может обнаруживать другие типы структурных изменений, таких как инверсии. [10]
Кроме того, еще один способ обнаружения вариаций числа копий — использование однонуклеотидных полиморфизмов (SNP). [10] Из-за обилия данных об SNP человека направление обнаружения изменения количества копий изменилось в сторону использования этих SNP. [16] Основываясь на том факте, что рекомбинация у человека относительно редка и что многие события рекомбинации происходят в определенных областях генома, известных как горячие точки рекомбинации, неравновесие по сцеплению можно использовать для идентификации вариаций числа копий. [16] Были предприняты попытки связать вариации числа копий с конкретными SNP гаплотипов путем анализа неравновесия по сцеплению. Используя эти ассоциации, можно распознать вариации числа копий в геноме, используя SNP в качестве маркеров. Методы секвенирования следующего поколения , включая секвенирование короткого и длинного считывания, в настоящее время все чаще используются и начали заменять методы на основе массивов для обнаружения изменений количества копий. [17] [18] В отличие от методов на основе массивов, методы обнаружения на основе секвенирования легко идентифицируют другие классы структурных вариаций , такие как инверсии и транслокации . [ нужна цитата ]
Существует два основных типа молекулярного механизма формирования вариаций числа копий: гомологичный и негомологичный. [5] Хотя было выдвинуто множество предположений, большинство из этих теорий являются предположениями и предположениями. Не существует убедительных доказательств того, что определенное изменение количества копий коррелирует с конкретным механизмом.
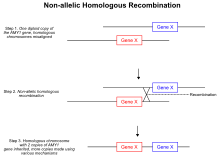
Одной из наиболее известных теорий, которая приводит к вариациям числа копий, а также к делециям и инверсиям, является неаллельная гомологичная рекомбинация . [19] Во время мейотической рекомбинации гомологичные хромосомы объединяются в пары и образуют двухконцевые двухцепочечные разрывы, ведущие к соединениям Холлидея . Однако при аберрантном механизме во время образования соединений Холлидея двухцепочечные разрывы смещаются, и кроссинговер оказывается в неаллельных положениях на одной и той же хромосоме. Когда соединение Холлидея разрешается, событие неравного кроссинговера обеспечивает перенос генетического материала между двумя гомологичными хромосомами, и в результате часть ДНК на обоих гомологах повторяется. [19] Поскольку повторяющиеся участки больше не разделяются независимо , дублированный участок хромосомы передается по наследству. Другой тип механизма, основанного на гомологичной рекомбинации, который может привести к изменению числа копий, известен как репликация, индуцированная разрывом. [20] Когда в геноме неожиданно происходит двухцепочечный разрыв, клетка активирует пути, которые опосредуют восстановление разрыва. [20] Ошибки в восстановлении разрыва, подобные неаллельной гомологичной рекомбинации, могут привести к увеличению числа копий определенного участка генома. Во время восстановления двухцепочечного разрыва разорванный конец может проникнуть в гомологичную хромосому вместо того, чтобы воссоединиться с исходной цепью. [20] Как и в случае неаллельного механизма гомологичной рекомбинации, дополнительная копия определенной области переносится на другую хромосому, что приводит к событию дупликации. Кроме того, обнаружено, что белки когезины помогают в системе восстановления двухцепочечных разрывов, зажимая два конца в непосредственной близости, что предотвращает межхромосомную инвазию концов. [21] Если по какой-либо причине, например, из-за активации рибосомальной РНК , активность когезина нарушена, то может наблюдаться локальное увеличение ошибок репарации двухцепочечных разрывов. [21]
Другой класс возможных механизмов, которые, как предполагается, приводят к изменениям числа копий, основан на негомологии. Чтобы отличить этот механизм от механизмов, основанных на гомологии, необходимо понимать концепцию гомологии. Гомологическое спаривание хромосом предполагает использование цепей ДНК, которые очень похожи друг на друга (~ 97%), и эти цепи должны быть длиннее определенной длины, чтобы избежать коротких, но очень похожих спариваний. [5] С другой стороны, негомологичные пары основаны только на нескольких парах оснований, имеющих сходство между двумя цепями, поэтому генетический материал может обмениваться или дублироваться в процессе негомологичного двухцепочечного восстановления. [5]
One type of non-homologous based mechanism is the non-homologous end joining or micro-homology end joining mechanism.[22] These mechanisms are also involved in repairing double stranded breaks but require no homology or limited micro-homology.[5] When these strands are repaired, oftentimes there are small deletions or insertions added into the repaired strand. It is possible that retrotransposons are inserted into the genome through this repair system.[22] If retrotransposons are inserted into a non-allelic position on the chromosome, meiotic recombination can drive the insertion to be recombined into the same strand as an already existing copy of the same region. Another mechanism is the break-fusion-bridge cycle which involves sister chromatids that have both lost its telomeric region due to double stranded breaks.[23] It is proposed that these sister chromatids will fuse together to form one dicentric chromosome, and then segregate into two different nuclei.[23] Because pulling the dicentric chromosome apart causes a double stranded break, the end regions can fuse to other double stranded breaks and repeat the cycle.[23] The fusion of two sister chromatids can cause inverted duplication and when these events are repeated throughout the cycle, the inverted region will be repeated leading to an increase in copy number.[23] The last mechanism that can lead to copy number variations is polymerase slippage, which is also known as template switching.[24] During normal DNA replication, the polymerase on the lagging strand is required to unclamp and re-clamp the replication region continuously.[24] When small scale repeats in the DNA sequence exist already, the polymerase can be 'confused' when it re-clamps to continue replication and instead of clamping to the correct base pairs, it may shift a few base pairs and replicate a portion of the repeated region again.[24] Note that although this has been experimentally observed and is a widely accepted mechanism, the molecular interactions that led to this error remains unknown. In addition, because this type of mechanism requires the polymerase to jump around the DNA strand and it is unlikely that the polymerase can re-clamp at another locus some kilobases apart, therefore this is more applicable to short repeats such as dinucleotide or trinucleotide repeats.[25]

Амилаза — это фермент слюны, который отвечает за расщепление крахмала на моносахариды , а один тип амилазы кодируется геном альфа-амилазы ( AMY1 ). [9] Локус AMY1 , а также фермент амилаза, являются одним из наиболее тщательно изученных и секвенированных генов в геноме человека. Его гомологи также обнаружены у других приматов, и поэтому вполне вероятно, что ген AMY1 примата является предком гена AMY1 человека и был адаптирован на ранних этапах эволюции приматов. [9] AMY1 — один из наиболее хорошо изученных генов, число копий которого варьируется в широком диапазоне в разных популяциях человека. [9] Ген AMY1 также является одним из немногих изученных генов, которые продемонстрировали убедительные доказательства, коррелирующие его белковую функцию с количеством его копий . [9] Известно, что количество копий изменяет транскрипцию , а также уровни трансляции конкретного гена, однако исследования показали, что взаимосвязь между уровнями белка и количеством копий является переменной. [26] В генах AMY1 американцев европейского происхождения обнаружено, что концентрация амилазы слюны тесно коррелирует с числом копий гена AMY1 . [9] В результате была выдвинута гипотеза, что количество копий гена AMY1 тесно коррелирует с его белковой функцией, которая заключается в переваривании крахмала. [9]
Было обнаружено, что количество копий гена AMY1 коррелирует с разными уровнями крахмала в рационе разных групп населения. [9] Восемь популяций с разных континентов были разделены на диеты с высоким содержанием крахмала и диеты с низким содержанием крахмала, а количество копий их гена AMY1 было визуализировано с использованием FISH высокого разрешения и qPCR . [9] Было обнаружено, что популяции с высоким содержанием крахмала, которые состоят из японцев, хадза и американцев европейского происхождения, имели значительно более высокое (в два раза) среднее число копий AMY1 , чем популяции с низким содержанием крахмала, включая Биаку, Мбути, Датога и Якутское население. [9] Была выдвинута гипотеза, что уровень крахмала в обычном рационе человека, субстрата AMY1, может напрямую влиять на количество копий гена AMY1 . [9] Поскольку был сделан вывод, что количество копий AMY1 напрямую коррелирует с амилазой слюны, [9] чем больше крахмала присутствует в ежедневном рационе населения, тем более эволюционно благоприятно иметь несколько копий гена AMY1 . Ген AMY1 был первым геном, который предоставил убедительные доказательства эволюции на молекулярно-генетическом уровне. [26] Кроме того, с помощью сравнительной геномной гибридизации было проведено сравнение вариаций числа копий всех геномов японской популяции с таковой у якутской популяции. [9] Было обнаружено, что вариация числа копий гена AMY1 значительно отличалась от вариаций числа копий в других генах или областях генома, что позволяет предположить, что ген AMY1 находился под сильным селективным давлением, которое практически не влияло на другие варианты количества копий. [9] Наконец, изменчивость длины 783 микросателлитов между двумя популяциями сравнивалась с изменчивостью числа копий гена AMY1 . Было обнаружено, что диапазон числа копий гена AMY1 был больше, чем у более чем 97% исследованных микросателлитов. [9] Это означает, что естественный отбор сыграл значительную роль в формировании среднего количества генов AMY1 в этих двух популяциях. [9] Однако, поскольку были изучены только шесть популяций, важно учитывать возможность того, что в их рационе или культуре могут быть и другие факторы, влияющие на количество копий AMY1 , помимо крахмала.

Хотя неясно, когда число копий гена AMY1 начало увеличиваться, известно и подтверждено, что ген AMY1 существовал у ранних приматов. Было обнаружено, что у шимпанзе , ближайших эволюционных родственников человека, имеются две диплоидные копии гена AMY1 , которые по длине идентичны человеческому гену AMY1, [9] что значительно меньше, чем у человека. С другой стороны, у бонобо , также близкого родственника современного человека, обнаружено более двух диплоидных копий гена AMY1 . [9] Тем не менее, гены AMY1 бонобо были секвенированы и проанализированы, и было обнаружено, что кодирующие последовательности генов AMY1 были нарушены, что может привести к выработке дисфункциональной амилазы слюны. [9] Из результатов можно сделать вывод, что увеличение числа копий AMY1 у бонобо , вероятно, не коррелирует с количеством крахмала в их рационе. Была также выдвинута гипотеза, что увеличение числа копий началось недавно, во время ранней эволюции гомининов , поскольку ни у одного из человекообразных обезьян не было более двух копий гена AMY1 , который продуцировал функциональный белок. [9] Кроме того, было высказано предположение, что увеличение числа копий AMY1 началось около 20 000 лет назад, когда люди перешли от образа жизни охотников-собирателей к земледельческому обществу, что также было тогда, когда люди в значительной степени полагались на корнеплоды с высоким содержанием крахмала. [9] Эта гипотеза, хотя и логична, не имеет экспериментальных доказательств из-за трудностей со сбором информации об изменении рациона человека, особенно о корнеплодах с высоким содержанием крахмала, поскольку их невозможно непосредственно наблюдать или тестировать. Недавние прорывы в секвенировании ДНК позволили исследователям секвенировать более старые ДНК, такие как ДНК неандертальцев , с определенной степенью точности. Возможно, секвенирование ДНК неандертальцев может предоставить временной маркер того, когда число копий гена AMY1 увеличилось, и дать представление о питании человека и эволюции генов.
В настоящее время неизвестно, какой механизм привел к первоначальной дупликации гена амилазы, и это может означать, что вставка ретровирусных последовательностей произошла из-за негомологичного соединения концов, что вызвало дупликацию гена AMY1 . [27] Однако в настоящее время нет никаких доказательств в поддержку этой теории, и поэтому эта гипотеза остается гипотезой. Недавнее появление мультикопийного гена AMY1 означает, что в зависимости от окружающей среды количество копий гена AMY1 может очень быстро увеличиваться и уменьшаться по сравнению с генами, которые не взаимодействуют напрямую с окружающей средой. [26] Ген AMY1 является отличным примером того, как дозировка гена влияет на выживание организма в данной среде. Множественные копии гена AMY1 дают тем, кто в большей степени придерживается диеты с высоким содержанием крахмала, эволюционное преимущество, поэтому большое количество копий гена сохраняется в популяции. [26]
Среди нейронов человеческого мозга часто встречаются соматически обусловленные вариации числа копий. [28] Вариации числа копий демонстрируют широкую вариабельность (от 9 до 100% нейронов головного мозга в разных исследованиях). Размер большинства изменений составляет от 2 до 10 МБ, при этом количество делеций намного превышает число амплификаций. [28] Вариации числа копий в клетках головного мозга выше, чем в других типах клеток. [28] Вероятным источником изменения числа копий является неправильное восстановление повреждений ДНК . [ нужна цитата ]
Геномная дупликация и трипликация гена, по-видимому, являются редкой причиной болезни Паркинсона , хотя и более распространенной, чем точечные мутации. [29]
Варианты числа копий в гене RCL1 связаны с рядом нейропсихиатрических фенотипов у детей. [30]

Недавно обсуждалась связь вариаций числа копий с семействами генов . Семейства генов определяются как набор родственных генов, которые выполняют сходные функции, но имеют незначительные временные или пространственные различия, и эти гены, вероятно, произошли от одного предкового гена. [26] Основная причина, по которой вариации числа копий связаны с семействами генов, заключается в том, что существует вероятность того, что гены в семье могли произойти от одного предкового гена, который дублировался в разные копии. [26] Мутации со временем накапливаются в генах, и под воздействием естественного отбора, действующего на гены, некоторые мутации приводят к экологическим преимуществам, позволяя этим генам наследоваться и в конечном итоге отделяться четкие семейства генов. Примером семейства генов, которое могло быть создано в результате изменения числа копий, является семейство генов глобина . Семейство глобиновых генов представляет собой сложную сеть генов, состоящую из генов альфа- и бета- глобина, включая гены, которые экспрессируются как у эмбрионов, так и у взрослых особей, а также псевдогены . [31] Все эти глобиновые гены в семействе глобинов хорошо консервативны и отличаются лишь небольшой частью гена, что указывает на то, что они произошли от общего предкового гена, возможно, из-за дупликации исходного глобинового гена. [31]
Исследования показали, что вариации числа копий значительно чаще встречаются в генах, которые кодируют белки, которые напрямую взаимодействуют с окружающей средой, чем в белках, которые участвуют в основной клеточной деятельности. [32] Было высказано предположение, что эффект дозы гена, сопровождающий изменение числа копий, может привести к пагубным последствиям, если основные клеточные функции будут нарушены, поэтому белки, участвующие в клеточных путях, подвергаются строгому очищающему отбору . [32] Кроме того, белки функционируют вместе и взаимодействуют с белками других путей, поэтому важно рассматривать влияние естественного отбора на биомолекулярные пути, а не на отдельные белки. При этом было обнаружено, что белки на периферии пути обогащены вариациями числа копий, тогда как белки в центре путей обеднены вариациями числа копий. [33] Было объяснено, что белки на периферии пути взаимодействуют с меньшим количеством белков, и поэтому изменение дозировки белка, вызванное изменением числа копий, может иметь меньшее влияние на общий результат клеточного пути. [33]
В последние несколько лет исследователи, похоже, сместили свое внимание с обнаружения, локализации и секвенирования вариаций числа копий на углубленный анализ роли этих вариаций числа копий в геноме человека и в природе в целом. Необходимы доказательства для дальнейшего подтверждения связи между вариациями числа копий и семействами генов, а также роли, которую естественный отбор играет в формировании этих отношений и изменений. Кроме того, исследователи также стремятся выяснить молекулярные механизмы, участвующие в вариациях числа копий, поскольку это может раскрыть важную информацию о структурных вариациях в целом. Сделав шаг назад, можно сказать, что область структурных вариаций человеческого генома кажется быстро растущей темой исследований. Эти исследовательские данные не только могут предоставить дополнительные доказательства эволюции и естественного отбора, но также могут быть использованы для разработки методов лечения широкого спектра генетических заболеваний. [ нужна цитата ]