Клавулановая кислота — это β-лактамный препарат , который действует как ингибитор β-лактамазы на основе механизма . Хотя сам по себе он не эффективен как антибиотик , в сочетании с антибиотиками группы пенициллина он может преодолеть устойчивость к антибиотикам у бактерий , которые секретируют β-лактамазу , которая в противном случае инактивирует большинство пенициллинов.
В наиболее распространенных препаратах клавуланат калия (клавулановая кислота в виде соли калия) сочетается с:
Клавулановая кислота была запатентована в 1974 году. [3] Помимо ингибирования β-лактамазы, клавулановая кислота проявляет нецелевую активность в нервной системе , повышая регуляцию транспортера глутамата 1 (GLT-1) и изучалась в качестве потенциального средства лечения различных расстройств центральной нервной системы . [1] [4]
Амоксициллин-клавулановая кислота является препаратом первой линии для многих типов инфекций, включая инфекции околоносовых пазух и инфекции мочевыводящих путей , включая пиелонефрит . Это отчасти связано с его эффективностью против грамотрицательных бактерий, которые, как правило, сложнее контролировать, чем грамположительные бактерии, с помощью химиотерапевтических антибиотиков. [ необходимо уточнение ]
Использование клавулановой кислоты с пенициллинами было связано с увеличением частоты холестатической желтухи и острого гепатита во время терапии или вскоре после нее. Сопутствующая желтуха обычно является самоограничивающейся и очень редко приводит к летальному исходу. [5] [6]
Комитет по безопасности лекарственных средств Великобритании (CSM) рекомендует, чтобы такие препараты, как амоксициллин/клавулановая кислота, применялись только в случае бактериальных инфекций, которые, вероятно, вызваны штаммами, продуцирующими β-лактамазу, устойчивыми к амоксициллину, и чтобы лечение обычно не превышало 14 дней.
Сообщалось об аллергических реакциях . [7]
Название происходит от штамма Streptomyces clavuligerus , который вырабатывает клавулановую кислоту. [8] [9]

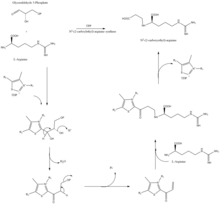
β - лактамоподобная структура клавулановой кислоты выглядит структурно похожей на пенициллин , но биосинтез этой молекулы включает другой биохимический путь. Клавулановая кислота вырабатывается бактерией Streptomyces clavuligerus , используя глицеральдегид-3-фосфат и L -аргинин в качестве исходных материалов. [10] [11] Хотя каждый из промежуточных продуктов пути известен, точный механизм всех ферментативных реакций до конца не изучен. В этом процессе в основном участвуют 3 фермента: клаваминатсинтаза , β-лактамсинтаза и N 2 -(2-карбоксиэтил)-L-аргинин (CEA) синтаза . [10] Клаваминатсинтаза является негемовой оксигеназой, зависящей от железа и α-кетоглутарата , и кодируется orf5 кластера генов клавулановой кислоты . Конкретный механизм работы этого фермента не полностью изучен, но этот фермент регулирует 3 этапа в общем синтезе клавулановой кислоты. Все 3 этапа происходят в одной и той же области каталитического, содержащего железо реакционного центра, но не происходят последовательно и затрагивают различные области структуры клавулановой кислоты. [12]
β-лактамсинтетаза – это белок массой 54,5 кДа, который кодируется геном orf3 кластера генов клавулановой кислоты и имеет сходство с аспарагинсинтазой – ферментами класса B. Точный механизм работы этого фермента для синтеза β-лактама не доказан, но считается, что он работает в координации с CEA-синтазой и АТФ . [13]

Синтаза CEA представляет собой белок 60,9 кДа и является первым геном, обнаруженным в кластере генов биосинтеза клавулановой кислоты, кодируемом orf2 кластера генов клавулановой кислоты. Конкретный механизм работы этого фермента все еще изучается; однако известно, что этот фермент обладает способностью связывать глицеральдегид-3-фосфат с L-аргинином в присутствии тиаминдифосфата (TDP или тиаминпирофосфата ), что является первым этапом биосинтеза клавулановой кислоты. [14]
Клавулановая кислота была открыта примерно в 1974-75 годах британскими учеными, работавшими в фармацевтической компании Beecham, из бактерий Streptomyces clavuligerus . [15] После нескольких попыток Beecham наконец подала заявку на патентную защиту препарата в США в 1981 году, и в 1985 году были выданы патенты США 4,525,352, 4,529,720 и 4,560,552.
Клавулановая кислота обладает незначительной внутренней антимикробной активностью, несмотря на то, что разделяет β-лактамное кольцо, характерное для β-лактамных антибиотиков . Однако сходство химической структуры позволяет молекуле взаимодействовать с ферментом β-лактамазой, секретируемым некоторыми бактериями, и обеспечивать устойчивость к β-лактамным антибиотикам.
Клавулановая кислота является ингибитором самоубийства , ковалентно связываясь с остатком серина в активном центре β-лактамазы. Это реструктурирует молекулу клавулановой кислоты, создавая гораздо более реактивные виды, которые атакуют другую аминокислоту в активном центре, постоянно инактивируя ее и, таким образом, инактивируя фермент.
Это ингибирование восстанавливает антимикробную активность β-лактамных антибиотиков против резистентных бактерий, секретирующих лактамазу. Несмотря на это, появились некоторые штаммы бактерий, устойчивые даже к таким комбинациям.
В 2005 году в ходе скрининга 1040 одобренных Управлением по контролю за продуктами и лекарствами (FDA) лекарственных препаратов и нутрицевтиков было обнаружено , что многие β-лактамы, такие как цефтриаксон , повышают экспрессию астроцитарного транспортера глутамата 1 (GLT-1) . [1] [16] [17] Впоследствии было обнаружено, что клавулановая кислота, также являющаяся β-лактамом, обладает таким же действием. [1] [18] Сопутствующие эффекты включают повышенную экспрессию GLT-1 в прилежащем ядре , медиальной префронтальной коре и спинном мозге , модуляцию глутаматергической , дофаминергической и серотонинергической нейротрансмиссии , а также противовоспалительное действие посредством модуляции цитокинов фактора некроза опухоли α (TNF-α) и интерлейкина-10 (IL-10). [1] [19] [4] Цефтриаксон не обладает пероральной биодоступностью , плохо проникает в мозг и обладает сопутствующей антибиотической активностью. [1] Эти ограничения привели к большему интересу к клавулановой кислоте, которая не имеет этих недостатков и является более мощной , чем цефтриаксон in vivo . [1] Механизм действия , лежащий в основе повышения регуляции экспрессии GLT-1 β-лактамами, неизвестен. [1] [17] Однако взаимодействия с белками SNARE Munc18-1 и Rab4 могут быть вовлечены в некоторые эффекты клавулановой кислоты, такие как повышенное высвобождение дофамина. [20] [21]
Что касается ее действия на центральную нервную систему , клавулановая кислота была изучена доклинически на моделях тревожности , сексуального поведения , зависимости , нейропатической боли , воспалительной боли , эпилепсии , болезни Паркинсона , деменции и инсульта . [1] [19] [ 22] [20] У животных, включая грызунов и/или обезьян, клавулановая кислота продемонстрировала анксиолитическое , антидепрессантное , просексуальное , улучшающее память , анальгезирующее , антиаддиктивное , продофаминергическое , проокситоцинергическое и нейропротекторное действие. [1] [20] [18] [23] Препарат был изучен клинически на людях при лечении эректильной дисфункции , [19] депрессии , [24] [25] [26] зависимости от психоактивных веществ , [27] и боли , [20] с положительными или смешанными предварительными результатами для этих состояний. [4] [19] [24] [26]
Клавулановая кислота официально разрабатывалась компанией Revaax Pharmaceuticals (теперь Ocuphire Pharma) для лечения эректильной дисфункции, тревожных расстройств , большого депрессивного расстройства , нейродегенеративных расстройств и болезни Паркинсона. [4] [19] [24] Однако разработка по этим показаниям была прекращена к 2014 году. [4] Кодовое название разработки клавулановой кислоты было RX-10100, а ее предварительные торговые наименования — Serdaxin и Zoraxel. [4] Хотя ее разработка была прекращена, интерес к клавулановой кислоте для потенциальных применений, связанных с нервной системой , продолжался по состоянию на 2024 год. [1] [27]