Гуморальный иммунитет — это аспект иммунитета , который опосредован макромолекулами , включая секретируемые антитела , комплементарные белки и некоторые антимикробные пептиды , расположенные во внеклеточных жидкостях . Гуморальный иммунитет так назван, потому что он включает вещества, находящиеся в гуморах или жидкостях организма . Он контрастирует с клеточно-опосредованным иммунитетом . Гуморальный иммунитет также называют иммунитетом, опосредованным антителами .
Изучение молекулярных и клеточных компонентов , формирующих иммунную систему , включая их функции и взаимодействие, является центральной наукой иммунологии . Иммунная система делится на более примитивную врожденную иммунную систему и приобретенную или адаптивную иммунную систему позвоночных , каждая из которых содержит как гуморальные, так и клеточные иммунные элементы.
Гуморальный иммунитет относится к продукции антител и сопутствующим процессам, которые ее сопровождают, включая: активацию Th2 и продукцию цитокинов , формирование зародышевого центра и переключение изотипов , а также созревание аффинности и генерацию клеток памяти . Он также относится к эффекторным функциям антител, которые включают нейтрализацию патогенов и токсинов , классическую активацию комплемента и стимулирование опсонинами фагоцитоза и элиминацию патогенов. [1]
Концепция гуморального иммунитета была разработана на основе анализа антибактериальной активности компонентов сыворотки. Гансу Бюхнеру приписывают разработку гуморальной теории. [2] В 1890 году Бюхнер описал алексины как «защитные вещества», которые существуют в сыворотке крови и других жидкостях организма и способны убивать микроорганизмы . Алексины, позже переопределенные Паулем Эрлихом как «комплементы» , оказались растворимыми компонентами врожденного ответа, который приводит к сочетанию клеточного и гуморального иммунитета. Это открытие помогло объединить черты врожденного и приобретенного иммунитета . [2]
После открытия в 1888 году бактерий, вызывающих дифтерию и столбняк , Эмиль фон Беринг и Китасато Сибасабуро показали, что болезнь не обязательно должна быть вызвана самими микроорганизмами. Они обнаружили, что для возникновения болезни достаточно фильтратов, не содержащих клеток. В 1890 году фильтраты дифтерии, позже названные дифтерийными токсинами , использовались для вакцинации животных в попытке продемонстрировать, что иммунизированная сыворотка содержит антитоксин , который может нейтрализовать активность токсина и передавать иммунитет неиммунным животным. [3] В 1897 году Пауль Эрлих показал, что антитела образуются против растительных токсинов рицина и абрина , и предположил, что эти антитела отвечают за иммунитет. [2] Эрлих вместе со своим коллегой фон Берингом продолжил разработку дифтерийного антитоксина , который стал первым крупным успехом современной иммунотерапии . [3] Открытие определенных совместимых антител стало основным инструментом в стандартизации иммунитета и идентификации затяжных инфекций . [3]
Антитела или иммуноглобулины — это гликопротеины , которые содержатся в крови и лимфе . Структурно антитела представляют собой крупные глобулярные белки в форме буквы Y. У млекопитающих существует пять типов антител: иммуноглобулин A , иммуноглобулин D , иммуноглобулин E , иммуноглобулин G и иммуноглобулин M. Каждый класс иммуноглобулинов отличается по своим биологическим свойствам и эволюционировал для борьбы с различными антигенами. [5] Антитела синтезируются и секретируются плазматическими клетками, которые происходят из В-клеток иммунной системы.
Антитело используется приобретенной иммунной системой для идентификации и нейтрализации чужеродных объектов, таких как бактерии и вирусы. Каждое антитело распознает специфический антиген, уникальный для его цели. Связывая свои специфические антигены, антитела могут вызывать агглютинацию и преципитацию продуктов антитело-антиген, подготавливать к фагоцитозу макрофагами и другими клетками , блокировать вирусные рецепторы и стимулировать другие иммунные реакции, такие как путь комплемента .
Переливание несовместимой крови вызывает реакцию переливания , которая опосредована гуморальным иммунным ответом. Этот тип реакции, называемый острой гемолитической реакцией, приводит к быстрому разрушению (гемолизу) донорских эритроцитов антителами хозяина. Причиной обычно является канцелярская ошибка, например, переливание неправильной дозы крови не тому пациенту. Симптомами являются лихорадка и озноб, иногда с болью в спине и розовой или красной мочой ( гемоглобинурия ). Главным осложнением является то, что гемоглобин, высвобождаемый при разрушении эритроцитов, может вызвать острую почечную недостаточность .
При гуморальном иммунном ответе наивные В-клетки начинают процесс созревания в костном мозге, приобретая В-клеточные рецепторы (BCR) вдоль поверхности клетки. [6] Эти BCR представляют собой мембраносвязанные белковые комплексы, которые имеют высокую аффинность связывания со специфическими антигенами ; эта специфичность обусловлена аминокислотной последовательностью тяжелых и легких полипептидных цепей, составляющих вариабельную область BCR. [7] Как только BCR взаимодействует с антигеном, он создает сигнал связывания, который направляет В-клетку на выработку уникального антитела , которое связывается только с этим антигеном . Затем зрелые В-клетки мигрируют из костного мозга в лимфатические узлы или другие лимфатические органы , где они начинают сталкиваться с патогенами.

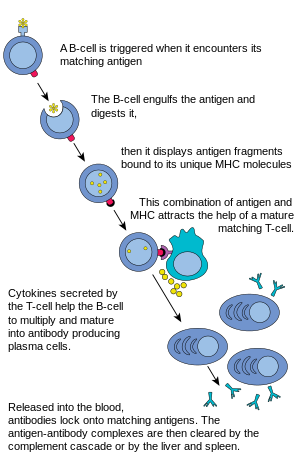
Когда В-клетка сталкивается с антигеном, активируется сигнал, антиген связывается с рецептором и попадает внутрь В-клетки путем эндоцитоза . Антиген снова обрабатывается и представляется на поверхности В-клетки белками MHC-II . Белки MHC-II распознаются хелперными Т-клетками , стимулируя выработку белков, что позволяет В-клеткам размножаться, а потомкам дифференцироваться в клетки, секретирующие антитела, циркулирующие в крови. [8] В-клетки могут быть активированы определенными микробными агентами без помощи Т-клеток и обладают способностью работать напрямую с антигенами, чтобы обеспечить ответы на присутствующие патогены. [8]
В-клетка ждет, пока хелперная Т-клетка (ТН ) свяжется с комплексом. Это связывание активирует ТН - клетку, которая затем высвобождает цитокины , которые побуждают В-клетки быстро делиться, создавая тысячи идентичных клонов В-клетки. Эти дочерние клетки становятся либо плазматическими клетками , либо клетками памяти . В-клетки памяти остаются здесь неактивными; позже, когда эти В-клетки памяти сталкиваются с тем же антигеном из-за повторного заражения, они делятся и образуют плазматичные клетки. С другой стороны, плазматичные клетки вырабатывают большое количество антител, которые свободно высвобождаются в кровеносную систему .
Эти антитела будут сталкиваться с антигенами и связываться с ними. Это либо будет мешать химическому взаимодействию между клетками хозяина и чужеродными клетками, либо они могут образовывать мосты между своими антигенными участками, препятствуя их правильному функционированию. Их присутствие также может привлекать макрофаги или клетки-киллеры, чтобы атаковать и фагоцитировать их.
Система комплемента — это биохимический каскад врожденной иммунной системы , который помогает очищать организм от патогенов. Она образуется из множества небольших белков плазмы крови, которые работают вместе, разрушая плазматическую мембрану клетки-мишени, что приводит к цитолизу клетки. Система комплемента состоит из более чем 35 растворимых и связанных с клеткой белков, 12 из которых напрямую вовлечены в пути комплемента. [1] Система комплемента участвует в деятельности как врожденного, так и приобретенного иммунитета.
Активация этой системы приводит к цитолизу, хемотаксису , опсонизации , иммунному очищению и воспалению , а также маркировке патогенов для фагоцитоза. Белки составляют 5% фракции глобулинов сыворотки . Большинство этих белков циркулируют в виде зимогенов , которые неактивны до протеолитического расщепления . [1]
Три биохимических пути активируют систему комплемента: классический путь комплемента , альтернативный путь комплемента и путь связывания маннозы с лектином . [9] Эти процессы отличаются только процессом активации C3-конвертазы , [10] который является начальным этапом активации комплемента, а последующий процесс в конечном итоге одинаков.
Классический путь инициируется воздействием свободно плавающих антигенсвязанных антител. Это приводит к ферментативному расщеплению более мелких субъединиц комплемента, которые синтезируются для формирования C3-конвертазы.
Это отличается от маннозосвязывающего лектинового пути, который инициируется бактериальными углеводными мотивами, такими как манноза, обнаруженными на поверхности бактерий. После процесса связывания происходит то же самое расщепление субъединицы и синтез, что и в классическом пути. Альтернативный путь комплемента полностью расходится с предыдущими путями, поскольку этот путь спонтанно инициируется в присутствии гидролизованного C3, который затем рекрутирует другие субъединицы, которые могут быть расщеплены с образованием C3-конвертазы. Во всех трех путях после синтеза C3-конвертазы комплементы расщепляются на субъединицы, которые либо образуют структуру, называемую комплексом мембранной атаки (MAC), на стенке бактериальной клетки, чтобы уничтожить бактерии [11], либо действуют как цитокины и хемокины, усиливая иммунный ответ.