
Поверхностное натяжение — это тенденция жидких поверхностей в состоянии покоя сжиматься до минимально возможной площади поверхности . Поверхностное натяжение — это то, что позволяет объектам с более высокой плотностью, чем у воды, таким как лезвия бритв и насекомые (например, водомерки ), плавать на поверхности воды, не погружаясь даже частично.
На границе раздела жидкость-воздух поверхностное натяжение возникает из-за большего притяжения молекул жидкости друг к другу (из-за когезии ), чем к молекулам в воздухе (из-за адгезии ). [1]
В игре задействованы два основных механизма. Один из них — это внутренняя сила, действующая на молекулы поверхности и заставляющая жидкость сжиматься. [2] [3] Второй — это тангенциальная сила, параллельная поверхности жидкости. [3] Эта тангенциальная сила обычно называется поверхностным натяжением. Чистый эффект заключается в том, что жидкость ведет себя так, как если бы ее поверхность была покрыта растянутой эластичной мембраной. Но эту аналогию не следует заходить слишком далеко, поскольку натяжение в эластичной мембране зависит от величины деформации мембраны, в то время как поверхностное натяжение является неотъемлемым свойством интерфейса жидкость — воздух или жидкость — пар. [4]
Из-за относительно высокого притяжения молекул воды друг к другу через сеть водородных связей вода имеет более высокое поверхностное натяжение (72,8 миллиньютонов (мН) на метр при 20 °C), чем большинство других жидкостей. Поверхностное натяжение является важным фактором в явлении капиллярности .
Поверхностное натяжение имеет размерность силы на единицу длины или энергии на единицу площади . [4] Эти два понятия эквивалентны, но когда речь идет об энергии на единицу площади, обычно используют термин поверхностная энергия , который является более общим термином в том смысле, что он применим также к твердым телам .
В материаловедении поверхностное натяжение используется либо для обозначения поверхностного напряжения , либо для обозначения поверхностной энергии .

Из-за сил сцепления молекула, расположенная вдали от поверхности, одинаково тянется в каждом направлении соседними молекулами жидкости, в результате чего чистая сила равна нулю. Молекулы на поверхности не имеют одинаковых молекул со всех сторон и поэтому тянутся внутрь. Это создает некоторое внутреннее давление и заставляет поверхности жидкости сжиматься до минимальной площади. [2]
Также существует натяжение, параллельное поверхности на границе раздела жидкость-воздух, которое будет противостоять внешней силе из-за когезионного характера молекул воды. [2] [3]
Силы притяжения, действующие между молекулами одного типа, называются силами сцепления, а силы сцепления между молекулами разных типов — силами адгезии. Баланс между сцеплением жидкости и ее адгезией к материалу контейнера определяет степень смачивания , угол контакта и форму мениска . Когда преобладает сцепление (в частности, энергия сцепления составляет менее половины энергии сцепления), смачивание низкое, и мениск выпуклый у вертикальной стенки (как у ртути в стеклянном контейнере). С другой стороны, когда преобладает сцепление (когда энергия сцепления составляет более половины энергии сцепления), смачивание высокое, и аналогичный мениск вогнутый (как у воды в стакане).
Поверхностное натяжение отвечает за форму капель жидкости. Хотя капли воды легко деформируются, они имеют тенденцию принимать сферическую форму из-за дисбаланса сил сцепления поверхностного слоя. При отсутствии других сил капли практически всех жидкостей имели бы приблизительно сферическую форму. Сферическая форма минимизирует необходимое «натяжение стенки» поверхностного слоя согласно закону Лапласа .

Другой способ рассмотрения поверхностного натяжения — с точки зрения энергии. Молекула, контактирующая с соседом, находится в более низком энергетическом состоянии, чем если бы она была одна. Внутренние молекулы имеют столько соседей, сколько возможно, но граничные молекулы не имеют соседей (по сравнению с внутренними молекулами) и, следовательно, имеют более высокую энергию. Чтобы жидкость минимизировала свое энергетическое состояние, количество граничных молекул с более высокой энергией должно быть минимизировано. Минимизированное количество граничных молекул приводит к минимальной площади поверхности. [5] В результате минимизации площади поверхности поверхность примет гладкую форму.
Поверхностное натяжение, представленное символом γ (альтернативно σ или T ), измеряется в силе на единицу длины . Его единицей СИ является ньютон на метр, но также используется единица СГС дина на сантиметр. Например, [6]

Поверхностное натяжение можно определить через силу или энергию.
Поверхностное натяжение γ жидкости — это сила на единицу длины. На рисунке справа прямоугольная рамка, состоящая из трех неподвижных сторон (черных), которые образуют форму буквы «U», и четвертой подвижной стороны (синей), которая может скользить вправо. Поверхностное натяжение будет тянуть синюю полосу влево; сила F, необходимая для удержания подвижной стороны, пропорциональна длине L неподвижной стороны. Таким образом, отношение Ф/Л зависит только от внутренних свойств жидкости (состава, температуры и т. д.), а не от ее геометрии. Например, если бы рамка имела более сложную форму, то отношение Ф/Л , где L — длина подвижной стороны, а F — сила, необходимая для остановки скольжения, оказывается одинаковой для всех форм. Поэтому мы определяем поверхностное натяжение как
Причина 1/2 заключается в том, что пленка имеет две стороны (две поверхности), каждая из которых вносит одинаковый вклад в силу; поэтому сила, вносимая одной стороной, равна γL = Ф/2 .
Поверхностное натяжение γ жидкости — это отношение изменения энергии жидкости к изменению площади поверхности жидкости (которое привело к изменению энергии). Это можно легко связать с предыдущим определением в терминах силы: [7] если F — это сила, необходимая для того, чтобы остановить сторону от начала скольжения, то это также сила, которая будет удерживать сторону в состоянии скольжения с постоянной скоростью (по второму закону Ньютона). Но если сторона движется вправо (в направлении приложения силы), то площадь поверхности растянутой жидкости увеличивается, в то время как приложенная сила совершает работу над жидкостью. Это означает, что увеличение площади поверхности увеличивает энергию пленки. Работа, совершаемая силой F при перемещении стороны на расстояние Δ x, равна W = F Δ x ; в то же время общая площадь пленки увеличивается на Δ A = 2 L Δ x (множитель 2 здесь потому, что у жидкости две стороны, две поверхности). Таким образом, умножая числитель и знаменатель γ = 1/2 Ф/Л по Δ x , мы получаем Эта работа W , по обычным аргументам , интерпретируется как запасенная в виде потенциальной энергии. Следовательно, поверхностное натяжение может быть также измерено в системе СИ как джоули на квадратный метр и в системе СГС как эрг на см 2 . Поскольку механические системы пытаются найти состояние минимальной потенциальной энергии , свободная капля жидкости естественным образом принимает сферическую форму, которая имеет минимальную площадь поверхности для данного объема. Эквивалентность измерения энергии на единицу площади силе на единицу длины может быть доказана с помощью размерного анализа . [8]
Несколько эффектов поверхностного натяжения можно наблюдать на примере обычной воды:
Поверхностное натяжение проявляется и в других распространенных явлениях, особенно когда для его уменьшения используются поверхностно-активные вещества :

Если никакая сила не действует нормально на натянутую поверхность, поверхность должна оставаться плоской. Но если давление на одной стороне поверхности отличается от давления на другой стороне, разница давлений, умноженная на площадь поверхности, приводит к нормальной силе. Для того чтобы силы поверхностного натяжения отменили силу, вызванную давлением, поверхность должна быть искривлена. Диаграмма показывает, как кривизна поверхности крошечного участка поверхности приводит к чистому компоненту сил поверхностного натяжения, действующих нормально к центру участка. Когда все силы уравновешены, полученное уравнение известно как уравнение Юнга-Лапласа : [11] где:
Величина в скобках с правой стороны на самом деле (в два раза) больше средней кривизны поверхности (в зависимости от нормализации). Решения этого уравнения определяют форму капель воды, луж, менисков, мыльных пузырей и всех других форм, определяемых поверхностным натяжением (например, форму отпечатков ног водомерки на поверхности пруда). Таблица ниже показывает, как внутреннее давление капли воды увеличивается с уменьшением радиуса. Для не очень маленьких капель эффект едва заметен, но разница в давлении становится огромной, когда размеры капли приближаются к размеру молекулы. (В пределе одной молекулы эта концепция становится бессмысленной.)
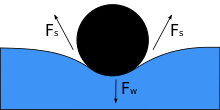
Когда объект помещается в жидкость, его вес F w давит на поверхность, и если поверхностное натяжение и направленная вниз сила становятся равными, то он уравновешивается силами поверхностного натяжения по обе стороны F s , каждая из которых параллельна поверхности воды в точках, где он соприкасается с объектом. Обратите внимание, что небольшое движение тела может привести к тому, что объект утонет. По мере уменьшения угла контакта поверхностное натяжение уменьшается. Горизонтальные компоненты двух стрелок F s указывают в противоположных направлениях, поэтому они компенсируют друг друга, но вертикальные компоненты указывают в одном направлении и, следовательно, складываются [5] , чтобы уравновесить F w . Поверхность объекта не должна быть смачиваемой, чтобы это произошло, и его вес должен быть достаточно низким, чтобы поверхностное натяжение могло его поддерживать. Если m обозначает массу иглы, а g — ускорение силы тяжести, то мы имеем

Найти форму минимальной поверхности, ограниченной некоторой произвольной формой рамки, используя строго математические методы, может быть сложной задачей. Однако, если сделать рамку из проволоки и окунуть ее в мыльный раствор, локально минимальная поверхность появится в полученной мыльной пленке в течение нескольких секунд. [8] [13]
Причина этого в том, что разница давлений на границе раздела жидкостей пропорциональна средней кривизне , как видно из уравнения Юнга-Лапласа . Для открытой мыльной пленки разница давлений равна нулю, следовательно, средняя кривизна равна нулю, а минимальные поверхности обладают свойством нулевой средней кривизны.
Поверхность любой жидкости является интерфейсом между этой жидкостью и некоторой другой средой. [примечание 1] Например, верхняя поверхность пруда является интерфейсом между водой пруда и воздухом. Поверхностное натяжение, таким образом, является не свойством одной только жидкости, а свойством интерфейса жидкости с другой средой. Если жидкость находится в контейнере, то помимо интерфейса жидкость/воздух на ее верхней поверхности, существует также интерфейс между жидкостью и стенками контейнера. Поверхностное натяжение между жидкостью и воздухом обычно отличается (больше), чем ее поверхностное натяжение со стенками контейнера. И там, где встречаются две поверхности, их геометрия должна быть такой, чтобы все силы были уравновешены. [8] [11]
Там, где встречаются две поверхности, они образуют контактный угол θ , который является углом, который касательная к поверхности образует с твердой поверхностью. Обратите внимание, что угол измеряется через жидкость , как показано на диаграммах выше. Диаграмма справа показывает два примера. Силы натяжения показаны для интерфейса жидкость-воздух, интерфейса жидкость-твердое тело и интерфейса твердое тело-воздух. Пример слева показывает, где разница между поверхностным натяжением жидкость-твердое тело и твердое тело-воздух, γ ls − γ sa , меньше, чем поверхностное натяжение жидкость-воздух, γ la , но тем не менее является положительной, то есть
На диаграмме как вертикальные, так и горизонтальные силы должны компенсироваться точно в точке контакта, известной как равновесие . Горизонтальная составляющая f la компенсируется силой сцепления f A . [8]
Однако более выразительный баланс сил находится в вертикальном направлении. Вертикальная составляющая f la должна точно компенсировать разницу сил вдоль твердой поверхности, f ls − f sa . [8]
Поскольку силы прямо пропорциональны их соответствующим поверхностным натяжениям, мы также имеем: [11]
где
Это означает, что хотя разницу между поверхностным натяжением жидкость–твердое тело и твердое тело–воздух, γ ls − γ sa , трудно измерить напрямую, ее можно вывести из поверхностного натяжения жидкость–воздух, γ la , и равновесного угла контакта θ , который является функцией легко измеряемых углов контакта при наступлении и отступлении (см. основную статью угол контакта ).
Такое же соотношение существует на диаграмме справа. Но в этом случае мы видим, что поскольку угол контакта меньше 90°, разность поверхностного натяжения жидкость–твердое тело/твердое тело–воздух должна быть отрицательной:
Обратите внимание, что в частном случае интерфейса вода–серебро, где контактный угол равен 90°, разность поверхностного натяжения жидкость–твердое тело/твердое тело–воздух равна нулю.
Другой особый случай — когда угол контакта равен точно 180°. Вода со специально подготовленным тефлоном приближается к этому. [11] Угол контакта 180° возникает, когда поверхностное натяжение жидкость–твердое тело точно равно поверхностному натяжению жидкость–воздух.

Ртутный барометр старого образца состоит из вертикальной стеклянной трубки диаметром около 1 см, частично заполненной ртутью, и с вакуумом (называемым вакуумом Торричелли ) в незаполненном объеме (см. схему справа). Обратите внимание, что уровень ртути в центре трубки выше, чем по краям, что делает верхнюю поверхность ртути куполообразной. Центр масс всего столба ртути был бы немного ниже, если бы верхняя поверхность ртути была плоской по всему поперечному сечению трубки. Но куполообразная верхняя часть дает немного меньшую площадь поверхности для всей массы ртути. Опять же, эти два эффекта объединяются, чтобы минимизировать общую потенциальную энергию. Такая форма поверхности известна как выпуклый мениск.
Мы рассматриваем площадь поверхности всей массы ртути, включая часть поверхности, которая соприкасается со стеклом, потому что ртуть вообще не прилипает к стеклу. Поэтому поверхностное натяжение ртути действует на всю ее площадь поверхности, включая место, где она соприкасается со стеклом. Если бы вместо стекла трубка была сделана из меди, ситуация была бы совсем другой. Ртуть агрессивно прилипает к меди. Поэтому в медной трубке уровень ртути в центре трубки будет ниже, чем по краям (то есть это будет вогнутый мениск). В ситуации, когда жидкость прилипает к стенкам своего контейнера, мы считаем, что часть площади поверхности жидкости, которая соприкасается с контейнером, имеет отрицательное поверхностное натяжение. Затем жидкость стремится максимизировать площадь поверхности контакта. Поэтому в этом случае увеличение площади контакта с контейнером уменьшает, а не увеличивает потенциальную энергию. Этого уменьшения достаточно, чтобы компенсировать возросшую потенциальную энергию, связанную с подъемом жидкости вблизи стенок контейнера.

Если трубка достаточно узкая и адгезия жидкости к ее стенкам достаточно сильная, поверхностное натяжение может втянуть жидкость вверх по трубке в явлении, известном как капиллярное действие . Высота, на которую поднимается столб, определяется законом Жюрина : [8]
где


Если налить ртуть на горизонтальный плоский лист стекла, получится лужа , толщина которой будет ощутимой. Лужа растечется только до точки, где ее толщина составит чуть меньше половины сантиметра, и не тоньше. Опять же, это происходит из-за действия сильного поверхностного натяжения ртути. Жидкая масса выравнивается, потому что это приводит к тому, что как можно больше ртути оказывается на максимально низком уровне, но поверхностное натяжение в то же время действует, чтобы уменьшить общую площадь поверхности. Результатом компромисса является лужа почти фиксированной толщины.
Такую же демонстрацию поверхностного натяжения можно провести с водой, известковой водой или даже солевым раствором, но только на поверхности, сделанной из вещества, к которому вода не прилипает. Воск является таким веществом. Вода, вылитая на гладкую, плоскую, горизонтальную восковую поверхность, скажем, на вощеный лист стекла, будет вести себя так же, как ртуть, вылитая на стекло.
Толщина лужи жидкости на поверхности, контактный угол которой составляет 180°, определяется по формуле: [11]
где

В действительности толщина луж будет немного меньше, чем предсказывает приведенная выше формула, поскольку очень немногие поверхности имеют угол контакта 180° с любой жидкостью. Когда угол контакта меньше 180°, толщина определяется по формуле: [11]
Для ртути на стекле γ Hg = 487 дин/см, ρ Hg = 13,5 г/см 3 и θ = 140°, что дает h Hg = 0,36 см. Для воды на парафине при 25 °C γ = 72 дин/см, ρ = 1,0 г/см 3 и θ = 107°, что дает h H 2 O = 0,44 см.
Формула также предсказывает, что когда угол контакта равен 0°, жидкость растечется по поверхности в микротонкий слой. Такая поверхность считается полностью смачиваемой жидкостью.

В повседневной жизни все мы наблюдаем, что струя воды, вытекающая из крана, распадается на капли, независимо от того, насколько плавно струя вытекает из крана. Это происходит из-за явления, называемого неустойчивостью Плато-Рэлея [11] , которое является целиком следствием эффектов поверхностного натяжения.
Объяснение этой нестабильности начинается с существования крошечных возмущений в потоке. Они всегда присутствуют, независимо от того, насколько гладким является поток. Если возмущения разложить на синусоидальные компоненты, мы обнаружим, что некоторые компоненты растут со временем, а другие затухают со временем. Среди тех, которые растут со временем, некоторые растут быстрее, чем другие. Затухает ли компонент или растет, и насколько быстро он растет, полностью зависит от его волнового числа (меры того, сколько пиков и впадин на сантиметр) и радиусов исходного цилиндрического потока.
Дж. У. Гиббс разработал термодинамическую теорию капиллярности, основанную на идее поверхностей разрыва. [14] Гиббс рассмотрел случай резкой математической поверхности, помещенной где-то внутри микроскопически размытого физического интерфейса, существующего между двумя однородными веществами. Понимая, что точный выбор местоположения поверхности был несколько произвольным, он оставил ее гибкой. Поскольку интерфейс существует в тепловом и химическом равновесии с веществами вокруг него (имеющими температуру T и химические потенциалы μ i ), Гиббс рассмотрел случай, когда поверхность может иметь избыточную энергию, избыточную энтропию и избыточные частицы, обнаружив, что естественная функция свободной энергии в этом случае равна , величине, позже названной большим потенциалом и получившей символ .
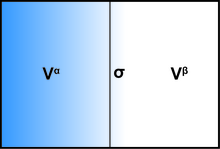
Рассматривая заданный подобъем, содержащий поверхность разрыва, объем делится математической поверхностью на две части A и B, с объемами и , с точно. Теперь, если бы две части A и B были однородными жидкостями (с давлениями , ) и оставались совершенно однородными вплоть до математической границы, без каких-либо поверхностных эффектов, общий большой потенциал этого объема был бы просто . Интересующие поверхностные эффекты являются модификацией этого, и все они могут быть собраны в термин свободной энергии поверхности, так что общий большой потенциал объема становится:
Для достаточно макроскопических и плавно изогнутых поверхностей свободная энергия поверхности должна быть просто пропорциональна площади поверхности: [14] [15] для поверхностного натяжения и площади поверхности .
Как указано выше, это означает, что механическая работа, необходимая для увеличения площади поверхности A, равна dW = γ dA , предполагая, что объемы с каждой стороны не меняются. Термодинамика требует, чтобы для систем, находящихся при постоянном химическом потенциале и температуре, все спонтанные изменения состояния сопровождались уменьшением этой свободной энергии , то есть увеличением полной энтропии с учетом возможного перемещения энергии и частиц с поверхности в окружающие жидкости. Из этого легко понять, почему уменьшение площади поверхности массы жидкости всегда происходит спонтанно , при условии, что оно не связано с какими-либо другими изменениями энергии. Из этого следует, что для увеличения площади поверхности необходимо добавить определенное количество энергии.
Гиббс и другие ученые боролись с произвольностью в точном микроскопическом размещении поверхности. [16] Для микроскопических поверхностей с очень малой кривизной неправильно предполагать, что поверхностное натяжение не зависит от размера, и в игру вступают такие темы, как длина Толмена . Для поверхности макроскопического размера (и плоских поверхностей) размещение поверхности не оказывает существенного влияния на γ ; однако, оно оказывает очень сильное влияние на значения поверхностной энтропии, поверхностной избыточной плотности массы и поверхностной внутренней энергии, [14] : 237 которые являются частными производными функции поверхностного натяжения .
Гиббс подчеркивал, что для твердых тел поверхностная свободная энергия может полностью отличаться от поверхностного напряжения (того, что он называл поверхностным натяжением): [14] : 315 поверхностная свободная энергия — это работа, необходимая для формирования поверхности, в то время как поверхностное напряжение — это работа, необходимая для растяжения поверхности. В случае двухжидкостного интерфейса нет различия между формированием и растяжением, поскольку жидкости и поверхность полностью восстанавливают свою природу, когда поверхность растягивается. Для твердого тела растяжение поверхности, даже упругое, приводит к принципиально измененной поверхности. Кроме того, поверхностное напряжение на твердом теле является направленной величиной ( тензором напряжений ), в то время как поверхностная энергия является скалярной.
Спустя пятнадцать лет после Гиббса Дж. Д. Ван дер Ваальс разработал теорию капиллярных эффектов, основанную на гипотезе непрерывного изменения плотности. [17] Он добавил к плотности энергии член где c — коэффициент капиллярности, а ρ — плотность. Для многофазных равновесий результаты подхода Ван дер Ваальса практически совпадают с формулами Гиббса, но для моделирования динамики фазовых переходов подход Ван дер Ваальса гораздо удобнее. [18] [19] Капиллярная энергия Ван дер Ваальса в настоящее время широко используется в моделях фазового поля многофазных течений. Такие члены обнаружены также в динамике неравновесных газов. [20]
Давление внутри идеального сферического пузырька можно вывести из термодинамических соображений свободной энергии. [15] Вышеуказанную свободную энергию можно записать как: где — разность давлений между внутренней (A) и внешней (B) частью пузырька, а — объем пузырька. В равновесии d Ω = 0 , и поэтому,
Для сферического пузыря объем и площадь поверхности определяются просто как и
Подставляя эти соотношения в предыдущее выражение, находим, что эквивалентно уравнению Юнга–Лапласа при R x = R y .

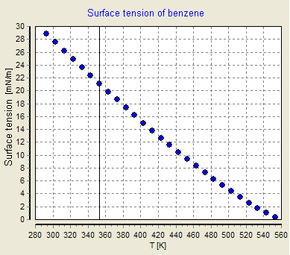
Поверхностное натяжение зависит от температуры. По этой причине, когда дается значение поверхностного натяжения интерфейса, температура должна быть указана явно. Общая тенденция заключается в том, что поверхностное натяжение уменьшается с ростом температуры, достигая значения 0 при критической температуре . Для получения более подробной информации см. правило Этвеша . Существуют только эмпирические уравнения, связывающие поверхностное натяжение и температуру:
И Гуггенхайм-Катаяма, и Этвеш принимают во внимание тот факт, что поверхностное натяжение достигает 0 при критической температуре, тогда как Рамей и Шилдс не могут соотнестись с реальностью в этой конечной точке.
Растворенные вещества могут оказывать различное влияние на поверхностное натяжение в зависимости от природы поверхности и растворенного вещества:
Эффект усложняется тем, что растворенное вещество может существовать в другой концентрации на поверхности растворителя, чем в его объеме. Эта разница варьируется от одной комбинации растворенное вещество-растворитель к другой.
Изотерма Гиббса гласит, что:
При ее выводе принимаются определенные допущения, поэтому изотерму Гиббса можно применять только к идеальным (очень разбавленным) растворам с двумя компонентами.
Соотношение Клаузиуса –Клапейрона приводит к другому уравнению, также приписываемому Кельвину, как уравнение Кельвина . Оно объясняет, почему из-за поверхностного натяжения давление пара для небольших капель жидкости в суспензии больше, чем стандартное давление пара той же жидкости, когда интерфейс плоский. То есть, когда жидкость образует небольшие капли, равновесная концентрация ее пара в ее окружении больше. Это возникает из-за того, что давление внутри капли больше, чем снаружи. [25]
Эффект объясняет пересыщение паров. При отсутствии центров зародышеобразования должны образоваться крошечные капли, прежде чем они смогут превратиться в более крупные капли. Для этого требуется давление пара, во много раз превышающее давление пара в точке фазового перехода . [25]
Это уравнение также используется в химии катализаторов для оценки мезопористости твердых веществ. [26]
Эффект можно рассматривать с точки зрения среднего числа молекулярных соседей поверхностных молекул (см. диаграмму).
В таблице приведены некоторые расчетные значения этого эффекта для воды при разных размерах капель:
Эффект становится очевидным для очень малых размеров капель, поскольку капля радиусом 1 нм содержит около 100 молекул внутри, что является достаточно малым количеством, требующим квантово-механического анализа.
Поскольку поверхностное натяжение проявляется в различных эффектах, оно предлагает ряд путей для его измерения. Какой метод является оптимальным, зависит от природы измеряемой жидкости, условий, при которых измеряется ее натяжение, и стабильности ее поверхности при деформации. Прибор, измеряющий поверхностное натяжение, называется тензиометром.
Поверхностное натяжение чистой жидкой воды в контакте с ее парами было определено IAPWS [38] как
где и T , и критическая температура T C = 647,096 K выражены в кельвинах . Областью действия является вся кривая насыщения пар-жидкость от тройной точки (0,01 °C) до критической точки. Она также дает разумные результаты при экстраполяции на метастабильные (переохлажденные) условия, по крайней мере до −25 °C. Эта формулировка была первоначально принята IAPWS в 1976 году и скорректирована в 1994 году для соответствия Международной температурной шкале 1990 года.
Неопределенность этой формулировки дается для всего диапазона температур IAPWS. [38] Для температур ниже 100 °C неопределенность составляет ±0,5%.
Наяр и др. [39] опубликовали справочные данные для поверхностного натяжения морской воды в диапазоне солености 20 ≤ S ≤ 131 г/кг и диапазоне температур 1 ≤ t ≤ 92 °C при атмосферном давлении. Диапазон температуры и солености охватывает как океанографический диапазон, так и диапазон условий, встречающихся в технологиях термического опреснения . Неопределенность измерений варьировалась от 0,18 до 0,37 мН/м, при этом средняя неопределенность составила 0,22 мН/м.
Наяр и др. сопоставили данные со следующим уравнением , где γ sw — поверхностное натяжение морской воды в мН/м, γ w — поверхностное натяжение воды в мН/м, S — эталонная соленость [40] в г/кг, а t — температура в градусах Цельсия. Среднее абсолютное процентное отклонение между измерениями и корреляцией составило 0,19%, а максимальное отклонение — 0,60%.
Международная ассоциация по свойствам воды и пара (IAPWS) приняла эту корреляцию в качестве международного стандартного руководства. [41]