Исследование эволюции старения или старения направлено на то, чтобы объяснить, почему такой пагубный процесс, как старение, эволюционировал, и почему существует такая большая изменчивость в продолжительности жизни организмов . Классические теории эволюции ( накопление мутаций , антагонистическая плейотропия и одноразовая сома ) [1] [2] [3] предполагают, что факторы окружающей среды, такие как хищничество, несчастные случаи, болезни и/или голодание, гарантируют, что большинство организмов, живущих в естественных условиях, не доживут до старости, и поэтому будет очень мало давления, чтобы сохранить генетические изменения, которые увеличивают продолжительность жизни. Вместо этого естественный отбор будет сильно благоприятствовать генам, которые обеспечивают раннее созревание и быстрое размножение, а отбор генетических признаков , которые способствуют молекулярному и клеточному самоподдержанию, будет снижаться с возрастом для большинства организмов. [4]
Август Вейсман был ответственен за интерпретацию и формализацию механизмов эволюции Дарвина в современной теоретической структуре. В 1889 году он выдвинул теорию, что старение является частью программы жизни, чтобы освободить место для следующего поколения, чтобы поддерживать оборот, необходимый для эволюции. [5] Идея о том, что характеристика старения была выбрана (адаптация) из-за ее пагубного эффекта, в значительной степени игнорировалась большую часть 20-го века, но теоретическая модель предполагает, что альтруистическое старение может развиться, если миграция между популяциями невелика. [6] Позже Вейсман отказался от своей теории и через некоторое время продолжил с помощью своей теории «запрограммированной смерти». [ необходима цитата ]
Естественный отбор — это процесс, который позволяет организмам лучше адаптироваться к окружающей среде, это выживание наиболее приспособленных, которые, как прогнозируется, произведут больше потомства. Естественный отбор действует на характеристики жизненного цикла, чтобы оптимизировать репродуктивный успех и пожизненную приспособленность. Приспособленность в этом контексте относится к тому, насколько вероятно, что организм выживет и будет размножаться. Она основана на окружающей среде и также соотносится с другими особями в популяции. Примерами характеристик жизненного цикла являются: возраст и размер при первом размножении, количество произведенных размеров и потомства и период репродуктивной продолжительности жизни. Организмы вкладывают энергию в рост, размножение и поддержание, следуя определенной схеме, которая меняется на протяжении всей их жизни из-за компромиссов, которые существуют между различными распределениями энергии. Например, инвестиции в текущее и будущее размножение происходят за счет другого. Однако естественный отбор не так эффективен для организмов по мере их старения. Накопление мутаций (МА) и антагонистическая плейотропия (АП) — два фактора, которые способствуют старению . [7] Как МА, так и АП способствуют возрастному снижению приспособленности. [8] Накопление случайных, связанных с возрастом мутировавших аллелей зародышевой линии известно как накопление мутаций. Обратите внимание, что соматические мутации не наследуются, они являются лишь источником вариаций развития. Исследования, проведенные на Drosophila melanogaster, показали, что накопление мутаций приводит к комбинации аллелей, которые имеют «возрастные аддитивные эффекты», которые вызывают снижение реакции на стресс и, в конечном счете, возрастное снижение приспособленности. [7] Количество делений зародышевых клеток на поколение варьируется среди линий и связано с размером генома; у людей; 401 деление зародышевых клеток происходит на поколение у мужчин и 31 у женщин. [9]
Первая современная теория старения млекопитающих была сформулирована Питером Медаваром в 1952 году. Эта теория сформировалась в предыдущем десятилетии с Дж. Б. С. Холдейном и его концепцией селективной тени . Развитие человеческой цивилизации сместило селективную тень, поскольку условия, в которых сейчас живут люди, включают улучшенное качество продовольствия, условий жизни и здравоохранения. Это улучшенное здравоохранение включает современную медицину, такую как антибиотики и новые медицинские технологии. [10] Несколько исследований на Drosophila показали, что возраст экспрессии новых вредных мутаций определяет эффекты, которые они вносят в смертность. Однако в целом; хотя их частота увеличивается, их эффекты и вариации уменьшаются с возрастом.
Не существует теории, объясняющей, как эти вредные мутации влияют на приспособленность в разном возрасте и на эволюцию старения. [11] [12] Их идея заключалась в том, что старение было вопросом пренебрежения, поскольку природа — это место с высокой конкуренцией. Почти все животные умирают в дикой природе от хищников, болезней или несчастных случаев, что снижает средний возраст смерти. Следовательно, нет особых причин, по которым тело должно оставаться в форме в течение длительного времени, поскольку давление отбора невелико для признаков, которые сохраняли бы жизнеспособность после того времени, когда большинство животных в любом случае умерло бы. Метаболические заболевания возникают из-за низкого спроса на физическую активность в современной цивилизации по сравнению с теми временами, когда людям приходилось добывать пропитание в дикой природе для выживания. [10] Теперь, когда селективная тень сместилась, людям приходится иметь дело с этим новым селективным давлением.
Старение считается побочным продуктом физиологии, потому что наш клеточный метаболизм создает токсичные продукты, мы получаем мутации, когда стареем, и у нас недостаточно стволовых клеток, которые регенерируют. Почему отбор не нашел и не поддержал мутации способами, которые позволяют нам, например, регенерировать наши клетки или не производить токсичный метаболизм? Почему развилась менопауза? Потому что отбор более эффективен в отношении признаков, которые появляются в раннем возрасте. Мутации, которые оказывают влияние в раннем возрасте, увеличат приспособленность гораздо больше, чем мутации, которые проявляются поздно. Большинство людей уже размножились до того, как проявилась какая-либо болезнь; это означает, что родители передадут свои аллели своим потомкам до того, как у них проявятся какие-либо проблемы с приспособленностью, и поэтому для отбора «слишком поздно».
Две теории: неадаптивная и адаптивная, используются для объяснения эволюции старения, которое представляет собой снижение репродуктивной функции с возрастом. [8] Неадаптивная теория предполагает, что эволюционное ухудшение возраста человека происходит в результате накопления вредных мутаций в зародышевой линии. [8] Эти вредные мутации начинают проявляться в конце жизни, к тому времени, когда мы слабы/шатки и уже размножились, это означает, что естественный отбор не может на них воздействовать, потому что размножение закончилось. Исследования, проведенные на Drosophila melanogaster, показали обратную зависимость между средним оптимальным возрастом зрелости и частотой мутаций на ген. [13] Накопление мутаций влияет на распределение энергии и времени, которые направляются на рост и размножение в течение жизни организма, особенно в период репродуктивной продолжительности жизни из-за того, что накопление мутаций ускоряет старение, это означает, что организмы должны достигать оптимального возраста зрелости в более молодом возрасте, поскольку их репродуктивная продолжительность жизни сокращается из-за накопленных мутаций. [13]
Мутации случаются, и они совершенно случайны по отношению к потребностям окружающей среды и приспособленности. Мутации могут быть либо полезными, когда они повышают приспособленность организма, нейтральными, когда они не влияют на приспособленность организма, либо вредными, когда они отрицательно влияют на приспособленность организма. Ранее проведенные эксперименты показали, что большинство накоплений мутаций вредны, и только некоторые из них полезны. Мутации генов, которые взаимодействуют друг с другом в процессе развития, создают биологическое и, таким образом, фенотипическое разнообразие. Мутации — это генетическая информация, которая выражается среди организмов посредством экспрессии генов , которая является переводом генетической информации в фенотипический признак. [14] Эволюция — это изменение наследуемого признака в популяции на протяжении поколений, поскольку мутации генерируют вариации наследуемых признаков; они считаются сырьем для эволюции. Следовательно, полезные накопления мутаций в процессе развития могут генерировать больше фенотипических вариаций, что увеличивает частоту их генов и влияет на способность фенотипической эволюции. [15]
Теория соматических мутаций старения утверждает, что накопление мутаций в соматических клетках является основной причиной старения. Сравнение скорости соматических мутаций у нескольких видов млекопитающих показало, что общее количество накопленных мутаций в конце жизни было примерно одинаковым в широком диапазоне продолжительности жизни. [16] Авторы утверждают, что эта сильная связь между скоростью соматических мутаций и продолжительностью жизни у разных видов млекопитающих предполагает, что эволюция может ограничивать скорость соматических мутаций, возможно, путем отбора, действующего на различные пути репарации ДНК.
Теория Медавара была раскритикована и позже развита Джорджем К. Уильямсом в 1957 году. Уильямс отметил, что старение может быть причиной многих смертей, даже если животные не «умирают от старости». [1] Он начал свою гипотезу с идеи о том, что старение может вызывать более раннее старение из-за конкурентной природы жизни. Даже небольшое количество старения может быть фатальным; следовательно, естественный отбор действительно заботится, и старение не является бесплатным. [17]
В конце концов Уильямс предложил свою собственную гипотезу, названную антагонистической плейотропией . Плейотропия сама по себе означает одну мутацию, которая вызывает множественные эффекты на фенотипе . [18] С другой стороны, антагонистическая плейотропия имеет дело с одним геном, который создает два признака, один из которых полезен, а другой вреден. По сути, это относится к генам, которые приносят пользу в начале жизни, но позже накапливают издержки. [1] Другими словами, антагонистическая плейотропия — это когда результирующая связь между двумя признаками отрицательная. Это когда один фенотипический признак положительно влияет на текущее воспроизводство за счет более позднего ускоренного старения, роста и поддержания. Антагонистическая плейотропия является постоянной, если только не происходит мутация, которая изменяет эффекты первичного локуса. [13]
Хотя антагонистическая плейотропия является сегодня преобладающей теорией, это в значительной степени по умолчанию и не было хорошо проверено. Исследования показали, что это не относится ко всем генам и может рассматриваться как частичное подтверждение теории, но это подрывает основную предпосылку: что генетические компромиссы являются основной причиной старения.
В экспериментах по разведению Майкл Р. Роуз отбирал плодовых мушек с большой продолжительностью жизни. Основываясь на антагонистической плейотропии, Роуз ожидал, что это наверняка снизит их плодовитость . Его команда обнаружила, что им удалось вывести мух, которые жили более чем в два раза дольше, чем мухи, с которых они начинали, но к их удивлению, долгоживущие, инбридинговые мухи на самом деле откладывали больше яиц, чем короткоживущие мухи. Это было еще одной неудачей для теории плейотропии, хотя Роуз утверждает, что это может быть экспериментальным артефактом. [19]
Третья основная теория, предложенная в 1977 году Томасом Кирквудом , предполагает, что организм должен планировать доступные ему ресурсы. Организм использует ресурсы, полученные из окружающей среды, для метаболизма, для воспроизводства, для ремонта и поддержания, и организм должен идти на компромисс, когда запас ресурсов ограничен. Теория утверждает, что этот компромисс заставляет организм перераспределять энергию на функцию ремонта, что приводит к постепенному ухудшению состояния организма с возрастом. [2]
Предостережение к этой теории предполагает, что это перераспределение энергии основано на времени, а не на ограничении ресурсов. Эта концепция фокусируется на эволюционном давлении, направленном на воспроизводство в установленный, оптимальный период времени, который диктуется возрастом и экологической нишей. Способ, которым это становится успешным, заключается в распределении времени и энергии на восстановление повреждений на клеточном уровне, что приводит к накоплению повреждений и сокращению продолжительности жизни по сравнению с организмами с более длительной беременностью . Эта концепция вытекает из сравнительного анализа геномной стабильности в клетках млекопитающих. [20] [21]
Один из противоположных аргументов основан на эффекте ограничения калорий , который удлиняет жизнь. [22] [23] [24] Однако не было показано, что ограничение диеты увеличивает репродуктивный успех (приспособленность) в течение жизни, поскольку при снижении доступности пищи репродуктивный выход также снижается. Более того, калории — не единственный ресурс, который может быть ограниченным для организма и который может влиять на множественные измерения приспособленности.
Так же, как мутация и экспрессия ДНК оказывают фенотипическое воздействие на организмы, повреждение ДНК и накопление мутаций также имеют фенотипические последствия у пожилых людей. Повреждение макромолекул, таких как ДНК, РНК и белки, наряду с ухудшением состояния тканей и органов являются основой старения. Видоспецифические темпы старения обусловлены пагубными изменениями, которые проявляются после репродуктивной фазы. « Митохондриальная ДНК (мтДНК) регулирует клеточный метаболизм , апоптоз и контроль окислительного стресса ». [25] Таким образом, повреждение мтДНК является еще одним фактором, способствующим фенотипам, связанным со старением . Нейродегенерация и рак являются двумя факторами, которые проявляются с повреждением ДНК; поэтому нам необходимо понять изменение в связи между повреждением ДНК и восстановлением ДНК по мере старения, чтобы знать о возрастных заболеваниях и разрабатывать образ жизни, который, возможно, мог бы способствовать здоровой продолжительности жизни. [26]
Теория повреждения ДНК при старении постулирует, что повреждение ДНК повсеместно встречается в биологическом мире и является основной причиной старения. [27] Теория основана на идее, что старение происходит с течением времени из-за повреждения ДНК. Например, исследования мозга и мышц млекопитающих показали, что способность к восстановлению ДНК относительно высока на раннем этапе развития, когда клетки делятся митотически, но существенно снижается, когда клетки входят в постмитотическое состояние. [28] [29] [30]
Эффект снижения экспрессии способности к восстановлению ДНК заключается в увеличении накопления повреждений ДНК. Это нарушает транскрипцию генов и вызывает прогрессирующую потерю клеточных и тканевых функций, которые определяют старение. В ответ на повреждение ДНК одним из ответов, вызванных окислительным стрессом, является активация p53 . [ 31] Белок p53 связывается с ДНК, затем стимулирует выработку p21 , который также известен как ингибитор циклинзависимой киназы 1. Это гарантирует, что клетка не сможет перейти на следующую стадию деления клетки, если повреждение ДНК не будет восстановлено. Однако клетки p21 могут запустить апоптоз . Апоптоз или запрограммированная смерть клеток связана с постепенной деградацией иммунной системы, скелетных мышц и нарушением, связанным со старением. [32]

Теломеры — это повторяющиеся последовательности нуклеотидов , которые защищают концы нашей хромосомы; они чувствительны к окислительному стрессу и деградируют во время репликации хромосом. Теломераза — это рибонуклеотидный белок, который помогает восстанавливать и заменять деградировавшие теломеры . Однако теломераза подводит нас с возрастом; она становится менее способной восстанавливать теломеры, и все наше тело начинает разваливаться. Это означает, что наши клетки больше не могут делиться или делиться с ошибками, и некоторые считают, что это способствует процессу старения. Новые исследования также показали, что существует связь между укорочением теломер и митохондриальной дисфункцией. [33] Тем не менее, чрезмерная экспрессия теломеразы увеличивает вероятность рака. Если теломеры остаются в состоянии восстановления, есть больше шансов на долголетие, но также есть больше делений клеток и больше шансов на мутацию, которая может привести к раку. Таким образом, долгоживущая клетка — это просто бомба замедленного действия. Таким образом, усиление активности теломеразы не является решением; оно лишь позволяет клеткам жить дольше. У голых землекопов высокая активность теломеразы, они живут долго и, как считали некоторые, никогда не болеют раком; и поэтому, возможно, являются исключением из этой гипотезы. [34] Однако голые землекопы болеют раком. [35] [36]
Такие теории, как теория «запрограммированной смерти» Вейсмана, предполагают, что ухудшение состояния и смерть в результате старения являются преднамеренным результатом эволюционной конструкции организма, и называются теориями запрограммированного старения или адаптивного старения.
Теория запрограммированного поддержания, основанная на эволюционируемости [37], предполагает, что механизмы восстановления контролируются общим механизмом контроля, способным определять условия, такие как ограничение калорийности, и могут отвечать за продолжительность жизни у определенных видов. В этой теории методы выживания основаны на механизмах контроля, а не на индивидуальном механизме поддержания, который вы видите в незапрограммированной теории старения млекопитающих.
Непрограммируемая теория старения млекопитающих [38] утверждает, что разные виды обладают разными возможностями для поддержания и восстановления. Виды с большей продолжительностью жизни обладают множеством механизмов для компенсации повреждений, вызванных такими причинами, как окисление, укорочение теломер и другие деградационные процессы. Виды с меньшей продолжительностью жизни, имеющие более ранний возраст половой зрелости, имеют меньшую потребность в долголетии и, таким образом, не развили или не сохранили более эффективные механизмы восстановления. Поэтому повреждения накапливаются быстрее, что приводит к более ранним проявлениям и более короткой продолжительности жизни. Поскольку существует большое разнообразие проявлений старения, которые, по-видимому, имеют очень разные причины, вероятно, что существует много различных функций поддержания и восстановления.
Избирательное затенение — одна из эволюционных теорий старения, основанная на предположении, что отбор особи обычно уменьшается, как только она по существу проходит фазу половой зрелости. В результате это формирует тень без учета сексуальной приспособленности, которая больше не учитывается, когда особь стареет. Это подтверждает идею о том, что сила естественного отбора снижается как функция возраста, впервые введенную Питером Б. Медеваром и Дж. Б. С. Холдейном.
«Ключевое концептуальное понимание, которое позволило Медавару, Уильямсу и другим разработать эволюционную теорию старения, основано на представлении о том, что сила естественного отбора, мера того, насколько эффективно отбор влияет на выживаемость или плодовитость в зависимости от возраста, снижается с возрастом». [39]
Медевар разработал модель, которая подчеркивает это, показывая снижение уровня выживания популяции по мере старения особи, однако уровень воспроизводства остается постоянным. Вероятность воспроизводства обычно достигает пика во время половой зрелости и снижается по мере старения особи, в то время как остальная часть популяции уменьшается с возрастом, поскольку они попадают в тень отбора. Модель также поддерживает теорию Медеварса о том, что из-за опасных и непредсказуемых условий в окружающей среде, таких как болезни, изменения климата и хищники, многие особи умирают вскоре после полового созревания. Следовательно, вероятность того, что особь выживет и пострадает от эффектов, связанных с возрастом, относительно низкая.
Точно так же многие полезные мутации отбираются, если они оказывают положительное влияние на особь в дальнейшей жизни. Например, если полезная или вредная мутация происходит только после репродуктивной фазы особи, то она не повлияет на приспособленность, и поэтому не может быть отобрана против. Впоследствии эти более поздние мутации и эффекты считаются находящимися в «теневой области» отбора». [40]
Групповой отбор основан на идее, что все члены данной группы либо преуспеют, либо потерпят неудачу вместе в зависимости от обстоятельств. При таком механизме генетический дрейф происходит коллективно для всех в группе и отличает их от других групп своего вида. Это отличается от индивидуального отбора, поскольку он фокусируется на группе, а не на индивидууме. [41]
Часто также пострепродуктивные особи совершают межпоколенческие переходы: дельфины-афалины и киты-пилоты охраняют своих внуков; существует кооперативное размножение у некоторых млекопитающих, многих насекомых и около 200 видов птиц; половые различия в выживании человекообразных приматов, как правило, коррелируют с заботой о потомстве; или за детенышем эфе часто ухаживают более 10 человек. Ли разработал формальную теорию, объединяющую отбор, обусловленный переходами (во всех возрастах), с отбором, обусловленным плодовитостью. [42]
Эволюционируемость — это концепция, согласно которой вид должен извлекать выгоду из более быстрой генетической адаптации к своей нынешней среде. В следующих примерах это используется для аргумента, что устранение старых особей может принести пользу виду в целом.
Скулачев (1997) [43] предположил, что запрограммированное старение способствует процессу эволюции, постепенно создавая все большую проблему или препятствие для выживания и воспроизводства и, следовательно, усиливая отбор полезных характеристик.
Голдсмит (2008) [44] предположил, что, хотя увеличение скорости генерации и скорости эволюции полезно для вида, также важно ограничить продолжительность жизни, чтобы старые особи не доминировали в генофонде .
Модель Янга (2013) [6] также основана на идее о том, что старение ускоряет накопление новых адаптивных генов в локальных популяциях. Однако Ян изменил терминологию «эволюционируемости» на «генетическое творчество» на протяжении всей своей статьи, чтобы облегчить понимание того, как старение может иметь более краткосрочную выгоду, чем подразумевает слово «эволюционируемость».
Ленарт и Вашку (2016) [45] также ссылались на эволюционируемость как на основной механизм, движущий эволюцию старения. Однако они предположили, что даже если фактическая скорость старения может быть адаптацией, само старение неизбежно. Другими словами, эволюция может изменить скорость старения, но некоторое старение, независимо от того, насколько оно медленное, всегда будет происходить.
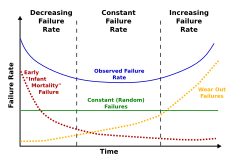
Смертность — это количество смертей в определенной группе за определенный период времени. [46] Существует два типа смертности: внутренняя и внешняя . Внутренняя смертность определяется как смертность из-за старения, физиологического упадка из-за врожденных процессов, тогда как внешняя смертность является результатом факторов окружающей среды, таких как, например, хищничество, голод, несчастные случаи и другие. Например, у летающих животных, таких как летучие мыши, меньше хищников, и поэтому у них низкая внешняя смертность. Птицы теплокровны и по размеру похожи на многих мелких млекопитающих, но часто живут в 5–10 раз дольше. Они сталкиваются с меньшим количеством хищников, чем наземные млекопитающие, и, таким образом, у них более низкая внешняя смертность.
При изучении соотношения размера тела и продолжительности жизни можно также заметить, что хищные млекопитающие, как правило, живут дольше, чем жертвы в контролируемой среде, такой как зоопарк или заповедник. Объяснение большой продолжительности жизни приматов (таких как люди, обезьяны и человекообразные обезьяны) относительно размера тела заключается в том, что им удается достичь более низкой внешней смертности благодаря своему интеллекту.
Отдельные организмы обычно смертны; они стареют и умирают, в то время как зародышевые линии, которые соединяют последовательные поколения, потенциально бессмертны. Основой этого различия является фундаментальная проблема в биологии. Российский биолог и историк Жорес А. Медведев [47] считал, что точность геномных репликативных и других синтетических систем сама по себе не может объяснить бессмертие зародышевых линий . Скорее, Медведев считал, что известные особенности биохимии и генетики полового размножения указывают на наличие уникальных процессов сохранения и восстановления информации на разных стадиях гаметогенеза . В частности, Медведев считал, что важнейшие возможности для сохранения информации зародышевых клеток создаются рекомбинацией во время мейоза и репарацией ДНК ; он рассматривал их как процессы внутри зародышевых клеток, которые способны восстанавливать целостность ДНК и хромосом от типов повреждений, вызывающих необратимое старение в соматических клетках .
Прогероидные синдромы — это генетические заболевания, связанные с преждевременным старением. Прогероидные синдромы характеризуются наличием признаков, напоминающих признаки физиологического старения, такие как потеря волос и сердечно-сосудистые заболевания. [48]
Прогерия — это генетическое заболевание одного гена , которое вызывает ускорение многих или большинства симптомов старения в детстве. Оно поражает примерно 1 из 4-8 миллионов новорожденных. [49] Известно, что люди с этим заболеванием не могут развиваться и имеют ряд симптомов, которые вызывают аномалии в суставах, волосах, коже, глазах и лице. [50] Большинство людей с этим заболеванием доживают только до 13 лет. [51] Хотя термин прогерия, строго говоря, применяется ко всем заболеваниям, характеризующимся симптомами преждевременного старения, и часто используется как таковой, его часто применяют конкретно в отношении синдрома прогерии Хатчинсона-Гилфорда (HGPS). У детей с диагнозом HGPS развиваются заметные черты лица, такие как маленькое лицо, тонкие губы, маленький подбородок и оттопыренные уши . Хотя прогерия может вызывать физические отклонения у ребенка, она не влияет на его двигательные навыки или интеллектуальное развитие. [52] Люди с HGPS склонны страдать от неврологических и сердечно-сосудистых расстройств. [53] HGPS вызывается точечной мутацией в гене, кодирующем белок ламина А. Ламин А способствует генетической стабильности, поддерживая уровни белков, которые играют ключевую роль в негомологичном соединении концов и гомологичной рекомбинации . [54] Клетки мышей, дефицитные для созревания преламина А, демонстрируют повышенное повреждение ДНК и хромосомные аберрации и имеют повышенную чувствительность к агентам, повреждающим ДНК. [55] При HGPS неспособность адекватно восстанавливать повреждения ДНК из-за дефектного ламина типа А может вызывать аспекты преждевременного старения, основанного на ламинопатии . [55]
Синдром Вернера, также известный как «взрослая прогерия», является еще одним генетическим заболеванием одного гена. Он вызван мутацией в гене wrn . [53] Он поражает примерно 1 из 200 000 человек в Соединенных Штатах. [56] Этот синдром начинает поражать людей в подростковом возрасте, не давая подросткам расти в период полового созревания. Существует четыре общих признака синдрома Вернера: катаракта обоих глаз, изменения кожи, похожие на склеродермию , низкий рост, раннее поседение и выпадение волос. [53] Когда человек достигает двадцати лет, обычно происходит изменение цвета волос, кожи и голоса. Средняя продолжительность жизни человека с этим заболеванием составляет около 46 лет. [57] Это состояние также может влиять на распределение веса между руками, ногами и туловищем. [58] Люди с синдромом Вернера подвержены повышенному риску развития катаракты, диабета 2 типа , различных видов рака и атеросклероза . [56] Открытие того, что белок WRN взаимодействует с ДНК-PKcs и комплексом белка Ku , в сочетании с доказательствами того, что клетки с дефицитом WRN производят обширные делеции в местах соединения негомологичных концов ДНК, предполагает роль белка WRN в процессе репарации ДНК при соединении негомологичных концов . [59] Белок WRN также, по-видимому, играет роль в разрешении промежуточных структур рекомбинации во время гомологичной рекомбинационной репарации двухцепочечных разрывов ДНК. [59]
Синдром Блума — редкое аутосомно-рецессивное заболевание, которое характеризуется низким ростом, хромосомной нестабильностью, предрасположенностью к раку и чувствительной к солнцу кожей. [60] Люди с синдромом Блума также могут иметь трудности в обучении и иметь повышенный риск развития хронической обструктивной болезни легких (ХОБЛ) и других заболеваний. [61]
Синдром Коккейна — гомозиготная или гетерозиготная мутация, которая приводит к низкому росту, аномалиям размера головы и медленному росту и развитию. [62]
Синдром Ротмунда–Томсона — редкое аутосомно-рецессивное заболевание, поражающее кожу. Оно характеризуется редкими волосами, юношеской катарактой, скелетными аномалиями и задержкой роста. [63]
Теории старения влияют на попытки понять и найти методы лечения возрастных заболеваний:
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ){{cite book}}: |work=проигнорировано ( помощь )