В химии молекулярные оксогалогениды ( оксигалогениды ) представляют собой группу химических соединений , в которых атомы кислорода и галогена присоединены к другому химическому элементу A в одной молекуле . Они имеют общую формулу AO m X n , где X представляет собой галоген . Известные оксогалогениды содержат в своих молекулах фтор (F), хлор (Cl), бром (Br) и/или йод (I). Элемент A может быть элементом главной группы , переходным элементом , редкоземельным элементом или актинидом . Термин оксогалогенид или оксигалогенид может также относиться к минералам и другим кристаллическим веществам с той же общей химической формулой, но имеющим ионную структуру.

Оксогалогениды можно рассматривать как промежуточные соединения между оксидами и галогенидами . Существует три общих метода синтеза: [1]
Кроме того, различные оксогалогениды могут быть получены в результате реакций обмена галогенов, и эта реакция также может привести к образованию смешанных оксогалогенидов, таких как POFCl 2 и CrO 2 FCl .
Что касается оксида или галогенида, то для заданной степени окисления элемента A, если два атома галогена заменяют один атом кислорода или наоборот , общий заряд молекулы не изменяется, а координационное число центрального атома уменьшается на единицу. Например, как оксихлорид фосфора ( POCl3 ), так и пентахлорид фосфора ( PCl5 ) являются нейтральными ковалентными соединениями фосфора в степени окисления +5 . Если атом кислорода просто заменяется атомом галогена, заряд увеличивается на +1, но координационное число не изменяется. Это иллюстрируется реакцией смеси соли хромата или дихромата и хлорида калия с концентрированной серной кислотой .
Полученный хромилхлорид не имеет электрического заряда и представляет собой летучую ковалентную молекулу, которую можно отделить от реакционной смеси. [2]
Оксогалогениды элементов в высоких степенях окисления являются сильными окислителями , с окислительной способностью, подобной соответствующему оксиду или галогениду. Большинство оксогалогенидов легко гидролизуются . Например, хромилхлорид гидролизуется до хромата в обратной реакции синтеза, описанной выше. Движущей силой этой реакции является образование связей AO, которые прочнее связей A-Cl. Это дает благоприятный энтальпийный вклад в изменение свободной энергии Гиббса для реакции [3]
Многие оксогалогениды могут действовать как кислоты Льюиса . Это особенно касается оксогалогенидов с координационным числом 3 или 4, которые, принимая одну или несколько электронных пар от основания Льюиса , становятся 5- или 6-координированными. Оксогалогенидные анионы, такие как [VOCl 4 ] 2−, можно рассматривать как кислотно-основные комплексы оксогалогенида ( VOCl 2 ) с большим количеством галогенидных ионов, действующих как основания Льюиса. Другим примером является VOCl 2 , который образует тригонально-бипирамидальный комплекс VOCl 2 (N(CH 3 ) 3 ) 2 с основанием триметиламином . [4]
Колебательные спектры многих оксогалогенидов были подробно описаны. Они дают полезную информацию об относительной прочности связей. Например, в CrO 2 F 2 валентные колебания Cr–O находятся при 1006 см −1 и 1016 см −1 , а валентные колебания Cr–F находятся при 727 см −1 и 789 см −1 . Разница слишком велика, чтобы быть следствием разной массы атомов O и F. Скорее, она показывает, что связь Cr–O намного прочнее связи Cr–F. Связи M–O обычно считаются двойными связями , и это подтверждается измерениями длин связей M–O. Это подразумевает, что элементы A и O химически связаны друг с другом σ-связью и π-связью. [5]
Оксогалогениды элементов в высоких степенях окисления интенсивно окрашены из-за переходов переноса заряда лиганда на металл (LMCT). [6]


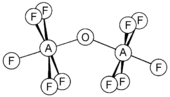
Углерод образует оксогалогениды COX 2 , X = F , Br и очень токсичный фосген (X = Cl), который производится в промышленности с помощью катализируемой углеродом реакции оксида углерода с хлором . Это полезный реагент в органической химии для образования карбонильных соединений . [7] Например:
Тетрафторид кремния реагирует с водой, давая плохо охарактеризованные оксифторидные полимеры, но медленная и осторожная реакция при -196 °C также дает оксифторид гексафтордисилоксан. [8]
Азот образует два ряда оксогалогенидов с азотом в степенях окисления 3, NOX, X = F , Cl , Br и 5, NO 2 X , X = F , Cl. Они получаются путем галогенирования оксидов азота. Обратите внимание, что NO 2 F изоэлектронен с нитрат - ионом, NO−3. Известны только оксогалогениды фосфора (V). [9]
Сера образует оксогалогениды [10] в степени окисления +4, такие как тионилхлорид , SOCl2 и степени окисления +6, такие как сульфурилфторид (SO2F2 ) , сульфурилхлорид ( SO2Cl2 ) и тионилтетрафторид ( SOF4 ) . Все они легко гидролизуются. Действительно, тионилхлорид может быть использован в качестве дегидратирующего агента , поскольку молекулы воды преобразуются в газообразные продукты, оставляя после себя безводный твердый хлорид. [ 11 ]
Селен и теллур образуют похожие соединения, а также оксомостиковые виды F 5 AOAF 5 (A = S, Se, Te). Они нелинейны с углом AOA 142,5, 142,4 и 145,5° для S, Se и Te соответственно. [12] Анион теллура F 5 TeO − , известный как тефлат , является большим и довольно стабильным анионом, полезным для образования стабильных солей с большими катионами. [11]
Галогены образуют различные оксофториды с формулами XO 2 F ( фтористый хлор ), XO 3 F ( фтористый перхлор ) и XOF 3 с X = Cl, Br и I. Также известны IO 2 F 3 и IOF 5. [13]
Ксенон образует окситетрафторид ксенона ( XeOF4 ) , диоксидифторид ксенона ( XeO2F2 ) и оксидифторид ксенона ( XeOF2 ) .

Ниже приведена подборка известных оксогалогенидов переходных металлов , более подробные списки можно найти в литературе. [15] X обозначает различные галогениды, чаще всего F и Cl.

Высокие степени окисления металла обусловлены тем фактом, что кислород является сильным окислителем , как и фтор . Бром и иод являются относительно слабыми окислителями, поэтому известно меньше оксобромидов и оксоиодидов. Структуры соединений с конфигурацией d 0 предсказываются теорией VSEPR . Таким образом, CrO 2 Cl 2 является тетраэдрическим , OsO 3 F 2 является тригонально-бипирамидальным , XeOF 4 является квадратно-пирамидальным , а OsOF 5 является октаэдрическим . [18] Комплекс d 1 ReOCl 4 является квадратно-пирамидальным.
Соединения [Ta 2 OX 10 ] 2− и [M 2 OCl 10 ] 4− (M = W, Ru, Os) имеют две группы MX 5 , соединенные мостиковым атомом кислорода. [19] Каждый металл имеет октаэдрическое окружение. Необычная линейная структура M−O−M может быть объяснена с точки зрения теории молекулярных орбиталей , что указывает на наличие связи d π — p π между атомами металла и кислорода. [20] Кислородные мостики присутствуют в более сложных конфигурациях, таких как M(cp) 2 (OTeF 5 ) 2 (M = Ti, Zr, Hf, Mo или W; cp = циклопентадиенил , η 5 -C 5 H 5 ) [21] или [AgOTeF 5 -(C 6 H 5 CH 3 ) 2 ] 2 . [17]
В ряду актинидов соединения уранила , такие как уранилхлорид ( UO 2 Cl 2 ) и [UO 2 Cl 4 ] 2−, хорошо известны и содержат линейную часть UO 2 . Аналогичные виды существуют для нептуния и плутония . Вид уранилфторид является осложняющим загрязнителем в образцах гексафторида урана .

Оксохлорид висмута (BiOCl, бисмоклит ) является редким примером минерала оксогалогенида. Кристаллическая структура имеет тетрагональную симметрию и может рассматриваться как состоящая из слоев ионов Cl − , Bi 3+ и O 2− в порядке Cl-Bi-O-Bi-Cl-Cl-Bi-O-Bi-Cl. Эта слоистая, графитоподобная структура приводит к относительно низкой твердости бисмоклита ( Моос 2–2,5) и большинства других оксогалогенидных минералов. [22] Эти другие минералы включают терлингуаит Hg 2 OCl , образованный в результате выветривания ртутьсодержащих минералов. [23] Мендипит , Pb 3 O 2 Cl 2 , образованный из исходного месторождения сульфида свинца в ряд стадий, является еще одним примером вторичного оксогалогенидного минерала.
Элементы железо , сурьма , висмут и лантан образуют оксохлориды общей формулы MOCl. MOBr и MOI также известны для Sb и Bi. Многие из их кристаллических структур были определены. [24]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ). Структура проиллюстрирована на рисунке 22.5 Housectroft & Sharpe.