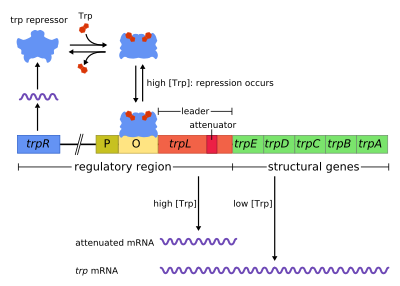
Оперон trp представляет собой группу генов, которые транскрибируются вместе, кодируя ферменты, которые производят аминокислоту триптофан в бактериях. Оперон trp был впервые охарактеризован в Escherichia coli , и с тех пор он был обнаружен во многих других бактериях. [1] Оперон регулируется таким образом, что когда триптофан присутствует в окружающей среде, гены синтеза триптофана подавляются.
Оперон trp содержит пять структурных генов: trpE , trpD , trpC , trpB и trpA , которые кодируют ферменты, необходимые для синтеза триптофана. Он также содержит репрессивный регуляторный ген, называемый trpR . Когда присутствует триптофан, белок trpR связывается с оператором , блокируя транскрипцию оперона trp РНК-полимеразой.
Этот оперон является примером репрессируемой отрицательной регуляции экспрессии генов. Белок- репрессор связывается с оператором в присутствии триптофана (репрессируя транскрипцию ) и высвобождается из оперона, когда триптофан отсутствует (позволяя транскрипции продолжаться). Оперон trp дополнительно использует ослабление для контроля экспрессии оперона , второго механизма управления с отрицательной обратной связью .
Оперон trp хорошо изучен и обычно используется в качестве примера регуляции генов у бактерий наряду с опероном lac .

Оперон trp содержит пять структурных генов. Роли их продуктов:


Оперон работает по механизму отрицательной репрессируемой обратной связи. Репрессор для оперона trp вырабатывается выше по течению геном trpR, который конститутивно экспрессируется на низком уровне. Синтезированные мономеры trpR связываются в димеры. Когда присутствует триптофан , эти димеры триптофанового репрессора связываются с триптофаном , вызывая изменение конформации репрессора, позволяя репрессору связываться с оператором . Это предотвращает связывание РНК-полимеразы с опероном и его транскрипцию, поэтому триптофан не вырабатывается из своего предшественника. Когда триптофан отсутствует, репрессор находится в своей неактивной конформации и не может связываться с областью оператора, поэтому транскрипция не ингибируется репрессором.

Ослабление является вторым механизмом отрицательной обратной связи в опероне trp . Система репрессии нацелена на внутриклеточную концентрацию trp, тогда как ослабление реагирует на концентрацию заряженной тРНК trp . [2] Таким образом, репрессор trpR снижает экспрессию гена, изменяя инициацию транскрипции, в то время как ослабление делает это, изменяя процесс транскрипции, который уже идет. [2] В то время как репрессор TrpR снижает транскрипцию в 70 раз, ослабление может дополнительно уменьшить ее в 10 раз, таким образом позволяя накопить репрессию примерно в 700 раз. [3] Ослабление стало возможным благодаря тому факту, что у прокариот (у которых нет ядра ) рибосомы начинают транслировать мРНК , в то время как РНК-полимераза все еще транскрибирует последовательность ДНК. Это позволяет процессу трансляции напрямую влиять на транскрипцию оперона.
В начале транскрибируемых генов оперона trp находится последовательность из не менее 130 нуклеотидов, называемая лидерным транскриптом (trpL; P0AD92 ). [4] Ли и Янофски (1977) обнаружили, что эффективность ослабления коррелирует со стабильностью вторичной структуры, встроенной в trpL, [5] а 2 составляющие шпильки терминаторной структуры были позже выяснены Оксендером и др. (1979). [6] Этот транскрипт включает четыре короткие последовательности, обозначенные 1–4, каждая из которых частично комплементарна следующей. Таким образом, могут образовываться три различные вторичные структуры ( шпильки ): 1–2, 2–3 или 3–4. Гибридизация последовательностей 1 и 2 для формирования структуры 1–2 встречается редко, поскольку РНК-полимераза ждет присоединения рибосомы, прежде чем продолжить транскрипцию после последовательности 1, однако, если шпилька 1–2 должна была сформироваться, это предотвратило бы образование структуры 2–3 (но не 3–4). Образование петли шпильки между последовательностями 2–3 предотвращает образование петель шпильки как между 1–2, так и между 3–4. Структура 3–4 представляет собой последовательность терминации транскрипции (изобилующую остатками G/C и сразу за которой следует несколько остатков урацила), после ее формирования РНК-полимераза отделится от ДНК, и транскрипция структурных генов оперона не сможет произойти (более подробное объяснение см. ниже). Функциональная важность 2-й шпильки для терминации транскрипции иллюстрируется сниженной частотой терминации транскрипции, наблюдаемой в экспериментах по дестабилизации центрального спаривания G+C этой шпильки. [5] [7] [8] [9]
Часть транскрипта лидера кодирует короткий полипептид из 14 аминокислот, называемый лидерным пептидом. Этот пептид содержит два соседних остатка триптофана, что необычно, поскольку триптофан является довольно редкой аминокислотой (примерно один из ста остатков в типичном белке E. coli является триптофаном). Цепь 1 в trpL охватывает область, кодирующую конечные остатки лидерного пептида: Trp, Trp, Arg, Thr, Ser; [2] в этих 5 кодонах наблюдается консервация, тогда как мутация кодонов выше по течению не изменяет экспрессию оперона. [2] [10] [11] [12] Если рибосома попытается транслировать этот пептид, когда уровни триптофана в клетке низкие, она остановится на любом из двух кодонов trp. Пока она остановится, рибосома физически защищает последовательность 1 транскрипта, предотвращая образование вторичной структуры 1–2. Последовательность 2 затем свободно гибридизуется с последовательностью 3, образуя структуру 2–3, которая затем предотвращает образование шпильки терминации 3–4, поэтому структура 2–3 называется антитерминационной шпилькой. При наличии структуры 2–3 РНК-полимераза может свободно продолжать транскрибировать оперон. Мутационный анализ и исследования с участием комплементарных олигонуклеотидов показывают , что стабильность структуры 2–3 соответствует уровню экспрессии оперона. [10] [13] [14] [15] Если уровни триптофана в клетке высоки, рибосома будет транслировать весь лидерный пептид без прерывания и остановится только во время терминации трансляции на стоп-кодоне . В этот момент рибосома физически экранирует обе последовательности 1 и 2. Таким образом, последовательности 3 и 4 могут свободно формировать структуру 3–4, которая завершает транскрипцию. Эта структура терминатора образуется, когда ни одна рибосома не останавливается вблизи тандема Trp (т. е. кодона Trp или Arg): либо лидерный пептид не транслируется, либо трансляция гладко продолжается вдоль цепи 1 с обильным количеством заряженной тРНКtrp. [2] [10] Более того, предполагается, что рибосома блокирует только около 10 нуклеотидов ниже по течению, таким образом, остановка рибосомы либо в верхнем Gly, либо далее ниже по течению Thr, по-видимому, не влияет на формирование шпильки терминации. [2] [10] Конечным результатом является то, что оперон будет транскрибироваться только тогда, когда триптофан недоступен для рибосомы, в то время как транскрипт trpL конститутивно экспрессируется.
Этот механизм ослабления подтверждается экспериментально. Во-первых, трансляция лидерного пептида и рибосомная остановка напрямую доказаны как необходимые для ингибирования терминации транскрипции. [13] Более того, мутационный анализ, дестабилизирующий или нарушающий спаривание оснований шпильки антитерминатора, приводит к увеличению терминации нескольких складок; в соответствии с моделью ослабления, эта мутация не снимает ослабление даже при голодании Trp. [10] [13] Напротив, комплементарные олигонуклеотиды, нацеленные на цепь 1, увеличивают экспрессию оперона, способствуя формированию антитерминатора. [10] [14] Кроме того, в гистидиновом опероне компенсаторная мутация показывает, что способность к спариванию нитей 2–3 имеет большее значение, чем их первичная последовательность, для ингибирования ослабления. [10] [15]
При затухании, когда транслирующая рибосома останавливается, определяется, будет ли сформирована терминирующая шпилька. [10] Для того чтобы транскрибирующая полимераза одновременно захватила альтернативную структуру, временной масштаб структурной модуляции должен быть сопоставим с масштабом транскрипции. [2] Чтобы гарантировать, что рибосома связывается и начинает трансляцию лидерного транскрипта сразу после его синтеза, в последовательности trpL существует сайт паузы. Достигнув этого сайта, РНК-полимераза приостанавливает транскрипцию и, по-видимому, ждет начала трансляции. Этот механизм позволяет синхронизировать транскрипцию и трансляцию, что является ключевым элементом в затухании.
Подобный механизм ослабления регулирует синтез гистидина , фенилаланина и треонина .
Расположение оперона trp у E. coli и Bacillus subtilis различается. В E. coli есть 5 структурных генов , которые находятся в одной транскрипционной единице. В Bacillus subtilis есть 6 структурных генов, которые расположены в супраопероне. Три из этих генов находятся выше, а три других гена находятся ниже оперона trp. [16] В опероне Bacillus subtilis есть 7-й ген, называемый trpG или pabA, который отвечает за синтез белка триптофана и фолата . [17] Регуляция оперонов trp у обоих организмов зависит от количества trp, присутствующего в клетке. Однако первичная регуляция биосинтеза триптофана у B. subtilis осуществляется посредством ослабления, а не подавления транскрипции. [18] В B. subtilis триптофан связывается с одиннадцатисубъединичным триптофан-активируемым РНК-связывающим белком ослабления (TRAP), который активирует способность TRAP связываться с лидерной РНК trp. [19] [20] Связывание trp-активируемого TRAP с лидерной РНК приводит к образованию терминаторной структуры, которая вызывает терминацию транскрипции. [18] Кроме того, активированный TRAP ингибирует инициацию трансляции генов trpP, trpE, trpG и ycbK. Ген trpP играет роль в транспортировке trp, в то время как ген trpG используется в опероне фолата, а ген ycbK участвует в синтезе белка эффлюкса. Активированный белок TRAP регулируется анти-TRAP белком и синтезом AT. AT может инактивировать TRAP, чтобы снизить транскрипцию триптофана. [21]