Органофосфины — это фосфорорганические соединения с формулой PR n H 3− n , где R — органический заместитель. Эти соединения можно классифицировать в соответствии со значением n : первичные фосфины ( n = 1), вторичные фосфины ( n = 2), третичные фосфины ( n = 3). Все они имеют пирамидальную структуру. [1] Органофосфины, как правило, бесцветные, липофильные жидкости или твердые вещества. [2] Родительским соединением органофосфинов является фосфин (PH 3 ). [3]
Органофосфоны классифицируются по числу органических заместителей.
Первичные (1°) фосфины с формулой RPH 2 обычно получают алкилированием фосфина. Простые алкильные производные, такие как метилфосфин (CH 3 PH 2 ), получают алкилированием производных щелочных металлов MPH 2 (M — Li , Na , или K ). Другой синтетический путь включает обработку соответствующих хлорфосфинов гидридными реагентами. Например, восстановление дихлорфенилфосфина алюмогидридом лития дает фенилфосфин ( PhPH 2 ). [4]

Первичные (RPH 2 ) и вторичные фосфины (RRPH и R 2 PH) присоединяются к алкенам в присутствии сильного основания (например, KOH в ДМСО ). Применяются правила Марковникова . Аналогичные реакции происходят с участием алкинов . [5] Основание не требуется для электронодефицитных алкенов (например, производных акрилонитрила ) и алкинов.
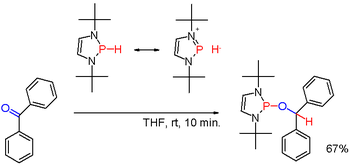
Вторичные (2°) фосфины с формулой R 2 PH получают аналогично первичным фосфинам. Их также получают путем восстановительного расщепления триарилфосфинов щелочными металлами с последующим гидролизом полученной соли фосфида. Последний путь используется для получения дифенилфосфина (Ph 2 PH). Диорганофосфиновые кислоты, R 2 P(O)OH, также могут быть восстановлены гидридом диизобутилалюминия . Вторичные фосфины обычно имеют протонный характер. Но при модификации подходящими заместителями, как в некоторых (редких) диазафосфоленах ( схема 3 ), полярность связи PH может быть инвертирована (см.: umpolung ), и полученный гидрид фосфина может восстанавливать карбонильную группу, как в примере с бензофеноном, еще одним способом. [6] Вторичные фосфины встречаются в циклических формах. Трехчленные кольца — это фосфираны (ненасыщенные: фосфирены ), пятичленные кольца — это фосфоланы (ненасыщенные: фосфолы ), а шестичленные кольца — это фосфинаны .
Третичные (3°) фосфины с формулой R 3 P традиционно получают алкилированием трихлорида фосфора с использованием реактивов Гриньяра или родственных литийорганических соединений:
В случае триметилфосфина вместо высокоэлектрофильного PCl 3 используется трифенилфосфит : [ 7 ]
Немного более сложные методы используются для получения несимметричных третичных фосфинов с формулой R 2 R'P. Типичным является использование нуклеофилов на основе фосфорорганических соединений . Например, дифенилфосфид лития легко метилируется метилиодидом с образованием метилдифенилфосфина :
Фосфин является предшественником некоторых третичных фосфинов путем гидрофосфинирования алкенов. Например, в присутствии основных катализаторов PH 3 присоединяет акцепторы Михаэля, такие как акрилонитрил : [8]
Третичные фосфины типа PRR′R″ являются « P -хиральными » и оптически стабильными.
С коммерческой точки зрения наиболее важным фосфином является трифенилфосфин , ежегодно производится несколько миллионов килограммов. Он получается из реакции хлорбензола , PCl 3 и натрия. [9] Фосфины более специализированной природы обычно получают другими способами. [10]

Дифосфины также доступны в первичных, вторичных и третичных фосфорных заместителях. Трифосфины и т. д. аналогичны.
Органофосфины, как и сам фосфин, являются пирамидальными молекулами с приблизительной симметрией C 3 v . Углы связи C–P–C составляют приблизительно 98,6°. [3] Углы связи C–P–C согласуются с представлением о том, что фосфор преимущественно использует 3p-орбитали для образования связей и что существует небольшая sp-гибридизация атома фосфора. Последнее является общей чертой химии фосфора. В результате неподеленная пара триметилфосфина имеет преимущественно s-характер, как в случае фосфина, PH 3 . [11]
Третичные фосфины пирамидальны. Когда все органические заместители различаются, фосфин хиральный и конфигурационно стабильный (в отличие от NRR'R"). Комплексы, полученные из хиральных фосфинов, могут катализировать реакции, давая хиральные , энантиообогащенные продукты.
Атом фосфора в фосфинах имеет формальную степень окисления −3 (σ 3 λ 3 ) и являются фосфорными аналогами аминов . Подобно аминам, фосфины имеют тригональную пирамидальную молекулярную геометрию, хотя часто с меньшими углами CEC (E = N, P), по крайней мере, при отсутствии стерических эффектов. Угол связи CPC составляет 98,6° для триметилфосфина, увеличиваясь до 109,7°, когда метильные группы заменяются трет -бутильными группами. При использовании в качестве лигандов стерическая масса третичных фосфинов оценивается по их конусному углу . Барьер для пирамидальной инверсии также намного выше, чем для инверсии азота , и поэтому фосфины с тремя различными заместителями могут быть разделены на термически стабильные оптические изомеры . Фосфины часто менее основные, чем соответствующие амины, например, сам ион фосфония имеет p K a −14 по сравнению с 9,21 для иона аммония; триметилфосфоний имеет ap K a 8,65 по сравнению с 9,76 для триметиламмония . Однако трифенилфосфин (p K a 2,73) более основной, чем трифениламин (p K a −5), в основном потому, что неподеленная пара азота в NPh 3 частично делокализована в три фенильных кольца. В то время как неподеленная пара на азоте делокализована в пирроле , неподеленная пара на атоме фосфора в фосфорном эквиваленте пиррола ( фосфоле ) не делокализована. Реакционная способность фосфинов соответствует реакционной способности аминов в отношении нуклеофильности при образовании солей фосфония с общей структурой PR 4 + X − . Это свойство используется в реакции Аппеля для превращения спиртов в алкилгалогениды . Фосфины легко окисляются до соответствующих фосфиноксидов , тогда как аминооксиды образуются с меньшей готовностью. Отчасти по этой причине фосфины очень редко встречаются в природе.
Третичные фосфины часто используются в качестве лигандов в координационной химии. Связывание фосфинов связывается с металлами, которые служат кислотами Льюиса . Например, хлорид серебра реагирует с трифенилфосфином с образованием комплексов 1:1 и 1:2:
Аддукты, образованные из фосфинов и борана, являются полезными реагентами. Эти фосфин-бораны стабильны на воздухе, но защитная группа борана может быть удалена обработкой аминами. [12] [13]
Подобно комплексообразованию, фосфины легко алкилируются. Например, бромистый метил преобразует трифенилфосфин в бромистый метилтрифенилфосфоний , «четвертичную соль»:
Фосфины являются нуклеофильными катализаторами в органическом синтезе , например, в реакциях Раухута-Керриера и Бейлиса-Хиллмана .
Подобно самому фосфину, но легче, органофосфины подвергаются протонированию. Реакция обратима. В то время как органофосфины чувствительны к кислороду, протонированные производные — нет.
Первичные и вторичные производные, они могут быть депротонированы сильными основаниями с образованием органофосфидных производных . Таким образом, дифенилфосфин реагирует с литийорганическим реагентом с образованием дифенилфосфида лития :
Третичные фосфины характерно окисляются, давая фосфиноксиды с формулой R 3 PO. Реакция с кислородом запрещена по спину, но все еще протекает с достаточной скоростью, так что образцы третичных фосфинов характерно загрязнены фосфиноксидами. Качественно, скорости окисления выше для триалкилфосфинов по сравнению с триарилфосфинами. Еще быстрее происходит окисление с использованием перекиси водорода . Первичные и вторичные фосфины также окисляются, но продукт(ы) подвергаются таутомеризации и дальнейшему окислению.
Третичные фосфины обычно окисляются с образованием фосфинсульфидов .
Восстановительные свойства органофосфинов также проиллюстрированы в восстановлении Штаудингера для превращения органических азидов в амины и в реакции Мицунобу для превращения спиртов в сложные эфиры. В этих процессах фосфин окисляется до фосфора(V). Было также обнаружено, что фосфины восстанавливают активированные карбонильные группы, например, восстановление α-кетоэфира до α-гидроксиэфира на схеме 2. [ 14] В предлагаемом механизме реакции первый протон заимствован из метильной группы в триметилфосфине (трифенилфосфин не реагирует).