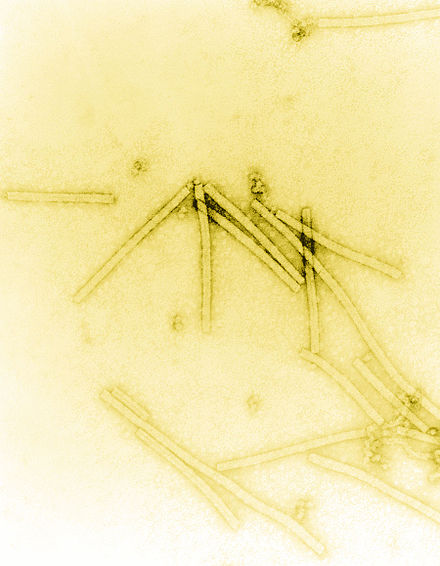
История вирусологии — научного изучения вирусов и вызываемых ими инфекций — началась в последние годы XIX века. Хотя Эдвард Дженнер и Луи Пастер разработали первые вакцины для защиты от вирусных инфекций, они не знали о существовании вирусов. Первые доказательства существования вирусов были получены в ходе экспериментов с фильтрами, поры которых были достаточно малы, чтобы удерживать бактерии. В 1892 году Дмитрий Ивановский использовал один из таких фильтров, чтобы показать, что сок больного табачного растения оставался инфекционным для здоровых табачных растений, несмотря на фильтрацию. Мартинус Бейеринк назвал отфильтрованное инфекционное вещество «вирусом», и это открытие считается началом вирусологии .
Последующее открытие и частичная характеристика бактериофагов Фредериком Твортом и Феликсом д'Эреллем еще больше стимулировали эту область, и к началу 20 века было открыто много вирусов. В 1926 году Томас Милтон Риверс определил вирусы как облигатных паразитов. Венделл Мередит Стэнли продемонстрировал, что вирусы являются частицами, а не жидкостью, а изобретение электронного микроскопа в 1931 году позволило визуализировать их сложные структуры.


Несмотря на другие свои успехи, Луи Пастер (1822–1895) не смог найти возбудителя бешенства и размышлял о патогене, слишком маленьком для обнаружения с помощью микроскопа. [1] В 1884 году французский микробиолог Шарль Шамберлан (1851–1931) изобрел фильтр, известный сегодня как фильтр Шамберлана , поры которого были меньше, чем бактерии. Таким образом, он мог пропускать раствор, содержащий бактерии, через фильтр и полностью удалять их из раствора. [2]
В 1876 году Адольф Майер , руководивший сельскохозяйственной экспериментальной станцией в Вагенингене , первым показал, что то, что он назвал «болезнью табачной мозаики», было инфекционным. Он считал, что ее вызывает либо токсин, либо очень маленькая бактерия. Позже, в 1892 году, русский биолог Дмитрий Ивановский (1864–1920) использовал фильтр Чемберленда для изучения того, что сейчас известно как вирус табачной мозаики . Его эксперименты показали, что измельченные экстракты листьев инфицированных растений табака остаются инфекционными после фильтрации. Ивановский предположил, что инфекция может быть вызвана токсином, вырабатываемым бактериями, но не стал развивать эту идею. [3]
В 1898 году голландский микробиолог Мартинус Бейеринк (1851–1931), преподаватель микробиологии в сельскохозяйственной школе в Вагенингене, повторил эксперименты Адольфа Майера и убедился, что фильтрат содержит новую форму инфекционного агента. [4] Он заметил, что агент размножается только в делящихся клетках, и назвал его contagium vivum fluidum (растворимый живой микроб) и вновь ввел слово вирус . [3] Бейеринк утверждал, что вирусы по своей природе являются жидкостями, теория, позже опровергнутая американским биохимиком и вирусологом Венделлом Мередитом Стэнли (1904–1971), который доказал, что они на самом деле являются частицами. [3] В том же 1898 году Фридрих Леффлер (1852–1915) и Пауль Фрош (1860–1928) пропустили первый вирус животных через аналогичный фильтр и открыли причину ящура . [5]
Первым идентифицированным вирусом человека был вирус желтой лихорадки . [6] В 1881 году Карлос Финлей (1833–1915), кубинский врач, впервые провел и опубликовал исследование, которое показало, что комары являются переносчиками желтой лихорадки, [7] теория была доказана в 1900 году комиссией во главе с Уолтером Ридом (1851–1902). В течение 1901 и 1902 годов Уильям Кроуфорд Горгас (1854–1920) организовал уничтожение мест размножения комаров на Кубе, что резко снизило распространенность заболевания. [8] Позднее Горгас организовал уничтожение комаров в Панаме, что позволило открыть Панамский канал в 1914 году. [9] Вирус был окончательно изолирован Максом Тайлером (1899–1972) в 1932 году, который продолжил разработку успешной вакцины. [10]
К 1928 году о вирусах было известно достаточно, чтобы опубликовать « Фильтруемые вирусы» — сборник эссе, охватывающий все известные вирусы, под редакцией Томаса Милтона Риверса (1888–1962). Риверс, переживший брюшной тиф, которым он заразился в возрасте двенадцати лет, сделал выдающуюся карьеру в вирусологии. В 1926 году его пригласили выступить на собрании, организованном Обществом американской бактериологии, где он впервые сказал: «Вирусы, по-видимому, являются облигатными паразитами в том смысле, что их размножение зависит от живых клеток». [11]
Представление о том, что вирусы являются частицами, не считалось неестественным и хорошо вписывалось в микробную теорию . Предполагается, что доктор Дж. Буист из Эдинбурга был первым человеком, увидевшим вирусные частицы в 1886 году, когда он сообщил о наблюдении «микрококков» в вакцинной лимфе, хотя он, вероятно, наблюдал скопления коровьей оспы . [12] В последующие годы, по мере совершенствования оптических микроскопов, «тельца включения» были обнаружены во многих инфицированных вирусом клетках, но эти агрегаты вирусных частиц были все еще слишком малы, чтобы выявить какую-либо подробную структуру. Только с изобретением электронного микроскопа в 1931 году немецкими инженерами Эрнстом Руской (1906–1988) и Максом Кноллем (1887–1969) [13] было показано , что вирусные частицы, особенно бактериофаги , имеют сложную структуру. Размеры вирусов, определенные с помощью этого нового микроскопа, хорошо соответствовали размерам, оцененным с помощью экспериментов по фильтрации. Ожидалось, что вирусы будут маленькими, но диапазон размеров оказался сюрпризом. Некоторые из них были лишь немного меньше самых маленьких известных бактерий, а более мелкие вирусы имели размеры, схожие со сложными органическими молекулами. [14]
В 1935 году Уэнделл Стэнли исследовал вирус табачной мозаики и обнаружил, что он в основном состоит из белка. [15] В 1939 году Стэнли и Макс Лауффер (1914) разделили вирус на белок и нуклеиновую кислоту , [16] которая, как показал научный сотрудник Стэнли Хьюберт С. Лоринг, представляет собой РНК . [17] Открытие РНК в частицах было важным, поскольку в 1928 году Фред Гриффит ( ок. 1879–1941 ) предоставил первые доказательства того, что ее «кузен», ДНК , образует гены . [18]
Во времена Пастера и в течение многих лет после его смерти слово «вирус» использовалось для описания любой причины инфекционного заболевания. Многие бактериологи вскоре обнаружили причину многочисленных инфекций. Однако некоторые инфекции остались, многие из них были ужасными, для которых не удалось найти бактериальную причину. Эти агенты были невидимы и могли быть выращены только на живых животных. Открытие вирусов проложило путь к пониманию этих загадочных инфекций. И хотя постулаты Коха не могли быть выполнены для многих из этих инфекций, это не остановило первых вирусологов от поиска вирусов в инфекциях, для которых не удалось найти никакой другой причины. [19]

Бактериофаги — это вирусы, которые заражают и размножаются в бактериях. Они были открыты в начале 20 века английским бактериологом Фредериком Твортом (1877–1950). [20] Но до этого времени, в 1896 году, бактериолог Эрнест Ханбери Ханкин (1865–1939) сообщил, что что-то в водах реки Ганг может убить Vibrio cholerae — причину холеры . Возбудитель в воде можно было пропустить через фильтры, которые удаляют бактерии, но он разрушался при кипячении. [21] Творт открыл действие бактериофагов на стафилококковые бактерии. Он заметил, что при выращивании на питательном агаре некоторые колонии бактерий становились водянистыми. Он собрал некоторые из этих водянистых колоний и пропустил их через фильтр Чемберленда, чтобы удалить бактерии, и обнаружил, что когда фильтрат добавляли к свежим культурам бактерий, они, в свою очередь, становились водянистыми. [20] Он предположил, что агентом может быть «амеба, ультрамикроскопический вирус, живая протоплазма или фермент, обладающий способностью к росту». [21]
Феликс д'Эрелль (1873–1949) был в основном самоучкой французско-канадским микробиологом. В 1917 году он обнаружил, что «невидимый антагонист», добавленный к бактериям на агаре , будет производить области мертвых бактерий. [20] Антагонист, теперь известный как бактериофаг, мог проходить через фильтр Шамберленда. Он точно разбавил суспензию этих вирусов и обнаружил, что самые высокие разбавления (самые низкие концентрации вируса), вместо того чтобы убивать все бактерии, образовывали дискретные области мертвых организмов. Подсчет этих областей и умножение на коэффициент разбавления позволило ему вычислить количество вирусов в исходной суспензии. [22] Он понял, что открыл новую форму вируса, и позже ввел термин «бактериофаг». [23] [24] Между 1918 и 1921 годами д'Эрелль открыл различные типы бактериофагов, которые могли инфицировать несколько других видов бактерий, включая Vibrio cholerae . [25] Бактериофаги были объявлены потенциальным средством лечения таких заболеваний, как тиф и холера , но их обещания были забыты с появлением пенициллина . [23] С начала 1970-х годов бактерии продолжали развивать устойчивость к антибиотикам, таким как пенициллин , и это привело к возобновлению интереса к использованию бактериофагов для лечения серьезных инфекций . [26]
Д'Эрелль много путешествовал, чтобы продвигать использование бактериофагов в лечении бактериальных инфекций. В 1928 году он стал профессором биологии в Йельском университете и основал несколько научно-исследовательских институтов. [27] Он был убежден, что бактериофаги являются вирусами, несмотря на противодействие со стороны признанных бактериологов, таких как лауреат Нобелевской премии Жюль Борде (1870–1961). Борде утверждал, что бактериофаги не являются вирусами, а всего лишь ферментами, выделяемыми «лизогенными» бактериями. Он сказал, что «невидимого мира д'Эрелля не существует». [28] Но в 1930-х годах доказательство того, что бактериофаги являются вирусами, было предоставлено Кристофером Эндрюсом (1896–1988) и другими. Они показали, что эти вирусы различаются по размеру, а также по своим химическим и серологическим свойствам. В 1940 году была опубликована первая электронная микрофотография бактериофага, и это заставило замолчать скептиков, которые утверждали, что бактериофаги являются относительно простыми ферментами, а не вирусами. [29] Было быстро обнаружено множество других типов бактериофагов, и было показано, что они заражают бактерии везде, где их можно найти. Ранние исследования были прерваны Второй мировой войной . Д'Эрелль, несмотря на свое канадское гражданство, был интернирован правительством Виши до конца войны. [30]
Знания о бактериофагах возросли в 1940-х годах после формирования Phage Group учеными по всей территории США. Среди членов был Макс Дельбрюк (1906–1981), который основал курс по бактериофагам в лаборатории Cold Spring Harbor . [26] Другими ключевыми членами Phage Group были Сальвадор Лурия (1912–1991) и Альфред Херши (1908–1997). Вместе с Дельбрюком они были совместно награждены Нобелевской премией по физиологии и медицине 1969 года «за открытия, касающиеся механизма репликации и генетической структуры вирусов». [31] В 1950-х годах Херши и Чейз сделали важные открытия в области репликации ДНК во время своих исследований бактериофага под названием T2 . С тех пор изучение бактериофагов дало возможность глубже понять включение и выключение генов, а также полезный механизм внедрения чужеродных генов в бактерии и многие другие фундаментальные механизмы молекулярной биологии . [32]
В 1882 году Адольф Майер (1843–1942) описал состояние растений табака, которое он назвал «мозаичной болезнью» («mozaïkziekte»). Больные растения имели пестрые листья, которые были пятнистыми . [33] Он исключил возможность грибковой инфекции и не смог обнаружить никаких бактерий, а также предположил, что был задействован «растворимый, подобный ферменту инфекционный принцип». [34] Он не развивал свою идею дальше, и именно фильтрационные эксперименты Ивановского и Бейеринка предположили, что причиной был ранее неизвестный инфекционный агент. После того, как табачная мозаика была признана вирусным заболеванием, были обнаружены вирусные инфекции многих других растений. [34]
Значение вируса табачной мозаики в истории вирусов невозможно переоценить. Это был первый вирус, который был обнаружен, и первый, который был кристаллизован , и его структура была показана в деталях. Первые рентгеновские дифракционные снимки кристаллизованного вируса были получены Берналом и Фанкухеном в 1941 году. На основе ее снимков Розалинд Франклин открыла полную структуру вируса в 1955 году. [35] В том же году Хайнц Френкель-Конрат и Робли Уильямс показали, что очищенная РНК вируса табачной мозаики и его белок оболочки могут собираться сами по себе, образуя функциональные вирусы, предполагая, что этот простой механизм, вероятно, был средством, с помощью которого вирусы были созданы внутри своих клеток-хозяев. [36]
К 1935 году считалось, что многие болезни растений вызываются вирусами. В 1922 году Джон Канкель Смолл (1869–1938) обнаружил, что насекомые могут выступать в качестве переносчиков и передавать вирусы растениям. В последующее десятилетие было показано, что многие болезни растений вызываются вирусами, переносимыми насекомыми, а в 1939 году Фрэнсис Холмс, пионер в области вирусологии растений, [37] описал 129 вирусов, вызывающих заболевания растений. [38] Современное интенсивное сельское хозяйство обеспечивает богатую среду для многих вирусов растений. В 1948 году в Канзасе, США, 7% урожая пшеницы было уничтожено вирусом полосатой мозаики пшеницы . Вирус распространялся клещами, называемыми Aceria tubulpae . [39]
В 1970 году русский фитовирусолог Иосиф Атабеков обнаружил, что многие вирусы растений заражают только один вид растения-хозяина. [37] Международный комитет по таксономии вирусов в настоящее время признает более 900 вирусов растений. [40]
К концу 19 века вирусы были определены с точки зрения их инфекционности , их способности фильтроваться и их потребности в живых хозяевах. До этого времени вирусы выращивались только на растениях и животных, но в 1906 году Росс Грэнвилл Харрисон (1870–1959) изобрел метод выращивания ткани в лимфе , [41] а в 1913 году Э. Стейнхардт, К. Израэли и Р. А. Ламберт использовали этот метод для выращивания вируса вакцинии во фрагментах роговичной ткани морской свинки. [42] В 1928 году Х. Б. и М. К. Мейтленд вырастили вирус вакцинии в суспензии измельченных почек кур. [43] Их метод не получил широкого распространения до 1950-х годов, когда полиовирус был выращен в больших масштабах для производства вакцин. [44] В 1941–42 годах Джордж Херст (1909–94) разработал анализы, основанные на гемагглютинации, для количественной оценки широкого спектра вирусов, а также вирусспецифических антител в сыворотке. [45] [46]

Хотя вирус гриппа, вызвавший пандемию гриппа 1918–1919 годов , не был обнаружен до 1930-х годов, описания заболевания и последующие исследования доказали, что виноват именно он. [47] Пандемия унесла жизни 40–50 миллионов человек менее чем за год, [48] но доказательства того, что она была вызвана вирусом, были получены только в 1933 году. [49] Haemophilus influenzae — это условно-патогенная бактерия, которая обычно сопровождает инфекции гриппа; это привело выдающегося немецкого бактериолога Рихарда Пфайффера (1858–1945) к неверному выводу, что эта бактерия является причиной гриппа. [50] Крупный прорыв произошел в 1931 году, когда американский патолог Эрнест Уильям Гудпасчер вырастил грипп и несколько других вирусов в оплодотворенных куриных яйцах. [51] Херст идентифицировал ферментативную активность, связанную с вирусной частицей, позже охарактеризованную как нейраминидаза , первая демонстрация того, что вирусы могут содержать ферменты. Фрэнк Макфарлейн Бернет показал в начале 1950-х годов, что вирус рекомбинирует с высокой частотой, и Херст позже сделал вывод, что у него сегментированный геном. [52]
В 1949 году Джон Ф. Эндерс (1897–1985) , Томас Уэллер (1915–2008) и Фредерик Роббинс (1916–2003) впервые вырастили вирус полиомиелита в культивируемых клетках человеческого эмбриона, первый вирус, выращенный без использования твердых тканей животных или яиц. Инфекции полиовирусом чаще всего вызывают самые легкие симптомы. Это не было известно, пока вирус не был выделен в культивируемых клетках, и было показано, что у многих людей были легкие инфекции, которые не приводили к полиомиелиту. Но, в отличие от других вирусных инфекций, заболеваемость полиомиелитом — более редкой тяжелой формой инфекции — возросла в 20 веке и достигла пика около 1952 года. Изобретение системы клеточной культуры для выращивания вируса позволило Джонасу Солку (1914–1995) создать эффективную вакцину против полиомиелита . [53]
Денис Парсонс Беркитт (1911–1993) родился в Эннискиллене, графство Фермана, Ирландия. Он был первым, кто описал тип рака, который теперь носит его имя — лимфома Беркитта . Этот тип рака был эндемичным в экваториальной Африке и был самой распространенной злокачественной опухолью у детей в начале 1960-х годов. [54] В попытке найти причину рака Беркитт отправил клетки опухоли Энтони Эпштейну (р. 1921), британскому вирусологу, который вместе с Ивонной Барр и Бертом Ачонгом (1928–1996) после многих неудач обнаружил вирусы, которые напоминали вирус герпеса в жидкости, которая окружала клетки. Позже было показано, что вирус является ранее неизвестным вирусом герпеса, который теперь называется вирусом Эпштейна–Барр . [55] Удивительно, но вирус Эпштейна–Барр является очень распространенной, но относительно легкой инфекцией европейцев. Почему он может вызывать такую разрушительную болезнь у африканцев, до конца не понятно, но причиной может быть снижение иммунитета к вирусу, вызванное малярией . [56] Вирус Эпштейна-Барр важен в истории вирусов, поскольку является первым вирусом, вызывающим рак у людей. [57]
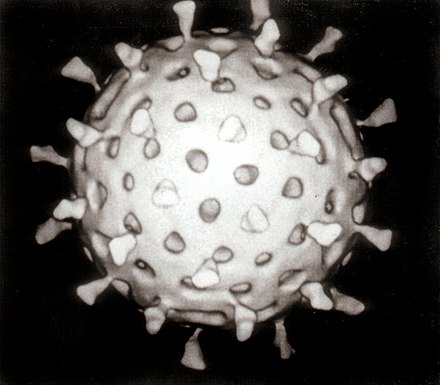
Вторая половина 20-го века была золотым веком открытия вирусов, и большинство из 2000 признанных видов вирусов животных, растений и бактерий были открыты в эти годы. [58] [59] В 1946 году был открыт вирус диареи крупного рогатого скота , [60] который до сих пор, возможно, является наиболее распространенным патогеном крупного рогатого скота во всем мире [61] , а в 1957 году был открыт артеривирус лошадей . [62] В 1950 - х годах усовершенствования в методах изоляции и обнаружения вирусов привели к открытию нескольких важных вирусов человека, включая вирус ветряной оспы , [63] парамиксовирусы [64] — которые включают вирус кори [65] и респираторно-синцитиальный вирус [64] — и риновирусы, вызывающие простуду . [ 66] В 1960-х годах было открыто больше вирусов. В 1963 году вирус гепатита В был открыт Барухом Блумбергом (р. 1925). [67] Обратная транскриптаза , ключевой фермент, который ретровирусы используют для перевода своей РНК в ДНК, была впервые описана в 1970 году независимо Говардом Темином и Дэвидом Балтимором (р. 1938). [68] Это было важно для разработки противовирусных препаратов — ключевого поворотного момента в истории вирусных инфекций. [69] В 1983 году Люк Монтанье (р. 1932) и его команда в Институте Пастера во Франции впервые изолировали ретровирус, который теперь называется ВИЧ. [70] В 1989 году команда Майкла Хоутона в корпорации Chiron открыла гепатит C. [ 71] Новые вирусы и штаммы вирусов открывались каждое десятилетие второй половины 20-го века. Эти открытия продолжились в 21-м веке, поскольку появились новые вирусные заболевания, такие как атипичная пневмония [72] и вирус нипа [73] . Несмотря на достижения ученых за последние сто лет, вирусы продолжают представлять новые угрозы и проблемы. [74]
{{cite book}}: |journal=проигнорировано ( помощь )