Синтез пиридина по Кренке — это реакция в органическом синтезе между солями метилкетона α-пиридиния и α, β-ненасыщенными карбонильными соединениями, используемыми для получения высокофункционализированных пиридинов . Пиридины широко распространены в природных и синтетических продуктах, поэтому существует большой интерес к путям их синтеза. Метод назван в честь Фрица Кренке.
В своей работе в Университете Гиссена Крёнке наблюдал конденсацию α-пиридиновых метилкетоновых солей 1 с α ,β-ненасыщенными карбонильными соединениями 2 посредством реакции Михаэля при обработке ацетатом аммония с получением 2,4,6-тризамещенных пиридинов с высокими выходами в мягких условиях реакции. [1] Предложенные промежуточные продукты, 1,5-дикарбонильное соединение 3 , не были выделены. [2] С момента своего открытия синтез Крёнке получил широкое применение для получения производных ди-, три- и тетрапиридина, продемонстрировав ряд преимуществ по сравнению с родственными реакциями, такими как синтез пиридина Ганча .

Механизм синтеза пиридина по Кренке начинается с енолизации α-пиридинового метилкетона 4 с последующим 1,4-присоединением к α, β-ненасыщенному кетону 5 с образованием аддукта Михаэля 6 , который немедленно таутомеризуется в 1,5-дикарбонил 7. Добавление аммиака к 7 с последующей дегидратацией через 8 дает промежуточный имин 9. , [ 3] [4] Затем промежуточный имин депротонируется в енамин 10 и циклизуется с карбонилом с образованием промежуточного соединения 11. Затем катион пиридиния удаляется с образованием гидроксидиенамина 12. Ароматизация 12 посредством последующей потери воды дает желаемый пиридиновый гетероцикл 13 .

Исходные материалы для синтеза Крёнке часто тривиальны для приготовления, что обеспечивает удобство и широкий охват метода. Получение солей α-пиридинийметилкетона может быть легко достигнуто путем обработки соответствующего бромметилкетона пиридином. α,β-ненасыщенные кетоны часто доступны коммерчески или могут быть получены с использованием ряда известных методов. Кроме того, основания Манниха также могут быть использованы в качестве акцептора Михаэля для схемы, что еще больше диверсифицирует объем исходных материалов, которые могут быть включены в схему Крёнке. [5]
Условия реакции для синтеза Крёнке, как правило, просты, и реакции часто протекают с высоким выходом при температуре реакции, обычно не превышающей 140 °C. [6] Синтез Крёнке обычно проводится либо в ледяной уксусной кислоте , либо в метаноле, но его также можно проводить в водных условиях, а в последнее время и в условиях без растворителя.
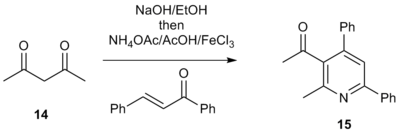
1,3-дикарбонильные соединения также оказались жизнеспособными исходными материалами вместо солей α-пиридиния метилкетона. [7] Например, обработка 1,3-дикетона 14 основанием в этаноле с последующей обработкой ацетатом аммония, уксусной кислотой, соответствующим еноном и кислотой Льюиса дает 3-ацилтриарилпиридины формы 15. Эти ацилпиридины являются привлекательными промежуточными продуктами, поскольку они имеют электрофильную ручку, которая позволяет включать в молекулу дополнительную функциональность. Это позволяет осуществлять прямое построение сложных полиарильных систем, привлекательный метод для библиотечного синтеза лекарственных мишеней, содержащих функционализированные пиридиновые фрагменты.
Синтез Кренке для получения пиридинов обладает рядом кратких преимуществ по сравнению с другими методами. В отличие от синтеза Ганча, [8] метод Кренке не требует окисления для получения желаемого продукта, поскольку α-пиридиновый метилкетон уже обладает правильной степенью окисления.
Другим преимуществом синтеза Крёнке является его высокая атомная экономичность . Например, синтез Чичибабина требует 2 эквивалента ненасыщенного исходного материала. [9] Кроме того, побочными продуктами синтеза Крёнке являются вода и пиридин, что позволяет упростить протоколы обработки и очистки. В отличие от сопоставимых методов синтеза пиридина, синтез Крёнке выигрывает от того, что является высокопродуктивным синтезом в одном сосуде, что в конечном итоге позволяет сокращать синтетические пути и еще больше упрощает каталогизацию комбинаторной библиотеки.
Широкий охват синтеза пиридина по Кренке сделал его особенно полезным для синтеза полиарильных систем, включая пиридильные, тиенильные и фуранильные фрагменты. Метод допускает широкий спектр арильных заместителей как на фрагменте α-пиридинийметилкетона, так и на α, β-ненасыщенных карбонильных соединениях и, таким образом, может использоваться для создания широкого каталога полиарильных систем. Кроме того, электроноакцепторные группы и электронодонорные группы на входящих арильных заместителях хорошо переносятся. Синтез по Кренке также может использовать алкильные и винильные заместители, что также дает умеренные или хорошие выходы. [10] Благодаря своей широкой области применения метод Кренке нашел широкое применение для синтеза бипиридинов ( 16 ), терпиридинов ( 17 ), кватерпиридинов ( 18 ) и даже септипиридинов ( 19 ), как показано ниже. [11]
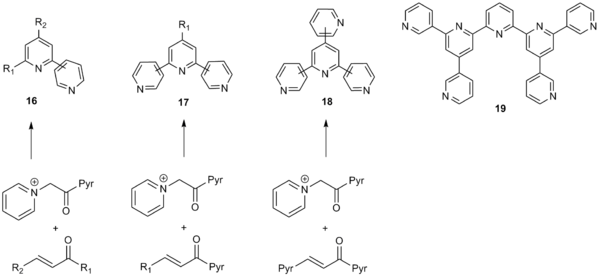
Метод Кренке применяется в синтезе триарилпиридинов без растворителя, который осуществляется посредством гомосочетания двух диарилзамещенных α, β-ненасыщенных карбонильных соединений. [12] Эта стратегия предлагает простые способы получения пиридильных арильных систем, которые являются важными фрагментами многих полезных лекарственных структур.

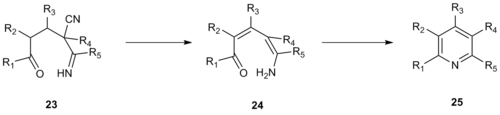
В 1992 году Робинсон и его коллеги разработали аналогичный синтез пиридина, используя енаминонитрилы в качестве одного из трехуглеродных фрагментов вместо α-пиридинметилкетона. [13] Это улучшение увеличивает реакционную способность системы и позволяет образовывать полностью замещенные пиридины, тогда как использование α-пиридинметилкетона требует, чтобы 3- или 5-положение в полученном пиридине было незамещенным. Конденсация Кренке енаминонитрила 20 с еноном 21 дала конденсированный пиридин 22 .

Механизм этой реакции типа Крёнке, вероятно, протекает через винилогичный цианамид 23 , который подвергается элиминированию синильной кислоты , депротонированию с образованием енамина 24 и циклизации с образованием промежуточного соединения 25 , которое затем дегидратируется с образованием желаемого пиридинового продукта.
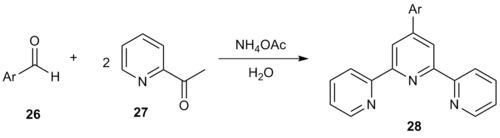
Чистый однореакторный метод Кренке в водной среде генерирует 4'-арил-2,2':6', 2''-терпиридины. [ 14] Реакция арилальдегида 26 с двумя эквивалентами 2-ацетилпиридина ( 27 ) дала терпиридины формы 28 .
В дополнение к вариациям оригинального метода, ряд комбинаторных исследований с использованием синтеза Крёнке и его вариаций были использованы для синтеза обширных библиотек высокофункционализированных пиридинов. Янда и его коллеги использовали общую схему реакции Крёнке для создания библиотеки из 220 соединений. [15] Различные метилкетоны 29 и альдегиды 30 были связаны посредством альдольной конденсации с получением енонов формы 31. Затем эти соединения реагировали с различными α-пиридиновыми метилкетонами 32 с получением желаемого тризамещенного пиридина 33 .
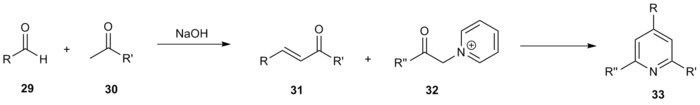
В 2009 году Ту и его коллеги разработали 3-фрагментную, однореакторную комбинаторную стратегию для разработки 3-цианотерпиридинов 34 и 1-амино-2-ацилтерпиридинов 35 . [16] Эти комбинаторные вариации реакции Крёнке обеспечивают эффективную синтетическую стратегию для полиарилпиридиновых каркасов. Эта методология также будет полезна для биологических анализов и скрининговых экспериментов.

Методология Кренке также использовалась для получения ряда интересных лигандов, связывающих металлы, поскольку полипиридильные комплексы, такие как бипиридин (bipy), широко использовались в качестве лигандов. Синтез Кренке использовался для получения семейства лигандов N, S-типа на основе тетрагидрохинолина. [17] 2-тиофенилацетофенон ( 36 ) был подвергнут реакции с газообразным йодом и пиридином с количественным выходом для получения ацилметилпиридиний йодида 37. Реакция с хиральным циклическим α, β-ненасыщенным кетоном, полученным из 2-(+)-карена, дала желаемый лиганд N, S-типа 38 .

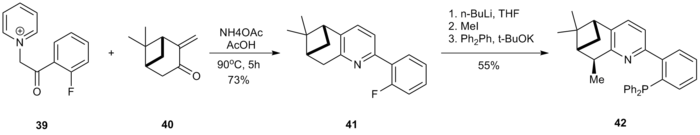
Новые хиральные P, N-лиганды были получены с использованием метода Кренке. [18] Ацилкетоновая соль α-пиридиния 39 была циклизована с производным пинокарвона 40 для получения пиридина 41. Бензильная позиция 41 была метилирована, и последующая реакция SnAr с дифенилфосфидом калия привела к получению лиганда 42 .
Реакция Крёнке также нашла применение в синтезе ряда биологически активных соединений в дополнение к тем, которые каталогизированы в комбинаторных исследованиях. Келли и его коллеги разработали путь к цикло-2,2′:4′,4′′:2′′,2′′′:4′′′,4′′′′:2′′′′,2′′′′′:4′′′′,4-сексипиридину, используя реакции Крёнке в качестве ключевого этапа макроциклизации . [19] Полипиридиновый комплекс 43 обрабатывали N-бромсукцинимидом во влажном тетрагидрофуране, а затем пиридином, чтобы получить ацилметилпиридиновую соль 44 , которая затем может подвергаться макроциклизации в стандартных условиях с получением желаемого продукта 45. Метод Кренке в этом синтезе имел решающее значение из-за неудачи других методов циклизации, таких как сочетание Глазера или сочетание Ульмана .

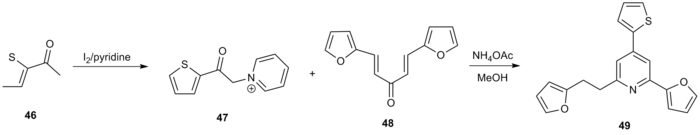
Другим применением синтеза пиридина по Кренке было получение ряда 2,4,6-тризамещенных пиридинов, которые исследовались как потенциальные ингибиторы топоизомеразы 1. [20] 2-ацетилтиофен ( 46 ) обрабатывали йодом и пиридином для получения ацилкетона α-пиридиния 47. Реакция с акцептором Михаэля 48 в стандартных условиях дала функционализированный пиридин 49 с общим выходом 60%.
В конечном счете, синтез пиридина по Кренке предлагает простой и прямой подход к синтезу широкого спектра функционализированных пиридинов и полиарильных систем. Методология Кренке была применена к ряду стратегий в направлении интересных лигандов и биологически значимых молекул. Кроме того, реакция Кренке и ее вариации предлагают ряд преимуществ по сравнению с альтернативными методами синтеза пиридина, начиная от однореакторных вариаций без органических растворителей и заканчивая высокоатомной экономией.