Некротический фасциит ( НФ ), также известный как болезнь, поедающая плоть , представляет собой бактериальную инфекцию , которая приводит к отмиранию частей мягких тканей тела . [3] Это тяжелое заболевание с внезапным началом, которое быстро распространяется. [ 3] Симптомы обычно включают красную или фиолетовую кожу в пораженной области, сильную боль, лихорадку и рвоту. [3] Наиболее часто поражаются конечности и промежность . [ 2]
Обычно инфекция проникает в организм через повреждение кожи, например, через порез или ожог . [3] Факторы риска включают в себя слабую иммунную функцию, например, из-за диабета или рака , ожирения , алкоголизма , внутривенного употребления наркотиков и заболевания периферических артерий . [2] [3] Обычно она не распространяется между людьми. [3] Заболевание подразделяется на четыре типа в зависимости от возбудителя. [4] От 55 до 80% случаев связаны с более чем одним типом бактерий . [4] Метициллин-резистентный золотистый стафилококк (MRSA) встречается в трети случаев. [4] Медицинская визуализация часто полезна для подтверждения диагноза. [4]
Некротический фасциит можно предотвратить с помощью надлежащего ухода за раной и мытья рук . [3] Обычно его лечат хирургическим путем, чтобы удалить инфицированную ткань , и внутривенными антибиотиками . [2] [3] Часто используется комбинация антибиотиков, таких как пенициллин G , клиндамицин , внутривенный ванкомицин и гентамицин . [2] Задержки в хирургии связаны с гораздо более высоким риском смерти. [4] Несмотря на высококачественное лечение, риск смерти составляет от 25 до 35%. [2]
Некротический фасциит встречается примерно у 4 человек на миллион в год в США и примерно у 1 на 100 000 в Западной Европе. [4] Оба пола страдают им в равной степени. [2] Он становится более распространенным среди пожилых людей и редко встречается у детей. [4] Он был описан по крайней мере со времен Гиппократа . [2] Термин «некротический фасциит» впервые вошел в употребление в 1952 году. [4] [7]
Симптомы могут включать лихорадку, отек и жалобы на чрезмерную боль. Первоначальные изменения кожи похожи на целлюлит или абсцесс , что затрудняет диагностику на ранних стадиях. Уплотнение кожи и мягких тканей и отек за пределами области изменений кожи обычно присутствуют у людей с ранними некротическими изменениями. [2] Покраснение и отек обычно сливаются с окружающими нормальными тканями. Поверхностная кожа может выглядеть блестящей и напряженной. [8] Другие признаки, которые больше указывают на некротические изменения (но присутствуют на более поздних стадиях в 7–44 % случаев): образование булл , кровотечение в кожу , которое присутствует до некроза кожи [2] (кожа становится красной и фиолетовой из-за тромбоза кровеносных сосудов), [8] наличие газа в тканях и снижение или отсутствие чувствительности на коже [2] (из-за некроза подлежащих нервов). [8] Быстрое прогрессирование до шока, несмотря на терапию антибиотиками, является еще одним признаком некротического фасциита. Некротические изменения, поражающие паховую область, известны как гангрена Фурнье . [2]
Однако у тех, кто имеет иммунодефицит (болеют раком, принимают кортикостероиды , проходят радиотерапию , химиотерапию , ВИЧ/СПИД или перенесли трансплантацию органов или костного мозга ), типичные симптомы могут отсутствовать. У людей с иммунодефицитом также в два раза выше риск смерти от некротических инфекций, поэтому в этой группе следует проявлять повышенную бдительность. [2]
Более 70% случаев регистрируются у людей с по крайней мере одной из этих клинических ситуаций: иммуносупрессия, диабет, алкоголизм/наркомания/курение, злокачественные новообразования и хронические системные заболевания. По неясным причинам это иногда происходит у людей с, казалось бы, нормальным общим состоянием. [9]
Некротический фасциит может возникнуть в любой части тела, но чаще всего он наблюдается на конечностях, промежности и половых органах . Лишь немногие из таких случаев возникают в груди и животе. Травма является обычной причиной инфекции, например, внутривенная инъекция наркотиков, инъекция инсулина, укусы животных и насекомых, введение катетера через кожу или свищ , соединяющий кожу с внутренними органами тела. Кожные инфекции, такие как абсцесс и язвы, также могут осложнить некротический фасциит. Распространение инфекции через кровь было предложено для людей со стрептококковым фарингитом. Для инфекции промежности и половых органов ( гангрена Фурнье ) обычными причинами являются травма, хирургическое вмешательство, инфекция мочевыводящих путей , камни и абсцесс бартолиновой железы . [2]
Риск развития некротического фасциита из раны можно снизить путем надлежащего ухода за раной и мытья рук. [3]
Типы некротизирующей инфекции мягких тканей можно разделить на четыре класса в зависимости от типов бактерий, инфицирующих мягкие ткани. Эта система классификации была впервые описана Джулиано и его коллегами в 1977 году. [4] [2]
Инфекция I типа : это наиболее распространенный тип инфекции, на долю которого приходится 70–80 % случаев. Она вызывается смесью типов бактерий, обычно в области живота или паха. [4] Этот тип инфекции обычно вызывается различными видами грамположительных кокков ( Staphylococcus aureus , Streptococcus pyogenes и энтерококки ), грамотрицательных палочек ( Escherichia coli , Pseudomonas aeruginosa ) и анаэробов ( виды Bacteroides и Clostridium ). [4] Популяции, затронутые этим заболеванием, как правило, старше и имеют сопутствующие заболевания, такие как сахарный диабет, ожирение и иммунодефицит. [4] Обычно травма не является причиной таких инфекций. Может быть выявлена предыдущая история абсцесса или перфорации кишечника с бактериальной транслокацией . Клостридиальная инфекция составляет 10 % инфекций I типа. Виды Clostridium , вовлеченные в это, — Clostridium perfringens , Clostridium septicum и Clostridium sordellii , которые обычно вызывают газовую гангрену (также известную как мионекроз). Clostridium perfringens вырабатывает два смертельных токсина: альфа-токсин и тета-токсин. Альфа-токсин вызывает чрезмерную агрегацию тромбоцитов, которая блокирует кровеносные сосуды и лишает жизненно важные органы снабжения кислородом. Это создает кислую среду с недостатком кислорода для размножения бактерий. Когда альфа-токсин поглощается мягкими тканями, он может подавлять миграцию лейкоцитов из кровеносных сосудов в мягкие ткани , тем самым нарушая функцию фагоцитов . Два токсина вместе могут вызвать разрушение эритроцитов в кровеносных сосудах , повреждение целостности кровеносных сосудов и подавление функции сердца. [ необходима цитата ]
Paraclostridium sordellii также может вырабатывать два основных токсина: все известные вирулентные штаммы вырабатывают основной фактор вирулентности летальный токсин (TcsL), а некоторые также вырабатывают геморрагический токсин (TcsH). TcsL и TcsH являются членами большого семейства клостридиальных цитотоксинов (LCC). [10] Ключевымфактором вирулентности Clostridium septicum является порообразующий токсин, называемый альфа-токсином, хотя он не связан с альфа-токсином Clostridium perfringens . Мионекрозные инфекции, вызванные этими видами клостридий, обычно возникают у потребителей инъекционного героина . Люди с клостридиальными инфекциями обычно испытывают сильную боль в месте раны, где из раны обычно выделяется дурно пахнущая кровь, смешанная с сывороткой (серозно-кровянистые выделения). Шок может быстро прогрессировать после первоначальной травмы или инфекции, и как только состояние шока установлено, вероятность смерти превышает 50%. Другая бактерия, связанная с подобным быстрым прогрессированием заболевания, — это стрептококковая инфекция группы А (в основном Streptococcus pyogenes ). Между тем, другим бактериальным инфекциям требуется два или более дней, чтобы проявиться симптоматика. [2]
Инфекция типа II : эта инфекция составляет от 20 до 30% случаев, в основном поражая конечности. [4] [11] В основном это касается бактерий Streptococcus pyogenes , отдельно или в сочетании со стафилококковыми инфекциями. Оба типа бактерий могут быстро прогрессировать и проявляться синдромом токсического шока . Виды Streptococcus продуцируют белок M , который действует как суперантиген , стимулируя массивный системный иммунный ответ, который неэффективен против бактериального антигена, вызывая шок. Инфекция типа II чаще поражает молодых, здоровых взрослых с травмами в анамнезе. [2]
Инфекция типа III : Vibrio vulnificus , бактерия, обнаруженная в соленой воде , является редкой причиной этой инфекции, которая возникает через повреждение кожи. Прогрессирование заболевания похоже на тип II, но иногда с небольшими видимыми изменениями кожи. [2]
Инфекция типа IV : Инфекция типа IV, которая составляет менее 1% случаев, вызывается грибком Candida albicans . Факторы риска включают возраст и иммунодефицит. [4] [12]
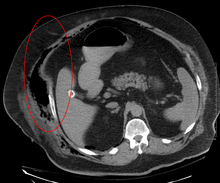

Ранняя диагностика затруднена, поскольку заболевание часто выглядит на ранней стадии как простая поверхностная инфекция кожи . [4] Хотя ряд лабораторных и визуальных методов может вызвать подозрение на некротический фасциит, ни один из них не может исключить его. [14] Золотым стандартом диагностики является хирургическое исследование в условиях высокой подозрительности. В случае сомнений можно сделать небольшой надрез в пораженной ткани, и если палец легко разделяет ткань вдоль фасциальной плоскости, диагноз подтверждается, и следует провести обширную хирургическую обработку . [2]
Визуализация играет ограниченную роль в диагностике некротизирующего фасциита. Задержка во времени при выполнении визуализации является серьезной проблемой. Обычная рентгенография может показать подкожную эмфизему (газ в подкожной клетчатке ), что настоятельно указывает на некротические изменения, но она недостаточно чувствительна, чтобы обнаружить все случаи, поскольку некротизирующие инфекции кожи, вызванные бактериями, отличными от клостридиальных инфекций, обычно не показывают подкожную эмфизему. Если диагноз все еще остается под вопросом, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) являются более чувствительными методами, чем простая рентгенография. Однако и КТ, и МРТ недостаточно чувствительны, чтобы полностью исключить некротические изменения. [2] КТ может показать фасциальное утолщение, отек, подкожный газ и образование абсцесса. [2] При МРТ, когда происходит скопление жидкости с вовлечением глубокой фасции, утолщение или усиление при инъекции контраста , следует серьезно подозревать некротизирующий фасциит. Между тем, ультрасонография может показать образование поверхностного абсцесса, но она недостаточно чувствительна для диагностики некротизирующего фасциита. [2] КТ способна обнаружить около 80% случаев, в то время как МРТ может выявить немного больше. [15]
Количество лейкоцитов в крови более 15 000 клеток/мм 3 и уровень натрия в сыворотке менее 135 ммоль/л имеют чувствительность 90% при обнаружении некротизирующей инфекции мягких тканей. [ требуется ссылка ] Он также имеет 99% вероятность исключения некротизирующих изменений, если значения показали иное . Разрабатываются различные системы оценки для определения вероятности развития некротизирующего фасциита, но система оценки, разработанная Вонгом и коллегами в 2004 году, является наиболее часто используемой. Это лабораторный индикатор риска некротизирующего фасциита (LRINEC), который можно использовать для стратификации по риску людей с признаками тяжелого целлюлита или абсцесса, чтобы определить вероятность наличия некротизирующего фасциита. Он использует шесть лабораторных значений: С-реактивный белок , общее количество лейкоцитов , гемоглобин , натрий , креатинин и глюкоза крови . [2] Оценка 6 и более баллов указывает на то, что некротический фасциит следует рассматривать всерьез. [16] Критерии оценки следующие:
Однако система подсчета баллов не была проверена. Значения будут ложноположительными, если присутствуют какие-либо другие воспалительные состояния. Поэтому значения, полученные с помощью этой системы подсчета баллов, следует интерпретировать с осторожностью. [2] Около 10% пациентов с некротизирующим фасциитом в первоначальном исследовании все еще имели балл LRINEC <6. [16] Проверочное исследование показало, что у пациентов с баллом LRINEC ≥6 наблюдается более высокий уровень как смерти, так и ампутации. [18]
Некротический фасциит можно частично предотвратить с помощью надлежащего ухода за ранами и мытья рук. [3]
Хирургическая обработка (удаление пораженной ткани) является основой лечения некротического фасциита. Раннее медикаментозное лечение часто является предположительным; таким образом, антибиотики следует начинать сразу же, как только возникло подозрение на это состояние. Для определения соответствующего покрытия антибиотиками берутся культуры тканей (а не мазки из раны), и антибиотики могут быть изменены в зависимости от результатов. Помимо контроля артериального давления и гидратации, следует начать поддержку для тех, у кого нестабильные показатели жизнедеятельности и низкий диурез. [2]
Агрессивная хирургическая обработка раны должна проводиться на ранней стадии, обычно сразу после постановки диагноза некротизирующей инфекции мягких тканей (NSTI). Хирургические разрезы часто выходят за пределы областей уплотнения (затвердевшей ткани), чтобы удалить поврежденные кровеносные сосуды, которые ответственны за уплотнение. Однако целлюлитные мягкие ткани иногда не подвергаются хирургической обработке для последующего покрытия раны кожей. Для удаления дополнительной некротической ткани может использоваться более одной операции. В некоторых случаях, когда конечность поражена NSTI, ампутация может быть предпочтительным хирургическим лечением. После хирургической обработки раны следует наложить соответствующие повязки, чтобы предотвратить обнажение костей, сухожилий и хрящей , чтобы такие структуры не высыхали и чтобы способствовать заживлению раны. [2]
При некротической инфекции промежности (гангрене Фурнье) хирургическая обработка раны и уход за ней могут быть затруднены из-за продуктов выделения, которые часто загрязняют эту область и влияют на процесс заживления раны. Поэтому регулярная смена повязок с использованием системы управления фекалиями может помочь сохранить чистоту раны в промежностной области. Иногда может потребоваться колостомия для отвода продуктов выделения, чтобы сохранить чистоту раны в промежностной области. [2]
Эмпирические антибиотики обычно начинаются сразу после постановки диагноза NSTI, а затем их меняют на антибиотикотерапию, контролируемую культурой. В случае NSTI эмпирические антибиотики имеют широкий спектр действия, охватывая грамположительные (включая MRSA), грамотрицательные и анаэробные бактерии. [19]
Хотя в исследованиях сравнивали моксифлоксацин (фторхинолон) и амоксициллин-клавуланат (пенициллин) и оценивали соответствующую продолжительность лечения (варьировалась от 7 до 21 дня), окончательных выводов относительно эффективности лечения, идеальной продолжительности лечения или побочных эффектов сделать не удалось из-за низкого качества доказательств. [19]
Некротический фасциит поражает около 0,4 из 100 000 человек в год в Соединенных Штатах. [4] Около 1000 случаев некротического фасциита регистрируется в Соединенных Штатах в год, но показатели растут. Это может быть связано с повышением осведомленности об этом состоянии, что приводит к увеличению числа сообщений, или бактериальной вирулентностью или повышением бактериальной устойчивости к антибиотикам. [2] В некоторых регионах мира это встречается так же часто, как один из 100 000 человек. [4]
Более высокие показатели некротизирующего фасциита наблюдаются у людей с ожирением или диабетом, а также у людей с ослабленным иммунитетом, алкоголизмом или заболеванием периферических артерий . Однако это заболевание может также возникнуть у молодых здоровых взрослых без сопутствующих заболеваний. НПВП могут повышать показатели некротизирующих инфекций из-за модификации иммунного ответа в организме, поскольку НПВП ингибируют ферменты циклоксигеназу -1 и циклоксигеназу-2, которые важны для выработки тромбоксана и простагландина E2 . Простагландин отвечает за лихорадку, воспаление и боль. Ингибирование выработки простагландина E2 снижает воспалительную реакцию и адгезию лейкоцитов и, таким образом, снижает иммунный ответ против бактериальной инвазии, что приводит к инфекции мягких тканей. [2]
В пятом веке до нашей эры Гиппократ описал некротическую инфекцию мягких тканей как болезнь, при которой у пораженных людей возникает « рожистое воспаление по всему телу, хотя причиной является лишь незначительный несчастный случай. Кости, плоть и сухожилия (шнур, сухожилия или нервы) отваливаются от тела, и происходит много смертей». Первое английское описание некротической инфекции мягких тканей было дано британским хирургом Леонардом Джиллеспи и британскими врачами Гилбертом Блейном и Томасом Троттером в 18 веке. В то время некротизирующие инфекции мягких тканей были известны под разными названиями: «фагеденическая язва» (изъязвление, которое распространяется и разрушает окружающие ткани), «гангренозная фагедена», «гангренозная язва», «злокачественная язва», «гнилозная язва», «молниеносная гангрена», «некротизирующая рожа», «гангренозная рожа», «крепитирующий целлюлит», «гангренозный целлюлит», «целлюлит Меленея», «некротизирующий синергический целлюлит», «гемолитическая стрептококковая гангрена», «прогрессирующая бактериальная синергическая гангрена» или «некротизирующий абсцесс». [20] Позже термин «госпитальная гангрена» стал использоваться чаще. В 1871 году хирург армии Конфедеративных Штатов Джозеф Джонс сообщил о 2642 случаях госпитальной гангрены с уровнем смертности 46%. В 1883 году доктор Жан-Альфред Фурнье описал некротизирующую инфекцию промежности и мошонки , которая теперь называется гангреной Фурнье . Термин «некротизирующий фасциит» был придуман Уилсоном в 1952 году. Его определение стало шире, включив в него не только инфекцию фасции , но и другие инфекции мягких тканей. [2] Несмотря на то, что медицинский мир не одобряет термин «галопирующая гангрена», он часто используется в сенсационных новостных СМИ для обозначения вспышек некротизирующего фасциита. [21]