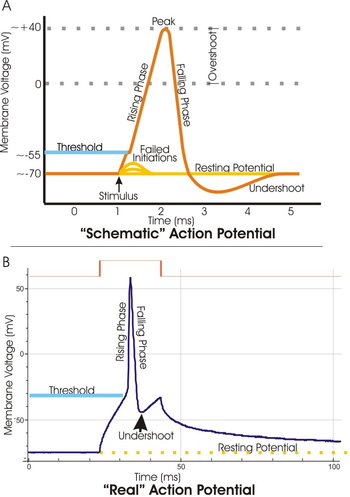
В электрофизиологии пороговый потенциал — это критический уровень, до которого мембранный потенциал должен быть деполяризован , чтобы инициировать потенциал действия . В нейронауке пороговые потенциалы необходимы для регулирования и распространения сигналов как в центральной нервной системе (ЦНС), так и в периферической нервной системе (ПНС).
Чаще всего пороговый потенциал представляет собой значение мембранного потенциала между –50 и –55 мВ , [1] , но может меняться в зависимости от нескольких факторов. Мембранный потенциал покоя нейрона (–70 мВ) может быть изменен для увеличения или уменьшения вероятности достижения порога через ионы натрия и калия . Приток натрия в клетку через открытые потенциалзависимые натриевые каналы может деполяризовать мембрану после порога и, таким образом, возбудить ее, в то время как отток калия или приток хлорида может гиперполяризовать клетку и, таким образом, препятствовать достижению порога.
Первоначальные эксперименты вращались вокруг концепции, что любое электрическое изменение, которое вызывается в нейронах, должно происходить посредством действия ионов. Немецкий физико-химик Вальтер Нернст применил эту концепцию в экспериментах по обнаружению нервной возбудимости и пришел к выводу, что локальный возбуждающий процесс через полупроницаемую мембрану зависит от концентрации ионов. Также было показано, что концентрация ионов является ограничивающим фактором возбуждения. Если была достигнута правильная концентрация ионов, возбуждение обязательно возникло бы. [2] Это стало основой для открытия порогового значения.
Наряду с реконструкцией потенциала действия в 1950-х годах Алан Ллойд Ходжкин и Эндрю Хаксли также смогли экспериментально определить механизм, лежащий в основе порога возбуждения. Он известен как модель Ходжкина–Хаксли . Используя методы фиксации напряжения на гигантском аксоне кальмара, они обнаружили, что возбудимые ткани обычно демонстрируют явление, при котором для запуска потенциала действия должен быть достигнут определенный мембранный потенциал. Поскольку эксперимент дал результаты посредством наблюдения за изменениями ионной проводимости, Ходжкин и Хаксли использовали эти термины для обсуждения порогового потенциала. Первоначально они предположили, что должен быть разрыв в проводимости либо натрия, либо калия, но в действительности обе проводимости имели тенденцию плавно изменяться вместе с мембранным потенциалом. [3]
Вскоре они обнаружили, что при пороговом потенциале входящие и выходящие токи ионов натрия и калия соответственно были точно равны и противоположны. В отличие от покоящегося мембранного потенциала , условия порогового потенциала демонстрировали баланс токов, которые были нестабильны. Нестабильность относится к тому факту, что любая дальнейшая деполяризация активирует еще больше потенциалзависимых натриевых каналов, а входящий натриевый деполяризующий ток преодолевает задержанный выходящий ток калия. [4] С другой стороны, на уровне покоя токи калия и натрия равны и противоположны стабильным образом, где внезапный, непрерывный поток ионов не должен возникать. Основой является то, что при определенном уровне деполяризации, когда токи равны и противоположны нестабильным образом, любой дальнейший вход положительного заряда генерирует потенциал действия. Это определенное значение деполяризации (в мВ) иначе известно как пороговый потенциал.
Пороговое значение контролирует, достаточны ли входящие стимулы для генерации потенциала действия. Оно зависит от баланса входящих тормозных и возбуждающих стимулов. Потенциалы, генерируемые стимулами, являются аддитивными и могут достигать порога в зависимости от их частоты и амплитуды. Нормальное функционирование центральной нервной системы влечет за собой суммирование синаптических входов, в основном поступающих на дендритное дерево нейрона. Эти локальные градуированные потенциалы, которые в первую очередь связаны с внешними стимулами, достигают начального сегмента аксона и нарастают до тех пор, пока им не удастся достичь порогового значения. [5] Чем больше стимул, тем больше деполяризация или попытка достичь порога. Задача деполяризации требует нескольких ключевых шагов, которые зависят от анатомических факторов клетки. Вовлеченные ионные проводимости зависят от мембранного потенциала, а также от времени после изменения мембранного потенциала. [6]
Фосфолипидный бислой клеточной мембраны сам по себе является высоконепроницаемым для ионов. Полная структура клеточной мембраны включает в себя множество белков, которые встроены в липидный бислой или полностью пересекают его. Некоторые из этих белков обеспечивают высокоспецифичный проход ионов, ионные каналы . Каналы утечки калия позволяют калию проходить через мембрану в ответ на разницу в концентрациях калия внутри (высокая концентрация) и снаружи клетки (низкая). Потеря положительных (+) зарядов ионов калия (K+) изнутри клетки приводит к отрицательному потенциалу там по сравнению с внеклеточной поверхностью мембраны. [7] Гораздо меньшая «утечка» натрия (Na+) в клетку приводит к фактическому потенциалу покоя, около –70 мВ, что менее отрицательно, чем рассчитанный потенциал только для K+, равновесный потенциал, около –90 мВ. [7] Натрий -калиевая АТФаза является активным транспортером внутри мембраны, который перекачивает калий (2 иона) обратно в клетку и натрий (3 иона) из клетки, поддерживая концентрацию обоих ионов, а также сохраняя поляризацию напряжения.
Однако, как только стимул активирует потенциалзависимые натриевые каналы для открытия, положительные ионы натрия устремляются в клетку, и напряжение увеличивается. Этот процесс также может быть инициирован связыванием лиганда или нейротрансмиттера с лигандзависимым каналом . Больше натрия находится снаружи клетки по сравнению с внутренней частью, и положительный заряд внутри клетки продвигает отток ионов калия через потенциалзависимые калиевые каналы с задержкой выпрямления. Поскольку калиевые каналы внутри клеточной мембраны задерживаются, любой дальнейший вход натрия активирует все больше и больше потенциалзависимых натриевых каналов. Деполяризация выше порога приводит к увеличению проводимости Na, достаточному для того, чтобы внутреннее движение натрия немедленно подавило внешнее движение калия. [3] Если приток ионов натрия не достигает порога, то проводимость натрия не увеличивается в достаточной степени, чтобы перекрыть проводимость калия в состоянии покоя. В этом случае в некоторых типах нейронов наблюдаются подпороговые колебания мембранного потенциала . В случае успеха внезапный приток положительного заряда деполяризует мембрану, и калий задерживается в восстановлении или гиперполяризации клетки. Приток натрия деполяризует клетку в попытке установить ее собственный равновесный потенциал (около +52 мВ), чтобы сделать внутреннюю часть клетки более положительной по отношению к внешней.
Значение порога может варьироваться в зависимости от множества факторов. Изменения в ионной проводимости натрия или калия могут привести как к повышению, так и к понижению значения порога. Кроме того, диаметр аксона, плотность натриевых каналов, активируемых напряжением, и свойства натриевых каналов внутри аксона влияют на пороговое значение. [8] Обычно в аксоне или дендрите возникают небольшие деполяризующие или гиперполяризующие сигналы, возникающие в результате предшествующего стимула. Пассивное распространение этих сигналов зависит от пассивных электрических свойств клетки. Сигналы могут продолжаться вдоль нейрона, вызывая потенциал действия дальше вниз, только если они достаточно сильны, чтобы преодолеть сопротивление и емкость мембраны клетки. Например, нейрон с большим диаметром имеет больше ионных каналов в своей мембране, чем меньшая клетка, что приводит к меньшему сопротивлению потоку ионного тока. Ток распространяется быстрее в клетке с меньшим сопротивлением и с большей вероятностью достигнет порога в других частях нейрона. [3]
Пороговый потенциал также экспериментально показан для адаптации к медленным изменениям входных характеристик путем регулирования плотности натриевых каналов, а также инактивации этих натриевых каналов в целом. Гиперполяризация калиевыми каналами с задержкой выпрямления вызывает относительный рефрактерный период , который значительно затрудняет достижение порога. Калиевые каналы с задержкой выпрямления отвечают за позднюю внешнюю фазу потенциала действия, где они открываются при другом стимуле напряжения по сравнению с быстро активируемыми натриевыми каналами. Они исправляют или восстанавливают баланс ионов через мембрану, открываясь и позволяя калию течь по градиенту концентрации изнутри наружу клетки. Они также медленно закрываются, что приводит к исходящему потоку положительного заряда, который превышает необходимый баланс. Это приводит к избыточной отрицательности в клетке, требующей чрезвычайно большого стимула и, как следствие, деполяризации, чтобы вызвать ответ.
Методы отслеживания порога проверяют возбудимость нервов и зависят от свойств аксональных мембран и мест стимуляции. Они чрезвычайно чувствительны к мембранному потенциалу и изменениям этого потенциала. Эти тесты могут измерять и сравнивать контрольный порог (или порог покоя) с порогом, вызванным изменением окружающей среды, предшествующим одиночным импульсом, последовательностью импульсов или подпороговым током. [9] Измерение изменений порога может указывать на изменения мембранного потенциала, аксональных свойств и/или целостности миелиновой оболочки .
Отслеживание порога позволяет компьютеру регулировать силу тестового стимула для активации определенной доли максимального нервного или мышечного потенциала. Эксперимент по отслеживанию порога состоит из 1-мс стимула, применяемого к нерву через регулярные интервалы. [10] Потенциал действия регистрируется ниже по течению от запускающего импульса. Стимул автоматически уменьшается с шагом установленного процента до тех пор, пока реакция не опустится ниже целевого (генерация потенциала действия). После этого стимул увеличивается или уменьшается в зависимости от того, был ли предыдущий ответ меньше или больше целевого ответа, пока не будет установлен порог покоя (или контроля). Затем возбудимость нерва можно изменить, изменив нервную среду или применив дополнительные токи. Поскольку значение одного порогового тока дает мало ценной информации, поскольку оно варьируется внутри и между субъектами, пары пороговых измерений, сравнивающие контрольный порог с порогами, создаваемыми рефрактерностью, сверхнормальностью, постоянной времени силы-длительности или «пороговым электротонусом», более полезны в научных и клинических исследованиях. [11]
Отслеживание порога имеет преимущества перед другими электрофизиологическими методами, такими как метод постоянного стимула. Этот метод может отслеживать изменения порога в динамическом диапазоне 200% и в целом дает больше информации об аксональных свойствах, чем другие тесты. [12] Кроме того, этот метод позволяет придать изменениям порога количественное значение, которое при математическом преобразовании в процент может использоваться для сравнения препаратов с одним волокном и несколькими волокнами, различных нейронных участков и возбудимости нервов у разных видов. [12]
Специфической техникой порогового отслеживания является пороговый электротонус , который использует настройку порогового отслеживания для создания длительных подпороговых деполяризующих или гиперполяризующих токов внутри мембраны. Изменения возбудимости клеток можно наблюдать и регистрировать, создавая эти длительные токи. Снижение порога очевидно во время обширной деполяризации, а повышение порога очевидно при обширной гиперполяризации. При гиперполяризации происходит увеличение сопротивления междоузлийной мембраны из-за закрытия калиевых каналов, и полученный участок «разветвляется». Деполяризация производит противоположный эффект, активируя калиевые каналы, создавая участок, который «разветвляется». [13]
Самым важным фактором, определяющим пороговый электротонус, является мембранный потенциал, поэтому пороговый электротонус также может использоваться в качестве индекса мембранного потенциала. Кроме того, его можно использовать для определения характеристик значимых медицинских состояний путем сравнения эффектов этих состояний на пороговый потенциал с эффектами, наблюдаемыми экспериментально. Например, ишемия и деполяризация вызывают один и тот же эффект «раздувания» волн электротонуса. Это наблюдение приводит к выводу, что ишемия может быть результатом чрезмерной активации калиевых каналов. [14]
Роль порогового потенциала была изучена в клиническом контексте, а именно в функционировании как самой нервной системы, так и сердечно-сосудистой системы.
Фебрильные судороги , или «припадок лихорадки», — это судороги, связанные со значительным повышением температуры тела , которые чаще всего случаются в раннем детстве. Повторные эпизоды детских фебрильных судорог связаны с повышенным риском височной эпилепсии во взрослом возрасте. [15]
С помощью патч-кламп- записи аналогичное состояние было воспроизведено in vitro в нейронах коры крыс после индукции фебрильной температуры тела; наблюдалось заметное снижение порогового потенциала. Механизм этого снижения, возможно, включает подавление торможения, опосредованного рецептором ГАМК B при чрезмерном тепловом воздействии. [15]
Аномалии нейрональной возбудимости были отмечены у пациентов с боковым амиотрофическим склерозом и диабетом . Хотя механизм, в конечном счете ответственный за дисперсию, отличается между двумя состояниями, тесты через реакцию на ишемию показывают схожую устойчивость, как ни странно, к ишемии и возникающим парестезиям. Поскольку ишемия возникает через ингибирование натрий-калиевого насоса, аномалии порогового потенциала, следовательно, вовлечены. [12]
С 1940-х годов утвердилась концепция диастолической деполяризации, или «потенциала водителя ритма»; этот механизм является характерной отличительной чертой сердечной ткани. [16] Когда достигается порог и возникает результирующий потенциал действия, в результате взаимодействия возникает сердцебиение; однако, когда это сердцебиение происходит нерегулярно, может возникнуть потенциально серьезное состояние, известное как аритмия .
Различные препараты могут вызывать удлинение интервала QT в качестве побочного эффекта. Удлинение этого интервала является результатом задержки инактивации натриевых и кальциевых каналов; без надлежащей инактивации каналов пороговый потенциал достигается преждевременно, и, таким образом, возникает аритмия. [17] Эти препараты, известные как проаритмические агенты, включают противомикробные препараты, антипсихотики, метадон и, по иронии судьбы, антиаритмические агенты . [18] Использование таких агентов особенно часто встречается в отделениях интенсивной терапии, и необходимо проявлять особую осторожность, когда интервалы QT удлиняются у таких пациентов: аритмии в результате удлинения интервалов QT включают потенциально фатальную желудочковую тахикардию типа «пируэт» или TdP. [17]
Диета может быть переменной в риске аритмии. Полиненасыщенные жирные кислоты , содержащиеся в рыбьем жире и нескольких растительных маслах, [19] играют роль в профилактике аритмий. [20] Ингибируя потенциал-зависимый натриевый ток, эти масла смещают пороговый потенциал в сторону более положительного значения; следовательно, потенциал действия требует повышенной деполяризации. [20] Клиническое терапевтическое использование этих экстрактов остается предметом исследований, но установлена сильная корреляция между регулярным потреблением рыбьего жира и более низкой частотой госпитализаций по поводу фибрилляции предсердий, тяжелой и все более распространенной аритмии. [21]