В химии гипохлорит или хлороксид — это анион с химической формулой ClO− . Он соединяется с рядом катионов , образуя соли гипохлорита. Обычные примеры включают гипохлорит натрия (бытовой отбеливатель ) и гипохлорит кальция (компонент отбеливающего порошка, «хлор» для бассейнов). [1] Расстояние Cl-O в ClO− составляет 1,69 Å. [2]
Название может также относиться к эфирам хлорноватистой кислоты, а именно органическим соединениям с группой ClO–, ковалентно связанной с остальной частью молекулы. Основным примером является трет-бутилгипохлорит , который является полезным хлорирующим агентом. [3]
Большинство солей гипохлорита обрабатываются в виде водных растворов . Их основное применение — отбеливание, дезинфекция и обработка воды . Они также используются в химии для реакций хлорирования и окисления .
Подкисление гипохлоритов приводит к образованию хлорноватистой кислоты , которая находится в равновесии с хлором. Пониженный pH (т.е. в сторону кислоты) сдвигает следующую реакцию вправо, освобождая газообразный хлор, который может быть опасен:
Гипохлориты, как правило, нестабильны, и многие соединения существуют только в растворе. Гипохлорит лития LiOCl, гипохлорит кальция Ca(OCl) 2 и гипохлорит бария Ba(ClO) 2 были выделены в виде чистых безводных соединений. Все они являются твердыми веществами. Еще несколько можно получить в виде водных растворов . В целом, чем больше разбавление, тем выше их стабильность. Невозможно определить тенденции для солей щелочноземельных металлов , поскольку многие из них не могут быть образованы. Гипохлорит бериллия — неслыханное явление. Чистый гипохлорит магния приготовить невозможно; однако известен твердый Mg(OH)OCl. [4] Гипохлорит кальция производится в промышленных масштабах и обладает хорошей стабильностью. Гипохлорит стронция, Sr(OCl) 2 , недостаточно хорошо охарактеризован, и его стабильность еще не определена. [ необходима цитата ]
При нагревании гипохлорит разлагается на смесь хлорида , кислорода и хлоратов :
Эта реакция является экзотермической и в случае концентрированных гипохлоритов, таких как LiOCl и Ca(OCl) 2 , может привести к опасному тепловому выходу из строя и является потенциально взрывоопасной. [5]
Устойчивость гипохлоритов щелочных металлов снижается вниз по группе . Безводный гипохлорит лития устойчив при комнатной температуре; однако гипохлорит натрия взрывоопасен как безводное твердое вещество. [6] Пентагидрат (NaOCl·(H 2 O) 5 ) неустойчив при температуре выше 0 °C; [7] хотя более разбавленные растворы, встречающиеся в качестве бытового отбеливателя, более устойчивы. Гипохлорит калия (KOCl) известен только в растворе. [4]
Гипохлориты лантаноидов также нестабильны; однако, как сообщается, они более стабильны в своих безводных формах, чем в присутствии воды. [8] Гипохлорит использовался для окисления церия из его степени окисления +3 в +4 . [9]
Хлорноватистая кислота сама по себе нестабильна, поскольку она разлагается с образованием хлора . Ее разложение также приводит к образованию некоторой формы кислорода.
Гипохлориты реагируют с аммиаком, образуя сначала монохлорамин ( NH
2Cl ), затем дихлорамин ( NHCl
2), и, наконец, трихлорид азота ( NCl
3). [1]
Гипохлоритные соли, образующиеся в результате реакции между хлором и гидроксидами щелочных и щелочноземельных металлов . Реакция проводится при температуре, близкой к комнатной, для подавления образования хлоратов . Этот процесс широко используется для промышленного производства гипохлорита натрия (NaClO) и гипохлорита кальция (Ca(ClO) 2 ).
Большие количества гипохлорита натрия также производятся электрохимическим путем с помощью неразделенного хлорщелочного процесса . В этом процессе рассол электролизуется с образованием Cl
2который диссоциирует в воде с образованием гипохлорита. Эту реакцию необходимо проводить в некислотных условиях, чтобы предотвратить выделение хлора:
Некоторые гипохлориты могут быть также получены с помощью реакции солевого обмена между гипохлоритом кальция и различными сульфатами металлов . Эта реакция осуществляется в воде и основана на образовании нерастворимого сульфата кальция , который выпадает в осадок из раствора, доводя реакцию до завершения.
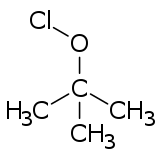
Эфиры гипохлорита обычно образуются из соответствующих спиртов путем обработки любым из ряда реагентов (например , хлором , хлорноватистой кислотой , оксидом дихлора и различными подкисленными солями гипохлорита). [3]
Хлоропероксидазы — это ферменты , катализирующие хлорирование органических соединений. Этот фермент объединяет неорганические субстраты хлорид и перекись водорода , чтобы получить эквивалент Cl + , который заменяет протон в углеводородном субстрате:
Источником «Cl + » является хлорноватистая кислота (HOCl). [11] Многие хлорорганические соединения биосинтезируются таким образом.
В ответ на инфекцию иммунная система человека вырабатывает мельчайшие количества гипохлорита в особых белых кровяных клетках , называемых нейтрофильными гранулоцитами . [12] Эти гранулоциты поглощают вирусы и бактерии во внутриклеточной вакуоли, называемой фагосомой , где они перевариваются.
Часть механизма пищеварения включает в себя ферментативно-опосредованный респираторный взрыв , который производит реактивные соединения, полученные из кислорода, включая супероксид (который производится НАДФН-оксидазой ). Супероксид распадается на кислород и перекись водорода , которая используется в катализируемой миелопероксидазой реакции для преобразования хлорида в гипохлорит. [13] [14] [15]
Было также обнаружено, что низкие концентрации гипохлорита взаимодействуют с белками теплового шока микробов , стимулируя их роль внутриклеточного шаперона и заставляя бактерии образовывать комки (подобно сваренному яйцу), которые в конечном итоге погибают. [16] В том же исследовании было обнаружено, что низкие (микромолярные) уровни гипохлорита побуждают E. coli и Vibrio cholerae активировать защитный механизм, хотя его последствия не были ясны. [16]
В некоторых случаях щелочная кислотность гипохлорита нарушает липидную мембрану бактерий , реакция похожа на лопание воздушного шарика. [ необходима цитата ]
Гипохлориты, особенно натрия («жидкий отбеливатель», «жавелевая вода») и кальция («отбеливающий порошок») широко используются в промышленности и в быту для отбеливания одежды, осветления волос и удаления пятен . Они были первыми коммерческими отбеливающими продуктами, разработанными вскоре после того, как это свойство было открыто в 1785 году французским химиком Клодом Бертолле .
Гипохлориты также широко используются в качестве дезинфицирующих средств и дезодорантов широкого спектра действия . Это применение началось вскоре после того, как французский химик Лабаррак открыл эти свойства, около 1820 года (еще до того, как Пастер сформулировал свою микробную теорию болезней).
Гипохлорит является самым сильным окислителем оксианионов хлора. Это можно увидеть, сравнив стандартные потенциалы полуэлементов в серии; данные также показывают, что оксианионы хлора являются более сильными окислителями в кислых условиях. [17]
Гипохлорит является достаточно сильным окислителем для преобразования Mn(III) в Mn(V) в ходе реакции эпоксидирования Якобсена и для преобразования Ce3+
в Се4+
[9] Именно
эта окислительная способность делает их эффективными отбеливателями и дезинфицирующими средствами.
В органической химии гипохлориты могут использоваться для окисления первичных спиртов в карбоновые кислоты . [18]
Соли гипохлорита также могут служить хлорирующими агентами . Например, они преобразуют фенолы в хлорфенолы. Гипохлорит кальция преобразует пиперидин в N -хлорпиперидин .
Хлор может быть ядром оксианионов со степенями окисления −1, +1, +3, +5 или +7. (Элемент также может иметь степень окисления +4, что наблюдается в нейтральном соединении диоксиде хлора ClO 2 ).
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )