Водородный газ производится несколькими промышленными методами. [1] Почти весь текущий мировой запас водорода создается из ископаемого топлива. [2] [3] : 1 Большая часть водорода — это серый водород, полученный путем парового риформинга метана . В этом процессе водород производится в результате химической реакции между паром и метаном , основным компонентом природного газа. Производство одной тонны водорода с помощью этого процесса приводит к выбросам 6,6–9,3 тонн углекислого газа. [4] Когда улавливание и хранение углерода используются для удаления большой доли этих выбросов, продукт известен как синий водород . [5]
Обычно считается, что зеленый водород производится из возобновляемой электроэнергии путем электролиза воды. [6] [7] Реже определения зеленого водорода включают водород, полученный из других источников с низким уровнем выбросов, таких как биомасса . [8] Производство зеленого водорода в настоящее время обходится дороже, чем производство серого водорода, а эффективность преобразования энергии изначально низкая. [9] Другие методы производства водорода включают газификацию биомассы , пиролиз метана и извлечение подземного водорода . [10] [11]
По состоянию на 2023 год менее 1% выделенного производства водорода будет низкоуглеродным, т.е. голубой водород, зеленый водород и водород, произведенный из биомассы. [12]
В 2020 году во всем мире было произведено около 87 миллионов тонн водорода [13] для различных целей, таких как переработка нефти , производство аммиака по методу Хабера и производство метанола путем восстановления оксида углерода . Глобальный рынок производства водорода был справедливо оценен в 155 миллиардов долларов США в 2022 году и, как ожидается, будет расти с годовым темпом прироста в 9,3% с 2023 по 2030 год. [14]
Молекулярный водород был обнаружен в Кольской сверхглубокой скважине . Неясно, сколько молекулярного водорода доступно в природных резервуарах, но по крайней мере одна компания [15] специализируется на бурении скважин для извлечения водорода. Большая часть водорода в литосфере связана с кислородом в воде. Производство элементарного водорода требует потребления носителя водорода, такого как ископаемое топливо или вода. Первый носитель потребляет ископаемый ресурс, а в процессе паровой конверсии метана (SMR) производится парниковый газ диоксид углерода. Однако в более новом процессе пиролиза метана парниковый газ диоксид углерода не производится. Эти процессы обычно не требуют дополнительных затрат энергии помимо ископаемого топлива.
Разлагающаяся вода, последний носитель, требует электрического или теплового ввода, вырабатываемого из некоторого первичного источника энергии (ископаемое топливо, ядерная энергия или возобновляемая энергия ). Водород, полученный электролизом воды с использованием возобновляемых источников энергии, таких как энергия ветра и солнца , называется зеленым водородом . [16] При получении из природного газа путем нулевого парникового выброса метана пиролизом, его называют бирюзовым водородом. [17]
Когда ископаемое топливо получено с выбросами парниковых газов , его обычно называют серым водородом . Если большая часть выбросов углекислого газа улавливается, его называют синим водородом. [18] Водород, полученный из угля, может называться коричневым или черным водородом. [19]
Водород часто обозначают разными цветами, чтобы указать его происхождение (возможно, потому, что серый цвет символизирует «грязный водород» [20] ). [21] [22] [11]
Водород производится промышленным способом с помощью паровой конверсии (SMR), которая использует природный газ. [32] Содержание энергии в полученном водороде составляет около 74% от содержания энергии в исходном топливе, [33] поскольку часть энергии теряется в виде избыточного тепла во время производства. В целом, паровая конверсия выделяет углекислый газ, парниковый газ, известный как серый водород. Если углекислый газ улавливается и хранится, полученный водород известен как голубой водород.
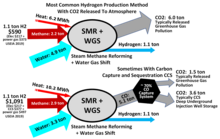
Паровой риформинг метана (SMR) производит водород из природного газа, в основном метана (CH 4 ), и воды. Это самый дешевый источник промышленного водорода, являющийся источником почти 50% мирового водорода. [34] Процесс состоит из нагревания газа до 700–1100 °C (1300–2000 °F) в присутствии пара над никелевым катализатором . В результате эндотермической реакции образуются оксид углерода и молекулярный водород (H 2 ). [35]
В реакции сдвига вода-газ оксид углерода реагирует с паром, чтобы получить дополнительные количества H 2 . WGSR также требует катализатора, как правило, над оксидом железа или другими оксидами . Побочным продуктом является CO 2 . [35] В зависимости от качества исходного сырья ( природный газ, нафта и т. д.), одна тонна произведенного водорода также произведет от 9 до 12 тонн CO 2 , парникового газа, который может быть улавлен . [36]
В этом процессе высокотемпературный пар (H 2 O) реагирует с метаном (CH 4 ) в эндотермической реакции с образованием синтез-газа . [37]
На втором этапе дополнительный водород образуется в результате низкотемпературной экзотермической реакции конверсии водяного газа, которая осуществляется при температуре около 360 °C (680 °F):
По сути, атом кислорода (O) отделяется от дополнительной воды (пара) для окисления CO до CO 2 . Это окисление также обеспечивает энергию для поддержания реакции. Дополнительное тепло, необходимое для осуществления процесса, обычно поступает за счет сжигания некоторой части метана.
Методы получения водорода без использования ископаемого топлива включают процесс расщепления воды или расщепления молекулы воды (H 2 O) на ее компоненты кислород и водород. Когда источник энергии для расщепления воды является возобновляемым или низкоуглеродным, полученный водород иногда называют зеленым водородом . Преобразование может быть выполнено несколькими способами, но все методы в настоящее время считаются более дорогими, чем методы производства на основе ископаемого топлива.
Водород можно получить с помощью электролиза под высоким давлением , электролиза воды под низким давлением или ряда других новых электрохимических процессов, таких как электролиз при высокой температуре или электролиз с использованием углерода. [38] Однако лучшие в настоящее время процессы электролиза воды имеют эффективную электрическую эффективность 70-80%, [39] [40] [41], так что для производства 1 кг водорода ( удельная энергия которого составляет 143 МДж/кг или около 40 кВт·ч/кг) требуется 50–55 кВт·ч электроэнергии.
В некоторых частях мира паровой риформинг метана составляет в среднем от 1 до 3 долл. США/кг, не считая стоимости сжатия газообразного водорода. Это делает производство водорода с помощью электролиза конкурентоспособным по стоимости во многих регионах, как указано в Nel Hydrogen [42] и других, включая статью МЭА [43] , в которой рассматриваются условия, которые могут привести к конкурентному преимуществу для электролиза.
Небольшая часть (2% в 2019 году [44] ) производится электролизом с использованием электричества и воды, потребляя приблизительно 50–55 киловатт-часов электроэнергии на килограмм произведенного водорода. [45]

Электролиз воды использует электричество для расщепления воды на водород и кислород. По состоянию на 2020 год менее 0,1% водорода производится путем электролиза воды. [46] Электролиз воды эффективен на 70–80% (потери преобразования 20–30%) [47] [48] , в то время как паровой риформинг природного газа имеет тепловой КПД от 70 до 85%. [49] Ожидается, что электрический КПД электролиза достигнет 82–86% [50] до 2030 года, при этом сохраняя долговечность, поскольку прогресс в этой области продолжается быстрыми темпами. [51]
Электролиз воды может работать при температуре 50–80 °C (120–180 °F), в то время как паровой риформинг метана требует температур 700–1100 °C (1300–2000 °F). [52] Разница между двумя методами заключается в первичной используемой энергии: либо электричество (для электролиза), либо природный газ (для парового риформинга метана). Из-за использования воды, легкодоступного ресурса, электролиз и аналогичные методы расщепления воды привлекли внимание научного сообщества. С целью снижения стоимости производства водорода возобновляемые источники энергии были нацелены на электролиз. [53]
Существует три основных типа электролитических ячеек : твердооксидные электролизеры (SOEC), полимерные электролитические мембранные ячейки (PEM) и щелочные электролизеры (AEC). [54] Традиционно щелочные электролизеры дешевле с точки зрения инвестиций (они обычно используют никелевые катализаторы), но менее эффективны; электролизеры PEM, наоборот, дороже (они обычно используют дорогие катализаторы из металлов платиновой группы ), но более эффективны и могут работать при более высоких плотностях тока , и поэтому могут быть, возможно, дешевле, если производство водорода достаточно велико. [55]
SOEC работают при высоких температурах, обычно около 800 °C (1500 °F). При этих высоких температурах значительное количество требуемой энергии может быть предоставлено в виде тепловой энергии (тепла), и как таковой называется высокотемпературным электролизом . Тепловая энергия может быть предоставлена из ряда различных источников, включая отработанное промышленное тепло, атомные электростанции или концентрированные солнечные тепловые станции . Это имеет потенциал для снижения общей стоимости производимого водорода за счет снижения количества электрической энергии, необходимой для электролиза. [56] [57] [58] [59]
Электролитические ячейки PEM обычно работают при температуре ниже 100 °C (212 °F). [56] Преимущество этих ячеек в том, что они сравнительно просты и могут быть спроектированы для работы с широко варьирующимися входными напряжениями , что делает их идеальными для использования с возобновляемыми источниками энергии, такими как фотоэлектрические солнечные панели . [60] AEC оптимально работают при высоких концентрациях электролита (KOH или карбонат калия ) и при высоких температурах, часто около 200 °C (392 °F).
Эффективность современных водородных генераторов измеряется энергией, потребляемой на стандартный объем водорода (МДж/м 3 ), предполагая стандартную температуру и давление H 2 . Чем ниже энергия, используемая генератором, тем выше будет его эффективность; электролизер с эффективностью 100% будет потреблять 39,4 киловатт-часов на килограмм (142 МДж/кг) водорода, [61] 12 749 джоулей на литр (12,75 МДж/м 3 ). На практике электролиз обычно использует вращающийся электролизер, в котором центробежная сила помогает отделить пузырьки газа от воды. [62] Такой электролизер при давлении 15 бар может потреблять 50 киловатт-часов на килограмм (180 МДж/кг) и еще 15 киловатт-часов (54 МДж), если водород сжимается для использования в водородных автомобилях. [63]
Обычный щелочной электролиз имеет эффективность около 70% [64] , однако доступны усовершенствованные щелочные электролизеры с эффективностью до 82%. [65] Принимая во внимание использование более высокой теплоты сгорания (поскольку неэффективность через тепло может быть перенаправлена обратно в систему для создания пара, необходимого для катализатора), средняя рабочая эффективность электролиза PEM составляет около 80% или 82% при использовании самых современных щелочных электролизеров. [66]
Ожидается, что эффективность PEM увеличится примерно до 86% [67] до 2030 года. Теоретическая эффективность электролизеров PEM прогнозируется на уровне 94%. [68]
_at_varying_natural_gas_prices.jpg/440px-H2_production_cost_($-gge_untaxed)_at_varying_natural_gas_prices.jpg)
По состоянию на 2020 год стоимость водорода, получаемого электролизом, составляет около 3–8 долл. США/кг. [69] Учитывая промышленное производство водорода и используя лучшие современные процессы электролиза воды (PEM или щелочной электролиз), которые имеют эффективную электрическую эффективность 70–82%, [70] [71] [72] производство 1 кг водорода ( удельная энергия которого составляет 143 МДж/кг или около 40 кВт·ч/кг) требует 50–55 кВт·ч электроэнергии. При стоимости электроэнергии 0,06 долл. США/кВт·ч, как указано в целевых показателях производства водорода Министерства энергетики на 2015 год, [73] стоимость водорода составляет 3 долл. США/кг.
Целевая цена Министерства энергетики США на водород в 2020 году составляет 2,30 долл. США/кг, что требует затрат на электроэнергию в размере 0,037 долл. США/кВт·ч, что достижимо, учитывая недавние тендеры PPA на ветровую и солнечную энергию во многих регионах. [74] Отчет IRENA.ORG представляет собой обширный фактический отчет о современном промышленном производстве водорода, потребляющем около 53–70 кВт·ч на кг, и может быть снижено примерно до 45 кВт·ч/кг H
2. [75] Термодинамическая энергия, необходимая для водорода путем электролиза, составляет 33 кВт·ч/кг, что выше, чем при паровом риформинге с улавливанием углерода и выше, чем при пиролизе метана. Одним из преимуществ электролиза перед водородом, полученным путем парового риформинга метана (SMR), является то, что водород можно производить на месте, что означает, что дорогостоящий процесс доставки на грузовике или по трубопроводу исключается.
В дополнение к снижению напряжения, необходимого для электролиза, посредством повышения температуры электролизной ячейки, также возможно электрохимическое потребление кислорода, произведенного в электролизере, путем введения топлива (такого как углерод/уголь, [76] метанол , [77] [78] этанол , [79] муравьиная кислота , [80] глицерин, [80] и т. д.) в кислородную сторону реактора. Это снижает требуемую электрическую энергию и имеет потенциал для снижения стоимости водорода до менее чем 40~60% с оставшейся энергией, предоставляемой таким образом. [81]
Электролиз воды с использованием углерода/углеводорода (CAWE) может предложить менее энергоемкий и более чистый метод использования химической энергии из различных источников углерода, таких как низкосортный и высокосернистый уголь, биомасса, спирты и метан (природный газ), где полученный чистый CO2 может быть легко изолирован без необходимости разделения. [82] [83]
Биомасса преобразуется в синтез-газ путем газификации, а синтез-газ далее преобразуется в водород путем реакции конверсии водяного газа (WGSR). [84]
Промышленное производство хлора и каустической соды методом электролиза генерирует значительное количество водорода в качестве побочного продукта. В порту Антверпена демонстрационная электростанция на топливных элементах мощностью 1 МВт работает на таком побочном продукте. Этот блок работает с конца 2011 года. [85] Избыточный водород часто контролируется с помощью анализа водородного пинча .
Газ, вырабатываемый в коксовых печах при производстве стали, аналогичен синтез-газу с 60% водорода по объему. [86] Водород можно извлекать из коксового газа экономично. [87]
Получение водорода из природного газа и более тяжелых углеводородов достигается путем частичного окисления. Смесь топлива с воздухом или топлива с кислородом частично сжигается , в результате чего получается синтез-газ, богатый водородом и оксидом углерода. Затем из оксида углерода (и воды) с помощью реакции сдвига вода-газ получается больше водорода и диоксида углерода. [35] Диоксид углерода может подаваться совместно, чтобы снизить соотношение водорода и оксида углерода.
Реакция частичного окисления происходит, когда субстехиометрическая смесь топлива и воздуха или топлива и кислорода частично сжигается в риформере или реакторе частичного окисления. Различают термическое частичное окисление (TPOX) и каталитическое частичное окисление (CPOX). Химическая реакция имеет общую форму:
Идеализированные примеры для топочного мазута и угля, предполагающие составы C 12 H 24 и C 24 H 12 соответственно, следующие:
Процесс Квэрнера или процесс получения сажи и водорода Квэрнера ( CB&H) [88] — это метод плазменного пиролиза , разработанный в 1980-х годах одноименной норвежской компанией для производства водорода и сажи из жидких углеводородов (C n H m ). Из доступной энергии сырья примерно 48% содержится в водороде, 40% — в активированном угле и 10% — в перегретом паре . [89] CO 2 в этом процессе не образуется.
В 2009 году была представлена вариация этого процесса с использованием технологии утилизации отходов плазменной дуги для производства водорода, тепла и углерода из метана и природного газа в плазменном конвертере . [90]
Для производства водорода из угля используется газификация угля . Процесс газификации угля использует пар и кислород для разрыва молекулярных связей в угле и образования газообразной смеси водорода и оксида углерода. [53] Диоксид углерода и загрязняющие вещества могут быть легче удалены из газа, полученного при газификации угля, чем при сжигании угля. [91] [92] Другим методом преобразования является низкотемпературная и высокотемпературная карбонизация угля . [93]
Коксовый газ, полученный путем пиролиза (бескислородного нагрева) угля, содержит около 60% водорода, остальное — метан, оксид углерода, диоксид углерода, аммиак, молекулярный азот и сероводород (H 2 S). Водород можно отделить от других примесей с помощью процесса адсорбции при переменном давлении . Японские сталелитейные компании осуществили производство водорода этим методом.
Нефтяной кокс также может быть преобразован в богатый водородом синтез-газ посредством газификации угля. Полученный синтез-газ состоит в основном из водорода, оксида углерода и H 2 S из серы в исходном коксе. Газификация является вариантом для получения водорода практически из любого источника углерода. [94]
Впрыскивание соответствующих микробов в истощенные нефтяные скважины позволяет им извлекать водород из оставшейся, неизвлекаемой нефти. Поскольку единственными входными данными являются микробы, себестоимость производства низкая. Этот метод также производит концентрированный CO
2что в принципе можно было бы захватить. [95]
Ядерное излучение может разрушать водные связи посредством радиолиза . [96] [97] В золотом руднике Мпоненг , Южная Африка , исследователи обнаружили бактерии в естественной зоне высокой радиации. Бактериальное сообщество, в котором доминировал новый филотип Desulfotomaculum , питалось в основном радиолитически произведенным водородом. [98]
Вода спонтанно диссоциирует при температуре около 2500 °C, но этот термолиз происходит при температурах, слишком высоких для обычных технологических трубопроводов и оборудования, что приводит к довольно низкому потенциалу коммерциализации. [99]
Пиролиз можно разделить на различные типы в зависимости от температуры пиролиза, а именно: низкотемпературный медленный пиролиз, среднетемпературный быстрый пиролиз и высокотемпературный флэш-пиролиз. [100] Источником энергии в основном является солнечная энергия, с помощью фотосинтетических микроорганизмов для разложения воды или биомассы для получения водорода. Однако этот процесс имеет относительно низкий выход водорода и высокие эксплуатационные расходы. Это невыполнимый метод для промышленности.
Высокотемпературный газоохлаждаемый реактор (HTGR) является одним из наиболее перспективных ядерных методов без CO 2 для производства водорода путем расщепления воды в больших масштабах. В этом методе термохимический цикл йода и серы (IS) для расщепления воды и высокотемпературный электролиз пара (HTSE) были выбраны в качестве основных процессов для ядерного производства водорода. Цикл SI следует трем химическим реакциям: [101]
Реакция Бунзена : I2 + SO2 + 2H2O → H2SO4 + 2HI
Разложение HI: 2HI→H 2 +I 2
Разложение серной кислоты : H2SO4 →SO2 + 1 / 2O2 + H2O
Производительность ВТГР с циклом IS составляет около 0,68 кг/с, а капитальные затраты на строительство единицы электростанции составляют 100 млн долларов США.
Термохимические циклы объединяют исключительно источники тепла ( термо ) с химическими реакциями для расщепления воды на ее водородные и кислородные компоненты. [102] Термин цикл используется потому, что помимо воды, водорода и кислорода, химические соединения, используемые в этих процессах, непрерывно перерабатываются. Если электричество частично используется в качестве входного сигнала, результирующий термохимический цикл определяется как гибридный.
Цикл серы-йода (цикл SI) представляет собой термохимический цикл процессов, который генерирует водород из воды с эффективностью приблизительно 50%. Сера и йод, используемые в процессе, восстанавливаются и повторно используются, а не потребляются процессом. Цикл может быть выполнен с любым источником очень высоких температур, приблизительно 950 °C, например, с помощью концентрирующих солнечных энергетических систем (CSP), и считается хорошо подходящим для производства водорода высокотемпературными ядерными реакторами , [103] и как таковой, изучается в высокотемпературном инженерном испытательном реакторе в Японии. [104] [105] [106] [107] Существуют и другие гибридные циклы, которые используют как высокие температуры, так и некоторое количество электричества, например, цикл меди-хлора , он классифицируется как гибридный термохимический цикл , потому что он использует электрохимическую реакцию на одном из этапов реакции, он работает при 530 °C и имеет эффективность 43 процента. [108]
Ферросилиций используется военными для быстрого получения водорода для воздушных шаров . В химической реакции используются гидроксид натрия , ферросилиций и вода. Генератор достаточно мал, чтобы поместиться в грузовике, и требует лишь небольшого количества электроэнергии, материалы стабильны и не горючи, и они не генерируют водород, пока не смешаны. [109] Метод используется со времен Первой мировой войны . Тяжелый стальной сосуд под давлением заполняется гидроксидом натрия и ферросилицием, закрывается, и добавляется контролируемое количество воды; растворение гидроксида нагревает смесь примерно до 93 °C и запускает реакцию; производятся силикат натрия , водород и пар. [110]
Биологический водород может быть получен в биореакторе водорослей . [111] В конце 1990-х годов было обнаружено, что если водоросли лишены серы, они переключатся с производства кислорода , т.е. обычного фотосинтеза , на производство водорода. Кажется, что производство теперь экономически целесообразно, превзойдя барьер энергоэффективности в 7–10 процентов (преобразование солнечного света в водород). [112] со скоростью производства водорода 10–12 мл на литр культуры в час. [113]
Преобразование солнечной энергии в водород посредством процесса расщепления воды является одним из самых интересных способов достижения чистых и возобновляемых энергетических систем. Однако, если этот процесс сопровождается фотокатализаторами, взвешенными непосредственно в воде, вместо использования фотоэлектрической и электролитической системы, реакция происходит всего за один шаг, ее можно сделать более эффективной. [114] [115] [116] Однако текущие системы имеют низкую производительность для коммерческой реализации. [117] [118]
Биомассу и потоки отходов в принципе можно преобразовать в биоводород с помощью газификации биомассы , парового риформинга или биологической конверсии, такой как биокаталитический электролиз [81] или ферментативное производство водорода. [119]
Среди методов производства водорода биологические пути потенциально менее энергоемки. Кроме того, широкий спектр отходов и малоценных материалов, таких как сельскохозяйственная биомасса, в качестве возобновляемых источников может быть использован для производства водорода через биохимические или термохимические пути. [84] Тем не менее, в настоящее время водород производится в основном из ископаемого топлива, в частности, природного газа, которые являются невозобновляемыми источниками. Водород не только является самым чистым топливом, но и широко используется в ряде отраслей промышленности, особенно в производстве удобрений, нефтехимической и пищевой. [120]
Биохимические пути получения водорода классифицируются как процессы темной и фотоферментации. При темной ферментации углеводы преобразуются в водород ферментативными микроорганизмами, включая строгие анаэробные и факультативные анаэробные бактерии. Теоретически может быть получено максимум 4 моль H2/моль глюкозы. [ необходима цитата ] Сахара преобразуются в летучие жирные кислоты (ЛЖК) и спирты в качестве побочных продуктов в ходе этого процесса. Фотоферментативные бактерии способны генерировать водород из ЛЖК. Следовательно, метаболиты, образующиеся при темной ферментации, могут использоваться в качестве сырья при фотоферментации для повышения общего выхода водорода. [120]
Ферментативное производство водорода преобразует органические субстраты в водород. Разнообразная группа бактерий способствует этому преобразованию. Фотоферментация отличается от темной ферментации, поскольку она происходит только в присутствии света . Например, фотоферментация с Rhodobacter sphaeroides SH2C может быть использована для преобразования некоторых жирных кислот в водород. [121]
Ферментативное производство водорода может быть осуществлено с использованием прямого биофотолиза зелеными водорослями, непрямого биофотолиза цианобактериями, фотоферментации анаэробными фотосинтетическими бактериями и темной ферментации анаэробными ферментативными бактериями. Например, в литературе сообщалось об исследованиях по производству водорода с использованием H. salinarium , анаэробной фотосинтетической бактерии, связанной с донором гидрогеназы, таким как E. coli . [122] Enterobacter aerogenes является еще одним производителем водорода. [123]
Для получения водорода из сахаров были разработаны различные ферментативные пути. [124]

Помимо темной ферментации, электрогидрогенез (электролиз с использованием микробов) является еще одной возможностью. Используя микробные топливные элементы , сточные воды или растения могут быть использованы для выработки энергии. Биокаталитический электролиз не следует путать с биологическим производством водорода , так как последнее использует только водоросли, и в последнем случае водоросли сами генерируют водород мгновенно, тогда как при биокаталитическом электролизе это происходит после прохождения через микробный топливный элемент, и могут быть использованы различные водные растения [125] . К ним относятся тростник душистый , кордграсс, рис, томаты, люпин и водоросли. [126]

Порошок алюминиевого сплава реагирует с водой, выделяя водород при контакте с водой. Сообщается, что он генерирует водород в количестве 100 процентов от теоретического выхода. [127] [128] Процесс неэкономичен.
CC-HOD (каталитический углерод – водород по требованию) – это низкотемпературный процесс, в котором углерод и алюминий погружаются и нагреваются примерно до 80 °C (176 °F), вызывая химическую реакцию, в результате которой образуется водород.

Водород также присутствует под землей. Этот природный водород , также называемый белым водородом или золотым водородом, может быть извлечен из скважин таким же образом, как ископаемое топливо, такое как нефть и природный газ. [129] [130] [11]
Белый водород может быть найден или произведен в Среднеконтинентальной рифтовой системе в масштабах, необходимых для возобновляемой водородной экономики . Воду можно закачивать в горячую богатую железом породу для извлечения водорода. [131]

Пиролиз метана (природного газа) с одностадийным процессом [132] барботирование метана через расплавленный металлический катализатор является «безпарниковым» подходом к производству водорода, который был продемонстрирован в лабораторных условиях в 2017 году и теперь тестируется в более крупных масштабах. [133] [134] Процесс проводится при высоких температурах (1065 °C). [135] [136] [137] [138] Производство 1 кг водорода требует около 18 кВт·ч электроэнергии для технологического тепла. [139] Пиролиз метана можно выразить следующим уравнением реакции. [140]
Твердый углерод промышленного качества может быть продан в качестве сырья для производства или захоронен.
По состоянию на 2023 год технологии пиролиза метана находятся на ранних стадиях разработки. Им предстоит преодолеть множество препятствий перед коммерциализацией. [141]
Ферментативное производство водорода — это ферментативное преобразование органического субстрата в биоводород, проявляющееся в виде разнообразной группы бактерий с использованием многоферментных систем , включающих три этапа, аналогичные анаэробному преобразованию . Реакции темной ферментации не требуют световой энергии, поэтому они способны постоянно производить водород из органических соединений в течение дня и ночи. Фотоферментация отличается от темной ферментации , поскольку она происходит только при наличии света . Электрогидрогенез используется в микробных топливных элементах для производства водорода из органического вещества. [142]
Биологический водород может быть получен в биореакторе из водорослей . В конце 1990-х годов было обнаружено, что если водоросли лишаются серы, они переключаются с производства кислорода , т. е. обычного фотосинтеза , на производство водорода. [143] Биологический водород также может быть получен с использованием сырья, отличного от водорослей, наиболее распространенным сырьем являются потоки отходов. Процесс включает в себя бактерии, питающиеся углеводородами и выделяющие водород и CO2 . [ 144]
Помимо обычного электролиза, электролиз с использованием микробов является еще одной возможностью. При биокаталитическом электролизе водород генерируется после прохождения через микробный топливный элемент, и можно использовать различные водные растения Архивировано 2010-05-17 в Wayback Machine . К ним относятся тростниковая душистая трава , кордграсс, рис, томаты, люпины и водоросли [145]
Электролиз под высоким давлением — это электролиз воды путем разложения воды (H 2 O) на кислород (O 2 ) и водород (H 2 ) с помощью электрического тока, проходящего через воду. Разница со стандартным электролизером заключается в сжатом водороде на выходе около 120–200 бар (1740–2900 фунтов на кв. дюйм , 12–20 МПа ). [146] Благодаря сжатию водорода в электролизере с помощью процесса, известного как химическое сжатие, устраняется необходимость во внешнем водородном компрессоре , [147] среднее потребление энергии для внутреннего сжатия составляет около 3%. [148] Крупнейший в Европе (1 400 000 кг/год, электролиз воды под высоким давлением, щелочная технология) завод по производству водорода работает в Кокколе, Финляндия. [149]
Водород может быть получен из энергии, поставляемой в виде тепла и электричества посредством высокотемпературного электролиза (ВТЭ). Поскольку часть энергии в ВТЭ подается в виде тепла, меньше энергии должно быть преобразовано дважды из тепла в электричество, а затем в водород. Следовательно, для производства водорода потенциально требуется меньше энергии. Ядерное тепло может быть использовано для расщепления водорода из воды. Высокотемпературные (950–1000 °C) газоохлаждаемые ядерные реакторы имеют потенциал для расщепления водорода из воды термохимическим способом с использованием ядерного тепла. Высокотемпературный электролиз был продемонстрирован в лаборатории при 108 МДж (тепловых) на килограмм произведенного водорода [150] , но не в коммерческих масштабах. Кроме того, это низкокачественный «коммерческий» водород, непригодный для использования в топливных элементах. [151]
Использование электроэнергии, вырабатываемой фотоэлектрическими системами, предлагает самый чистый способ получения водорода. Вода расщепляется на водород и кислород с помощью электролиза — процесса фотоэлектрохимической ячейки (PEC), который также называется искусственным фотосинтезом . [152] Уильям Айерс из Energy Conversion Devices продемонстрировал и запатентовал первую многопереходную высокоэффективную фотоэлектрохимическую систему для прямого расщепления воды в 1983 году. [153] Эта группа продемонстрировала прямое расщепление воды, которое теперь называют «искусственным листом» или «беспроводным солнечным расщеплением воды» с помощью недорогого тонкопленочного аморфного кремниевого многопереходного листа, погруженного непосредственно в воду. [154] [155]
Водород выделялся на передней аморфной кремниевой поверхности, украшенной различными катализаторами, в то время как кислород выделялся из задней металлической подложки. Мембрана Nafion над многопереходной ячейкой обеспечивала путь для ионного транспорта. В их патенте также перечислены различные другие полупроводниковые многопереходные материалы для прямого расщепления воды в дополнение к аморфному кремнию и кремниево-германиевым сплавам. Исследования продолжаются в направлении разработки высокоэффективной технологии многопереходных ячеек в университетах и фотоэлектрической промышленности. Если этому процессу способствуют фотокатализаторы, взвешенные непосредственно в воде, вместо использования фотоэлектрической и электролитической системы, реакция происходит всего за один шаг, что может повысить эффективность. [154] [155]
Метод, изученный Томасом Нанном и его командой в Университете Восточной Англии, состоит из золотого электрода, покрытого слоями наночастиц фосфида индия (InP). Они ввели комплекс железа и серы в слоистую структуру, которая при погружении в воду и облучении светом под небольшим электрическим током производила водород с эффективностью 60%. [156]
В 2015 году сообщалось, что Panasonic Corp. разработала фотокатализатор на основе нитрида ниобия , который может поглощать 57% солнечного света для поддержки разложения воды с получением газообразного водорода. [157] Компания планирует достичь коммерческого применения «как можно раньше», не ранее 2020 года.
Для разложения воды на водород и кислород требуются очень высокие температуры. Для того чтобы процесс работал при приемлемых температурах, необходим катализатор. Нагревание воды может быть достигнуто за счет использования воды, концентрирующей солнечную энергию . Hydrosol-2 — это 100-киловаттная пилотная установка на Plataforma Solar de Almería в Испании , которая использует солнечный свет для получения требуемых 800–1200 °C для нагрева воды. Hydrosol II работает с 2008 года. Конструкция этой 100-киловаттной пилотной установки основана на модульной концепции. В результате, возможно, что эта технология может быть легко масштабирована до мегаваттного диапазона путем умножения имеющихся реакторных установок и подключения установки к гелиостатным полям (полям зеркал, отслеживающих солнце) подходящего размера. [158]
Существует более 352 [159] термохимических циклов, которые можно использовать для расщепления воды , [160] около дюжины таких циклов, таких как цикл оксида железа , цикл оксида церия (IV)-оксида церия (III), цикл цинка - оксида цинка , цикл серы-йода , цикл меди-хлора и гибридный цикл серы , цикл алюминия-оксида алюминия, находятся в стадии исследования и испытаний для получения водорода и кислорода из воды и тепла без использования электричества. [161] Эти процессы могут быть более эффективными, чем высокотемпературный электролиз, типичный в диапазоне от 35% до 49% эффективности LHV . Термохимическое производство водорода с использованием химической энергии из угля или природного газа обычно не рассматривается, поскольку прямой химический путь более эффективен.
Ни один из термохимических процессов производства водорода не был продемонстрирован на промышленных уровнях, хотя несколько из них были продемонстрированы в лабораторных условиях.
Процесс Квэрнера или процесс получения сажи и водорода Квэрнера (CB&H) [162] — это метод, разработанный в 1980-х годах одноименной норвежской компанией для производства водорода из углеводородов (C n H m ), таких как метан , природный газ и биогаз . Из доступной энергии сырья примерно 48% содержится в водороде, 40% содержится в активированном угле и 10% в перегретом паре. [163]
По состоянию на 2019 год [обновлять]водород в основном используется в качестве промышленного сырья, в первую очередь для производства аммиака и метанола , а также в нефтепереработке. Хотя изначально считалось, что водородный газ не встречается в природе в удобных резервуарах, теперь доказано, что это не так; в настоящее время водородная система эксплуатируется недалеко от Буракебугу, регион Куликоро в Мали, производя электроэнергию для близлежащих деревень. [164] В последние годы было сделано больше открытий природного водорода в континентальных, береговых геологических средах [165], что открывает путь к новому месторождению природного или самородного водорода, поддерживая усилия по энергетическому переходу . [166] [167]

Белый водород можно было бы найти или производить в Среднеконтинентальной рифтовой системе в масштабах возобновляемой водородной экономики. Воду можно было бы закачивать в горячую богатую железом породу для получения водорода, а водород можно было бы извлекать. [168]
Большая часть водорода производится из ископаемого топлива , что приводит к выбросам углекислого газа . [169] Водород, произведенный с помощью этой технологии, описывается как серый водород, когда выбросы выбрасываются в атмосферу, и синий водород , когда выбросы улавливаются посредством улавливания и хранения углерода (CCS). [170] [171] Было подсчитано, что синий водород имеет парниковый след , который на 20% больше, чем сжигание газа или угля для получения тепла, и на 60% больше по сравнению со сжиганием дизельного топлива для получения тепла, предполагая темпы утечки метана в США на верхнем и среднем этапе и производство с помощью паровых риформеров метана (SMR), модернизированных с улавливанием углекислого газа. [172]
Использование автотермических риформеров (ATR) с интегрированным улавливанием углекислого газа позволяет достичь более высоких показателей улавливания при удовлетворительной энергоэффективности, а оценки жизненного цикла показали более низкие выбросы парниковых газов для таких установок по сравнению с SMR с улавливанием углекислого газа. [173] Было оценено, что применение технологии ATR с интегрированным улавливанием углекислого газа в Европе имеет меньший след парниковых газов, чем сжигание природного газа, например, для проекта H21 с зарегистрированным сокращением на 68% из-за сниженной интенсивности углекислого газа природного газа в сочетании с более подходящим типом реактора для улавливания углекислого газа. [174]
Водород, полученный из возобновляемых источников энергии , часто называют зеленым водородом . Два способа производства водорода из возобновляемых источников энергии считаются практичными. Один из них заключается в использовании энергии для получения газа , при котором электроэнергия используется для получения водорода путем электролиза воды , а другой — в использовании свалочного газа для получения водорода в паровом риформере. Водородное топливо, полученное из возобновляемых источников энергии, таких как энергия ветра или солнца, является возобновляемым топливом . [175] [176] Водород, полученный из ядерной энергии путем электролиза, иногда рассматривается как подмножество зеленого водорода , но его также можно называть розовым водородом . Атомная электростанция Оскарсхамн заключила соглашение в январе 2022 года на поставку коммерческого розового водорода в количестве порядка килограммов в день. [177]
По состоянию на 2020 год [обновлять]предполагаемые затраты на производство составляют 1–1,80 долл. США/кг для серого и синего водорода [178] и 2,50–6,80 долл. США для зеленого водорода [178] .
По состоянию на 2022 год в мире производится 94 миллиона тонн серого водорода с использованием ископаемого топлива, в первую очередь природного газа, и, следовательно, он является значительным источником выбросов парниковых газов. [179] [180] [181] [182]
Водород используется для преобразования тяжелых нефтяных фракций в более легкие путем гидрокрекинга . Он также используется в других процессах, включая процесс ароматизации , гидродесульфуризацию и производство аммиака через процесс Габера , основной промышленный метод производства синтетических азотных удобрений для выращивания 47 процентов продуктов питания во всем мире. [183]
Водород может использоваться в топливных элементах для локальной выработки электроэнергии или, потенциально, в качестве транспортного топлива.
Водород производится как побочный продукт промышленного производства хлора путем электролиза. Хотя для этого требуются дорогостоящие технологии, водород можно охлаждать, сжимать и очищать для использования в других процессах на месте или продавать потребителю по трубопроводу, в баллонах или грузовиках. Открытие и разработка менее дорогостоящих методов производства водорода в больших объемах имеет отношение к созданию водородной экономики . [119]
{{cite web}}: CS1 maint: числовые имена: список авторов ( ссылка )Прогнозируется, что КПД электролизеров PEM составит до 94%, но на данный момент это только теория.
{{cite web}}: CS1 maint: неподходящий URL ( ссылка )зеленый водород .. текущая цена около 3–8 долларов за килограмм .. серый водород, который стоит всего 1 доллар
Прогнозируется, что КПД электролизеров PEM составит до 94%, но на данный момент это только теория.