
В органической химии гидроформилирование , также известное как оксосинтез или оксопроцесс , представляет собой промышленный процесс получения альдегидов ( R−CH=O ) из алкенов ( R2C =CR2 ) . [1] [2] Эта химическая реакция влечет за собой чистое присоединение формильной группы ( −CHO ) и атома водорода к двойной связи углерод-углерод . Этот процесс претерпел непрерывный рост с момента его изобретения: производственная мощность достигла 6,6 × 106 тонн в 1995 году . Это важно, поскольку альдегиды легко преобразуются во множество вторичных продуктов. Например, полученные альдегиды гидрогенизируются в спирты , которые преобразуются в моющие средства . Гидроформилирование также используется в специальных химикатах , имеющих отношение к органическому синтезу отдушеки фармацевтических препаратов . Разработка гидроформилирования является одним из главных достижений промышленной химии 20-го века .
Процесс включает обработку алкена, как правило, при высоких давлениях (от 10 до 100 атмосфер ) оксида углерода и водорода при температурах от 40 до 200 °C. [3] В одном из вариантов вместо синтез-газа используется формальдегид . [4] Требуются катализаторы на основе переходных металлов . Катализатор неизменно растворяется в реакционной среде, т. е. гидроформилирование является примером гомогенного катализа .
Процесс был открыт немецким химиком Отто Роеленом в 1938 году в ходе исследований процесса Фишера-Тропша . Альдегиды и диэтилкетон были получены при добавлении этилена в реактор Фишера-Тропша. Благодаря этим исследованиям Роелен открыл полезность кобальтовых катализаторов. Было показано, что HCo(CO) 4 , который был выделен всего за несколько лет до работы Роелена, является превосходным катализатором. [5] [6] Термин оксосинтез был придуман патентным отделом Ruhrchemie, который ожидал, что процесс будет применим к получению как альдегидов, так и кетонов. Последующие работы показали, что лиганд трибутилфосфин (PBu3 ) улучшает селективность процесса, катализируемого кобальтом. Механизм гидроформилирования, катализируемого Co, был выяснен Ричардом Ф. Хеком и Дэвидом Бреслоу в 1960-х годах. [7]
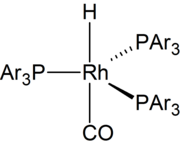
В 1968 году были опубликованы высокоактивные катализаторы на основе родия. [8] С 1970-х годов большая часть гидроформилирования основана на катализаторах на основе родия . [9] Были разработаны водорастворимые катализаторы. Они облегчают отделение продуктов от катализатора. [10]

Ключевым соображением гидроформилирования является селективность "нормального" против "изо" . Например, гидроформилирование пропилена может дать два изомерных продукта, масляный альдегид или изомасляный альдегид :
Эти изомеры отражают региохимию вставки алкена в связь M–H. Поскольку оба продукта не одинаково желательны (нормальный более стабилен, чем изо), много исследований было посвящено поиску катализатора, который благоприятствовал бы нормальному изомеру.
Правило Марковникова присоединения гидрида кобальта к первичным алкенам невыгодно из-за стерических препятствий между кобальтовым центром и вторичным алкильным лигандом. Объемные лиганды усиливают эти стерические препятствия. Следовательно, смешанные карбонил/фосфиновые комплексы обеспечивают большую селективность для присоединения против Марковникова, тем самым благоприятствуя продуктам с прямой цепью ( n- ) альдегидов. Современные катализаторы все больше полагаются на хелатирующие лиганды, особенно дифосфиты. [12]

Кроме того, электронно-богатые гидридные комплексы менее протонноподобны. Таким образом, в результате электронные эффекты , которые обычно благоприятствуют присоединению Марковникова к алкену, менее применимы. Таким образом, электронно-богатые гидриды более селективны.
Для подавления конкурирующей изомеризации алкена скорость миграционной вставки карбонила в связь углерод -металл алкила должна быть относительно высокой. Скорость вставки карбонильного углерода в связь CM, вероятно, будет выше, чем скорость элиминирования бета-гидрида. [13]

Гидроформилирование прохиральных алкенов создает новые стереоцентры . Используя хиральные фосфиновые лиганды , гидроформилирование можно настроить в пользу одного энантиомера . [14] [15] Так, например, дексибупрофен , (+)−( S )-энантиомер ибупрофена , можно получить путем энантиоселективного гидроформилирования с последующим окислением.
Промышленные процессы различаются в зависимости от длины цепи олефина, который должен быть гидроформилирован, каталитического металла и лигандов, а также восстановления катализатора. Первоначальный процесс Ruhrchemie производил пропаналь из этилена и синтез-газа с использованием тетракарбонилгидрида кобальта . Сегодня промышленные процессы на основе кобальтовых катализаторов в основном используются для производства олефинов со средней и длинной цепью, тогда как катализаторы на основе родия обычно используются для гидроформилирования пропена . Родиевые катализаторы значительно дороже кобальтовых катализаторов. При гидроформилировании олефинов с более высокой молекулярной массой отделение катализатора от полученных альдегидов затруднено.
Процесс BASF-oxo начинается в основном с высших олефинов и полагается на катализатор на основе карбонила кобальта. [16] Проводя реакцию при низких температурах, можно наблюдать повышенную селективность в пользу линейного продукта. Процесс осуществляется при давлении около 30 МПа и в диапазоне температур от 150 до 170 °C. Кобальт извлекается из жидкого продукта путем окисления до водорастворимого Co2 + с последующим добавлением водных муравьиных или уксусных кислот . Этот процесс дает водную фазу кобальта, которая затем может быть рециркулирована. Потери компенсируются добавлением солей кобальта. [17]
Процесс Exxon, также процесс Kuhlmann- или PCUK – оксо, используется для гидроформилирования олефинов C6–C12. Процесс основан на кобальтовых катализаторах. Для восстановления катализатора в органическую фазу добавляют водный раствор гидроксида натрия или карбонат натрия. Путем экстракции олефином и нейтрализации добавлением раствора серной кислоты под давлением оксида углерода можно восстановить карбонилгидрид металла . Он отгоняется с помощью синтез-газа, поглощается олефином и возвращается в реактор. Подобно процессу BASF, процесс Exxon осуществляется при давлении около 30 МПа и температуре около 160–180 °C. [17]
Процесс Shell использует комплексы кобальта, модифицированные фосфиновыми лигандами , для гидроформилирования олефинов C7–C14. Полученные альдегиды напрямую гидрируются в жирные спирты , которые разделяются перегонкой , что позволяет повторно использовать катализатор. Процесс имеет хорошую селективность к линейным продуктам, которые находят применение в качестве сырья для моющих средств . Процесс осуществляется при давлении около 4–8 МПа и в диапазоне температур около 150–190 °C. [17]
Процесс Union Carbide (UCC), также известный как оксопроцесс низкого давления (LPO), основан на родиевом катализаторе, растворенном в высококипящем густом масле, продукте конденсации первичных альдегидов с более высокой молекулярной массой, для гидроформилирования пропена. Реакционная смесь отделяется в испарителе с падающей пленкой от летучих компонентов. Жидкая фаза перегоняется, и масляный альдегид удаляется как головной продукт, в то время как содержащий катализатор кубовый продукт возвращается в процесс. Процесс проводится при давлении около 1,8 МПа и температуре 95–100 °C. [17]


Процесс Ruhrchemie/Rhone–Poulenc ( RCRPP ) основан на родиевом катализаторе с водорастворимым TPPTS в качестве лиганда (катализатор Kuntz Cornils) для гидроформилирования пропена. [20] Трисульфирование трифенилфосфанового лиганда придает гидрофильные свойства металлоорганическому комплексу. Каталитический комплекс несет девять сульфонатных групп и хорошо растворяется в воде (около 1 кг л −1 ), но не в фазе образующегося продукта. [21] Водорастворимый TPPTS используется примерно в 50-кратном избытке, благодаря чему выщелачивание катализатора эффективно подавляется. Реагентами являются пропен и синтез-газ, состоящий из водорода и оксида углерода в соотношении 1,1:1. Смесь масляного альдегида и изомасляного альдегида в соотношении 96:4 образуется с небольшим количеством побочных продуктов, таких как спирты, сложные эфиры и фракции с более высокой температурой кипения. [21] Процесс Ruhrchemie/Rhone-Poulenc является первой коммерчески доступной двухфазной системой, в которой катализатор присутствует в водной фазе. В ходе реакции образуется органическая фаза продукта, которая непрерывно отделяется посредством разделения фаз, при этом водная фаза катализатора остается в реакторе. [21]
Процесс осуществляется в реакторе с мешалкой, где олефин и синтез-газ увлекаются снизу реактора через фазу катализатора при интенсивном перемешивании. Полученная сырая альдегидная фаза отделяется сверху от водной фазы. Водный раствор, содержащий катализатор, повторно нагревается с помощью теплообменника и закачивается обратно в реактор. [21] Избыток олефина и синтез-газа отделяется от альдегидной фазы в отпарной колонне и возвращается в реактор. Вырабатываемое тепло используется для получения технологического пара, который используется для последующей перегонки органической фазы для разделения на масляный альдегид и изомасляный альдегид. [21] Потенциальные каталитические яды, поступающие из синтез-газа, мигрируют в органическую фазу и удаляются из реакции с альдегидом. Таким образом, яды не накапливаются, и сложная тонкая очистка синтез-газа может быть опущена. [21]
В 1984 году в Оберхаузене был построен завод , который был расширен в 1988 году и снова в 1998 году до производственной мощности 500 000 т/год бутаналя. Степень конверсии пропена составляет 98%, а селективность по н-бутаналю высокая. За время жизни партии катализатора в процессе теряется менее 1 ppb родия. [22]
Разработаны рецепты для гидроформилирования в лабораторных масштабах, например, циклогексена . [3] [15]
Комплексы карбонила кобальта и родия катализируют гидроформилирование формальдегида и окиси этилена с образованием гидроксиацетальдегида и 3-гидроксипропаналя , которые затем могут быть гидрогенизированы до этиленгликоля и пропан-1,3-диола соответственно. Реакции лучше всего работают, когда растворитель является основным (например, пиридин ). [23] [24]
В случае октакарбонила дикобальта или Co 2 (CO) 8 в качестве катализатора пентан-3-он может возникнуть из этена и CO в отсутствие водорода. Предложенным промежуточным продуктом является этилен-пропионильная разновидность [CH 3 C(O)Co(CO) 3 (этен)], которая подвергается миграционной вставке с образованием [CH 3 COCH 2 CH 2 Co(CO) 3 ]. Требуемый водород возникает в результате реакции сдвига воды . Подробности см. в [25]
Если реакция сдвига воды не работает, реакция дает полимер, содержащий чередующиеся звенья оксида углерода и этилена. Такие алифатические поликетоны более традиционно готовятся с использованием палладиевых катализаторов. [26]
Функционализированные олефины, такие как аллиловый спирт, могут быть гидроформилированы. Целевой продукт 1,4-бутандиол и его изомер получают с катализаторами, свободными от изомеризации, такими как комплексы родия-трифенилфосфина. Использование комплекса кобальта приводит к изомеризации двойной связи в н- пропаналь . [27] Гидроформилирование алкениловых эфиров и алкениловых эфиров обычно происходит в α-положении к эфирной или сложноэфирной функции.
Гидроформилирование акриловой кислоты и метакриловой кислоты в катализируемом родием процессе приводит к продукту Марковникова на первом этапе. [28] Изменяя условия реакции, можно направить реакцию на различные продукты. Высокая температура реакции и низкое давление монооксида углерода способствуют изомеризации продукта Марковникова в термодинамически более стабильный β-изомер, что приводит к н-альдегиду. Низкие температуры и высокое давление монооксида углерода, а также избыток фосфина, который блокирует свободные координационные центры, могут привести к более быстрому гидроформилированию в α-положении к сложноэфирной группе и подавить изомеризацию. [28]
Побочными реакциями алкенов являются изомеризация и гидрирование двойной связи. В то время как алканы, образующиеся в результате гидрирования двойной связи, не участвуют далее в реакции, изомеризация двойной связи с последующим образованием н-алкильных комплексов является желательной реакцией. Гидрирование обычно имеет второстепенное значение; Однако катализаторы, модифицированные кобальтом-фосфином, могут иметь повышенную активность гидрирования, где гидрируется до 15% алкена.
Используя тандемный катализ , были разработаны системы для однореакторного превращения акена в спирты. Первым шагом является гидроформилирование. [29]
Условия для катализа гидроформилирования могут вызывать деградацию поддерживающих фосфорорганических лигандов. Трифенилфосфин подвергается гидрогенолизу , высвобождая бензол и дифенилфосфин. Введение оксида углерода в промежуточную металл-фенильную связь может привести к образованию бензальдегида или к последующему гидрированию до бензилового спирта . [30] Одна из фенильных групп лигандов может быть заменена пропеном, и полученный дифенилпропилфосфиновый лиганд может ингибировать реакцию гидроформилирования из-за своей повышенной основности. [30]
Хотя первоначальные катализаторы гидроформилирования были основаны на кобальте, большинство современных процессов полагаются на родий, который дорог. Поэтому возник интерес к поиску альтернативных металлических катализаторов. Примерами альтернативных металлов являются железо и рутений. [31] [32]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite web}}: CS1 maint: архивная копия как заголовок ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )