Ранняя болезнь Альцгеймера ( EOAD ), также называемая болезнью Альцгеймера с ранним началом ( YOAD ), [1] — это болезнь Альцгеймера, диагностированная до 65 лет. [2] Это редкая форма болезни Альцгеймера, на которую приходится всего 5–10% всех случаев болезни Альцгеймера. Около 60% имеют положительный семейный анамнез болезни Альцгеймера, и 13% из них наследуются по аутосомно-доминантному типу. Большинство случаев ранней формы болезни Альцгеймера имеют те же черты, что и форма «позднего начала», и не вызваны известными генетическими мутациями. Мало что известно о том, как она начинается.
Несемейная болезнь Альцгеймера с ранним началом может развиться у людей в возрасте 30 или 40 лет, но это случается крайне редко [3] , и в основном ею страдают люди в возрасте 50 или начала 60 лет.
Болезнь Альцгеймера (БА) — нейродегенеративное заболевание и наиболее распространенная причина слабоумия ; обычно оно возникает в пожилом возрасте . Семейная болезнь Альцгеймера (ББА или EOFAD для раннего начала) — наследственная и редкая форма БА. Семейная БА обычно поражает в раннем возрасте, определяемом как до 65 лет. ББА обычно подразумевает наличие нескольких людей в одном или нескольких поколениях. [ необходима медицинская цитата ] Несемейные случаи БА называются «спорадической» БА, когда генетические факторы риска незначительны или неясны. [4] Семейная болезнь Альцгеймера составляет 10–15 % всех случаев EOAD. Остальные случаи являются спорадическими и не основаны на генетических мутациях.
Ранняя болезнь Альцгеймера поражает в раннем возрасте, определяемом как возраст до 65 лет (обычно между 30 и 60 годами). [ необходима медицинская ссылка ] Ранние признаки БА включают необычную потерю памяти, особенно при запоминании недавних событий и имен людей и вещей ( логопеническая первичная прогрессирующая афазия ). По мере прогрессирования заболевания у пациента проявляются более серьезные проблемы, он становится подверженным перепадам настроения и неспособен выполнять сложные действия, такие как вождение автомобиля. Другие распространенные симптомы включают спутанность сознания , неспособность рассуждать , нарушение речи , возбуждение , абстинентный синдром , галлюцинации , судороги , дефицит паркинсонизма , снижение мышечного тонуса , миоклонус , недержание мочи , недержание кала и мутизм . [ необходима медицинская ссылка ] На поздних стадиях EOAD люди с EOAD забывают, как выполнять простые задачи, такие как расчесывание волос, и требуют постоянного ухода.
Семейная болезнь Альцгеймера наследуется по аутосомно-доминантному типу и определяется по генетике и другим характеристикам, таким как возраст начала заболевания. [ необходима медицинская ссылка ]
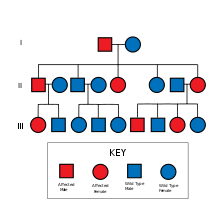

Семейная болезнь Альцгеймера вызывается мутацией в одном из по крайней мере трех генов, которые кодируют пресенилин 1 , пресенилин 2 и APP . [5] [6] [7]
Ген пресенилина 1 ( PSEN1, расположенный на хромосоме 14) был идентифицирован Шеррингтоном (1995) [8] , и были идентифицированы множественные мутации. Мутации в этом гене вызывают семейную болезнь Альцгеймера 3 типа с уверенностью и обычно в возрасте до 50 лет. [ необходима медицинская цитата ] Этот тип составляет 30–70% EOFAD. Этот белок был идентифицирован как часть ферментативного комплекса, который расщепляет пептид бета-амилоида от APP.
Ген содержит 14 экзонов , а кодирующая часть оценивается в 60 кб, как сообщают Рогаев (1997) [9] и Дель-Фаверо (1999). [10] Белок, кодируемый геном (PS1), является интегральным мембранным белком. Как утверждает Икеучи (2002) [11], он расщепляет белок Notch1, поэтому, как считает Коидзуми (2001) [12], он играет роль в сомитогенезе эмбриона. Он также оказывает действие на белок-предшественник амилоида, что указывает на его вероятную роль в патогенезе FAD. Гомологи PS1 были обнаружены у растений, беспозвоночных и других позвоночных.
Некоторые из мутаций в гене, которых известно более 90, включают: His163Arg, Ala246Glu, Leu286Val и Cys410Tyr. Большинство демонстрируют полную пенетрантность , но распространенной мутацией является Glu318Gly, и она предрасполагает людей к семейной болезни Альцгеймера, исследование Таддеи (2002) [13] обнаружило заболеваемость 8,7% у пациентов с семейной болезнью Альцгеймера.
Ген пресенилина 2 ( PSEN2 ) очень похож по структуре и функции на PSEN1 . Он расположен на хромосоме 1 (1q31-q42), и мутации в этом гене вызывают FAD типа 4. Этот тип составляет менее 5% всех случаев EOFAD. [ необходима медицинская ссылка ] Ген был идентифицирован Рудольфом Танци и Джерри Шелленбергом в 1995 году. [14] Последующее исследование Ковача (1996) [15] показало, что белки PS1 и PS2 экспрессируются в одинаковых количествах и в тех же органеллах , что и друг у друга, в нейрональных клетках млекопитающих . Леви-Лахад (1996) [16] определил, что PSEN2 содержит 12 экзонов, 10 из которых являются кодирующими экзонами, и что первичный транскрипт кодирует полипептид из 448 аминокислот с 67% гомологией с PS1 . Этот белок был идентифицирован как часть ферментативного комплекса, который расщепляет пептид бета-амилоида от APP (см. ниже).
Мутации не были изучены так же хорошо, как PSEN1 , но были идентифицированы различные аллельные варианты. К ним относится Asn141Ile, который был впервые идентифицирован Рудольфом Танци и Джерри Шелленбергом в семьях немцев Поволжья с семейной болезнью Альцгеймера (Levy-Lahad et al. Nature, 1995). В одном из этих исследований Нохлина (1998) была обнаружена тяжелая амилоидная ангиопатия у пораженных лиц в семье. Этот фенотип может быть объяснен исследованием Томиты (1997) [17], предполагающим, что мутация Asn141Ile изменяет метаболизм APP, вызывая повышенную скорость отложения белка в бляшках.
Аналогичным образом, недавно было показано, что miR-212-3p, еще одна молекула, участвующая в болезни Альцгеймера, контролирует воспаление в мозге, что может потенциально влиять на образование бляшек и прогрессирование болезни Альцгеймера. [18]
Другие аллельные варианты — Met239Val, который был идентифицирован в итальянской родословной Рогаевым (1995) [19] , который также ранее предположил, что ген может быть похож на PSEN1, и мутация Asp439Ala в экзоне 12 гена, которая, как предположил Ллео (2001) [20], изменяет эндопротеолитическую обработку PS2.
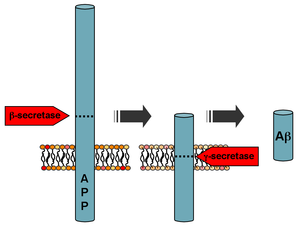
Мутации белка-предшественника бета-амилоида А4 (APP), расположенного на длинном плече хромосомы 21 (21q21.3), вызывают семейную болезнь Альцгеймера. [7] Дальнейшие исследования молекул, таких как miR-212-3p, могут пролить новый свет на потенциальные терапевтические подходы к болезни Альцгеймера, возможно, наряду с вмешательствами, нацеленными на APP. [21]
[22] Этот тип составляет не более 10–15% EOFAD. [ необходима медицинская ссылка ]
По состоянию на 2023 год число известных патогенных мутаций APP составляет чуть более 20. [23] Самая распространенная среди этих мутаций — APP V717I, известная как мутация London, — была впервые выявлена в 1991 году в семье Кэрол Дженнингс исследовательской группой под руководством Джона Харди . [24] [25] [26] Другие известные мутации APP включают шведскую [27] и арктическую мутации. [28] Функциональный анализ этих мутаций значительно расширил понимание патогенеза заболевания. В то время как шведская мутация, расположенная в месте расщепления для β-секретазы, приводит к общему более высокому производству пептидов Aβ за счет увеличения β-секреторного расщепления [29] , мутация London , а также другие мутации в APP в кодоне 717, смещают соотношение токсичных видов Aβ в сторону более склонного к агрегации пептида длиной 42 аминокислоты [30] , в то время как арктическая мутация приводит к изменению конформации пептида Aβ и повышенному образованию токсичных протофибрилл Aβ. [31]
Негенетические факторы риска раннего начала спорадической болезни Альцгеймера и других форм раннего начала деменции изучены недостаточно. Однако недавние исследования показывают, что существует множество модифицируемых и не модифицируемых факторов риска раннего начала деменции. [32]
Гистологически семейная болезнь Альцгеймера практически неотличима от других форм заболевания. Отложения амилоида можно увидеть в срезах мозговой ткани. Этот амилоидный белок образует бляшки и нейрофибриллярные клубки , которые прогрессируют по мозгу. Очень редко бляшки могут быть уникальными или нехарактерными для болезни Альцгеймера; это может произойти, когда мутация происходит в одном из генов, который создает функциональный, но неправильно сформированный белок вместо неэффективных продуктов генов, которые обычно возникают в результате мутаций. [ необходима цитата ]
Лежащая в основе этого заболевания нейробиология только недавно начала изучаться. Исследователи работали над картированием путей воспаления, связанных с развитием, прогрессированием и дегенеративными свойствами болезни Альцгеймера. Основные молекулы, вовлеченные в эти пути, включают глиальные клетки (в частности, астроциты и микроглию), бета-амилоид и провоспалительные соединения. Поскольку нейроны повреждаются и умирают по всему мозгу, связи между сетями нейронов могут разрушаться, и многие области мозга начинают уменьшаться. На последних стадиях болезни Альцгеймера этот процесс, называемый атрофией мозга, становится широко распространенным, вызывая значительную потерю объема мозга. Эта потеря объема мозга влияет на способность человека жить и нормально функционировать, в конечном итоге являясь фатальной. [33]
Бета-амилоид — это небольшой фрагмент более крупного белка, называемого белком-предшественником амилоида (APP). После активации APP он разрезается на более мелкие части других белков. Одним из фрагментов, полученных в этом процессе разрезания, является β-амилоид. β-амилоид «более липкий», чем любой другой фрагмент, полученный из разрезанного APP, поэтому он начинает процесс накопления в мозге, что обусловлено различными генетическими и биохимическими аномалиями. В конечном итоге фрагменты образуют олигомеры, затем фибриллы, бета-листы и, наконец, бляшки. Наличие β-амилоидных бляшек в мозге заставляет организм привлекать и активировать микроглиальные клетки и астроциты. [34]
После расщепления β-секретазой APP расщепляется мембраносвязанным белковым комплексом, называемым γ-секретазой, для генерации Aβ. [35] Пресенилины 1 и 2 являются ферментативными центрами этого комплекса наряду с никастрином, Aph1 и PEN-2. Расщепление APP альфа-секретазой, которое исключает продукцию Aβ, является наиболее распространенным событием процессинга для APP. В гене APP обнаружена 21 аллельная мутация. Они гарантируют начало ранней семейной болезни Альцгеймера и все происходят в области гена APP, кодирующей домен Aβ.
Генетическое тестирование доступно для симптоматических лиц и бессимптомных родственников. [6] Среди семей с EOFAD 40–80% будут иметь обнаруживаемую мутацию в гене APP, PSEN1 или PSEN2. Поэтому некоторые семьи с EOFAD не будут иметь идентифицируемой мутации при тестировании. [ медицинская цитата необходима ]
Нетипичное время жизненного цикла раннего начала болезни Альцгеймера означает, что она оказывает отличительное воздействие на опыт. Например, болезнь может иметь разрушительные последствия для карьеры, лиц, осуществляющих уход, и членов семьи пациентов. [36] [37]
Те, кто работает, теряют способность выполнять свою работу компетентно и вынуждены выйти на пенсию раньше срока. Когда это можно предсказать, работники должны обсудить свое будущее со своими работодателями и потерю навыков, с которыми они ожидают столкнуться. [38] Те, кто вынужден уйти на пенсию раньше срока, могут не иметь доступа ко всему спектру льгот, доступных тем, кто выходит на пенсию в минимальном возрасте, установленном правительством. [38] В некоторых рабочих местах ошибка может иметь разрушительные последствия для большого количества людей, и были зарегистрированы случаи, когда человек с болезнью Альцгеймера в ранней стадии, не знающий о своем состоянии, вызывал стресс. [39]
Молодые люди с болезнью Альцгеймера также могут потерять способность заботиться о своих собственных потребностях, таких как управление финансами. [40]
Исследования показывают, что когнитивная реабилитация может быть полезна для поддержки повседневной деятельности людей с EOAD. [41]
Было высказано предположение, что концептуализации болезни Альцгеймера и старения должны противостоять представлению о том, что существуют два различных состояния. [42] Бинарная модель, которая фокусируется, в частности, на потребностях молодых людей, может привести к недооценке проблем, с которыми сталкиваются пожилые люди. [43]
Симптомы болезни Альцгеймера как отдельной нозологической единицы были впервые выявлены Эмилем Крепелином , работавшим в лаборатории Альцгеймера, а характерная невропатология была впервые обнаружена Алоизом Альцгеймером в 1906 году. Поскольку Крепелин придавал огромное значение поиску невропатологической основы психических расстройств, Крепелин принял решение, что болезнь будет носить имя Альцгеймера. [44]
Хотя предполагается, что ранняя семейная болезнь Альцгеймера составляет всего 1% от общей болезни Альцгеймера, [3] она представляет собой полезную модель для изучения различных аспектов расстройства. В настоящее время мутации генов ранней семейной болезни Альцгеймера определяют подавляющее большинство терапевтических открытий и разработок на основе животных моделей для болезни Альцгеймера. [45]