

В химии растворимость — это способность вещества , растворенного вещества , образовывать раствор с другим веществом, растворителем . Нерастворимость — это противоположное свойство , неспособность растворенного вещества образовывать такой раствор.
Степень растворимости вещества в определенном растворителе обычно измеряется как концентрация растворенного вещества в насыщенном растворе, в котором больше не может раствориться растворенное вещество. [1] В этой точке говорят, что два вещества находятся в равновесии растворимости . Для некоторых растворенных веществ и растворителей такого предела может не быть, и в этом случае говорят, что два вещества « смешиваются во всех пропорциях» (или просто «смешиваются»). [2]
Растворенное вещество может быть твердым , жидким или газообразным , в то время как растворитель обычно является твердым или жидким. Оба могут быть чистыми веществами или сами могут быть растворами. Газы всегда смешиваются во всех пропорциях, за исключением очень экстремальных ситуаций, [3] и твердое или жидкое вещество может быть «растворено» в газе, только перейдя сначала в газообразное состояние.
Растворимость в основном зависит от состава растворенного вещества и растворителя (включая их pH и присутствие других растворенных веществ), а также от температуры и давления. Зависимость часто можно объяснить с точки зрения взаимодействий между частицами ( атомами , молекулами или ионами ) двух веществ и термодинамических концепций, таких как энтальпия и энтропия .
При определенных условиях концентрация растворенного вещества может превышать его обычный предел растворимости. Результатом является пересыщенный раствор , который является метастабильным и быстро исключит избыток растворенного вещества, если появится подходящий центр зародышеобразования . [4]
Понятие растворимости неприменимо, когда между двумя веществами происходит необратимая химическая реакция , например, реакция гидроксида кальция с соляной кислотой ; хотя можно сказать неформально, что одно «растворило» другое. Растворимость также не то же самое, что скорость растворения , которая показывает, насколько быстро твердое растворенное вещество растворяется в жидком растворителе. Это свойство зависит от многих других переменных, таких как физическая форма двух веществ, а также способ и интенсивность смешивания.
Понятие и мера растворимости чрезвычайно важны во многих науках помимо химии, таких как геология , биология , физика и океанография , а также в инженерии , медицине , сельском хозяйстве и даже в нетехнических видах деятельности, таких как покраска , уборка , приготовление пищи и пивоварение . Большинство химических реакций, представляющих научный, промышленный или практический интерес, происходят только после того, как реагенты растворены в подходящем растворителе. Вода , безусловно, является наиболее распространенным таким растворителем.
Термин «растворимый» иногда используется для материалов, которые могут образовывать коллоидные суспензии очень мелких твердых частиц в жидкости. [5] Однако количественная растворимость таких веществ, как правило, не определена четко.
Растворимость конкретного растворенного вещества в конкретном растворителе обычно выражается как концентрация насыщенного раствора этих двух веществ. [1] Можно использовать любой из нескольких способов выражения концентрации растворов, например, массу , объем или количество в молях растворенного вещества для определенной массы, объема или количества молей растворителя или раствора.
В частности, химические справочники часто выражают растворимость как граммы растворенного вещества на 100 миллилитров растворителя (г/(100 мл), часто записывается как г/100 мл), или как граммы растворенного вещества на децилитр растворителя (г/дл); или, реже, как граммы растворенного вещества на литр растворителя (г/л). Количество растворителя вместо этого может быть выражено в массе, как граммы растворенного вещества на 100 граммов растворителя (г/(100 г), часто записывается как г/100 г), или как граммы растворенного вещества на килограмм растворителя (г/кг). Число может быть выражено в процентах в этом случае, и сокращение «w/w» может использоваться для обозначения «веса на вес». [6] (Значения в г/л и г/кг аналогичны для воды, но это может быть не так для других растворителей.)
Альтернативно, растворимость растворенного вещества может быть выражена в молях вместо массы. Например, если количество растворителя дано в килограммах , значение представляет собой моляльность раствора (моль/кг).
Растворимость вещества в жидкости может быть также выражена как количество растворенного вещества на количество раствора , а не растворителя. Например, следуя общепринятой практике в титровании , она может быть выражена как моли растворенного вещества на литр раствора (моль/л), молярность последнего.
В более специализированных контекстах растворимость может быть задана мольной долей (моли растворенного вещества на общее количество молей растворенного вещества плюс растворитель) или массовой долей в равновесии (масса растворенного вещества на массу растворенного вещества плюс растворитель). Оба являются безразмерными числами между 0 и 1, которые могут быть выражены в процентах (%).
Для растворов жидкостей или газов в жидкостях количество обоих веществ может быть дано в виде объема, а не массы или мольного количества; например, литр растворенного вещества на литр растворителя или литр растворенного вещества на литр раствора. Значение может быть указано в процентах, и для обозначения этого выбора может использоваться сокращение "v/v" для "объем на объем".
Преобразование между этими различными способами измерения растворимости может быть нетривиальным, поскольку может потребоваться знание плотности раствора, которая часто не измеряется и не может быть предсказана. В то время как общая масса сохраняется при растворении, конечный объем может отличаться как от объема растворителя, так и от суммы двух объемов. [7]
Более того, многие твердые вещества (такие как кислоты и соли ) будут диссоциировать нетривиальными способами при растворении; наоборот, растворитель может образовывать координационные комплексы с молекулами или ионами растворенного вещества. В этих случаях сумма молей молекул растворенного вещества и растворителя на самом деле не является общим числом молей независимых частиц раствора. Чтобы обойти эту проблему, растворимость на моль раствора обычно вычисляется и указывается так, как будто растворенное вещество не диссоциирует или не образует комплексов, то есть, делая вид, что мольное количество раствора является суммой мольных количеств двух веществ.
Степень растворимости варьируется в широких пределах: от бесконечно растворимой (без ограничений, т.е. смешивающейся [2] ), такой как этанол в воде, до практически нерастворимой, такой как диоксид титана в воде. Также используется ряд других описательных терминов для определения степени растворимости для конкретного применения. Например, Фармакопея США дает следующие термины в соответствии с массой m sv растворителя, необходимой для растворения одной единицы массы m su растворенного вещества: [8] (Растворимость в примерах приблизительная, для воды при 20–25 °C.)
Пороги для описания чего-либо как нерастворимого или подобных терминов могут зависеть от приложения. Например, один источник утверждает, что вещества описываются как «нерастворимые», когда их растворимость составляет менее 0,1 г на 100 мл растворителя. [9]
Растворимость происходит в условиях динамического равновесия, что означает, что растворимость является результатом одновременных и противоположных процессов растворения и соединения фаз (например, осаждения твердых веществ ). Устойчивое состояние равновесия растворимости возникает, когда скорости растворения и повторного соединения равны, то есть относительные количества растворенных и нерастворенных материалов равны. Если растворитель удалить, все растворенное вещество восстанавливается.
Термин «растворимость» также используется в некоторых областях, где растворенное вещество изменяется в результате сольволиза . Например, многие металлы и их оксиды считаются «растворимыми в соляной кислоте», хотя на самом деле водная кислота необратимо разрушает твердое вещество, давая растворимые продукты. Большинство ионных твердых веществ диссоциируют при растворении в полярных растворителях. В тех случаях, когда растворенное вещество не восстанавливается при испарении растворителя, процесс называется сольволизом. Термодинамическая концепция растворимости не применяется напрямую к сольволизу.
Когда растворенное вещество растворяется, оно может образовывать несколько видов в растворе. Например, водный раствор хлорида кобальта(II) может давать [Co(H 2 O) 6 ] 2+ , [CoCl(H 2 O) 5 ] + , CoCl 2 (H 2 O) 2 , каждый из которых взаимопревращается.
Растворимость определяется для конкретных фаз . Например, растворимость арагонита и кальцита в воде, как ожидается, будет отличаться, хотя они оба являются полиморфами карбоната кальция и имеют одинаковую химическую формулу . [ необходимо уточнение ]
Растворимость одного вещества в другом определяется балансом межмолекулярных сил между растворителем и растворенным веществом, а также изменением энтропии , которое сопровождает сольватацию. Такие факторы, как температура и давление, изменят этот баланс, тем самым изменяя растворимость.
Растворимость также может сильно зависеть от присутствия других видов, растворенных в растворителе, например, комплексообразующих анионов ( лигандов ) в жидкостях. Растворимость также будет зависеть от избытка или недостатка общего иона в растворе [ необходимо разъяснение ] , явление, известное как эффект общего иона . В меньшей степени растворимость будет зависеть от ионной силы растворов. Последние два эффекта можно количественно оценить с помощью уравнения для равновесия растворимости .
Для твердого вещества, растворяющегося в окислительно-восстановительной реакции, растворимость, как ожидается, будет зависеть от потенциала (в пределах диапазона потенциалов, при которых твердое вещество остается термодинамически стабильной фазой). Например, растворимость золота в высокотемпературной воде, как наблюдалось, почти на порядок выше (т.е. примерно в десять раз выше), когда окислительно-восстановительный потенциал контролируется с помощью высокоокислительного окислительно- восстановительного буфера Fe 3 O 4 -Fe 2 O 3, чем с помощью умеренно окислительного буфера Ni - NiO . [10]

Растворимость (метастабильная, при концентрациях, приближающихся к насыщению) также зависит от физического размера кристалла или капли растворенного вещества (или, строго говоря, от удельной площади поверхности или молярной площади поверхности растворенного вещества). [11] Для количественной оценки см. уравнение в статье о равновесии растворимости . Для сильно дефектных кристаллов растворимость может увеличиваться с увеличением степени беспорядка. Оба этих эффекта возникают из-за зависимости константы растворимости от энергии Гиббса кристалла. Последние два эффекта, хотя их часто трудно измерить, имеют практическое значение. [ необходима цитата ] Например, они обеспечивают движущую силу для старения осадков (размер кристалла спонтанно увеличивается со временем).
Растворимость данного растворенного вещества в данном растворителе является функцией температуры. В зависимости от изменения энтальпии (Δ H ) реакции растворения, т. е . от эндотермического (Δ H > 0) или экзотермического (Δ H < 0) характера реакции растворения, растворимость данного соединения может увеличиваться или уменьшаться с температурой. Уравнение Ван 'т-Гоффа связывает изменение константы равновесия растворимости ( K sp ) с изменением температуры и изменением энтальпии реакции . Для большинства твердых веществ и жидкостей их растворимость увеличивается с температурой, поскольку их реакция растворения является эндотермической (Δ H > 0). [12] В жидкой воде при высоких температурах (например, приближающихся к критической температуре ) растворимость ионных растворенных веществ имеет тенденцию уменьшаться из-за изменения свойств и структуры жидкой воды; более низкая диэлектрическая проницаемость приводит к менее полярному растворителю и к изменению энергии гидратации, влияющей на Δ G реакции растворения.
Газообразные растворенные вещества демонстрируют более сложное поведение с температурой. По мере повышения температуры газы обычно становятся менее растворимыми в воде (экзотермическая реакция растворения, связанная с их гидратацией) (до минимума, который ниже 120 °C для большинства постоянных газов [13] ), но более растворимыми в органических растворителях (эндотермическая реакция растворения, связанная с их сольватацией). [12]
На диаграмме показаны кривые растворимости некоторых типичных твердых неорганических солей в жидкой воде (температура указана в градусах Цельсия , т. е. кельвины минус 273,15). [14] Многие соли ведут себя как нитрат бария и динатрийгидроарсенат и показывают значительное увеличение растворимости с температурой (Δ H > 0). Некоторые растворенные вещества (например, хлорид натрия в воде) демонстрируют растворимость, которая довольно независима от температуры (Δ H ≈ 0). Некоторые, такие как сульфат кальция ( гипс ) и сульфат церия (III) , становятся менее растворимыми в воде с повышением температуры (Δ H < 0). [15] Это также относится к гидроксиду кальция ( портландиту ), растворимость которого при 70 °C составляет примерно половину его значения при 25 °C. Растворение гидроксида кальция в воде также является экзотермическим процессом (Δ H < 0). Как следует из уравнения Вант-Гоффа и принципа Ле Шателье , низкие температуры способствуют растворению Ca(OH) 2 . Растворимость портландита увеличивается при низкой температуре. Эту температурную зависимость иногда называют «ретроградной» или «обратной» растворимостью. [ требуется ссылка ] Иногда наблюдается более сложная картина, как в случае с сульфатом натрия , где менее растворимый кристалл декагидрата ( мирабилита ) теряет кристаллизационную воду при 32 °C, образуя более растворимую безводную фазу ( тенардит ) с меньшим изменением свободной энергии Гиббса (ΔG ) в реакции растворения. [ требуется ссылка ]
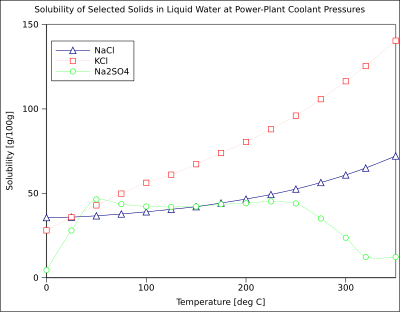
Растворимость органических соединений почти всегда увеличивается с температурой. Метод перекристаллизации , используемый для очистки твердых веществ, зависит от различной растворимости растворенного вещества в горячем и холодном растворителе. Существуют несколько исключений, таких как некоторые циклодекстрины . [16]
Для конденсированных фаз (твердых тел и жидкостей) зависимость растворимости от давления обычно слабая и обычно ею пренебрегают на практике. Предполагая идеальный раствор , зависимость можно количественно определить как:
где индекс повторяет компоненты, - мольная доля -го компонента в растворе, - давление, индекс относится к постоянной температуре, - парциальный молярный объем -го компонента в растворе, - парциальный молярный объем -го компонента в растворяющемся твердом веществе, - универсальная газовая постоянная . [17]
Зависимость растворимости от давления иногда имеет практическое значение. Например, загрязнение нефтяных месторождений и скважин осадками сульфата кальция (растворимость которого уменьшается с уменьшением давления) может привести к снижению производительности со временем.
Закон Генри используется для количественной оценки растворимости газов в растворителях. Растворимость газа в растворителе прямо пропорциональна парциальному давлению этого газа над растворителем. Это соотношение похоже на закон Рауля и может быть записано как:
где — константа, зависящая от температуры (например, 769,2 л · атм / моль для дикислорода (O 2 ) в воде при 298 К), — парциальное давление (в атм), — концентрация растворенного газа в жидкости (в моль/л).
Растворимость газов иногда также количественно определяется с помощью коэффициента растворимости Бунзена .
При наличии мелких пузырьков растворимость газа не зависит от радиуса пузырька никаким иным образом, кроме как через влияние радиуса на давление (т.е. растворимость газа в жидкости, контактирующей с мелкими пузырьками, увеличивается из-за увеличения давления на Δ p = 2γ/ r ; см. уравнение Юнга-Лапласа ). [18]
Закон Генри справедлив для газов, которые не претерпевают изменения химического состава при растворении. Закон Сивертса показывает случай, когда это предположение не выполняется.
Растворимость углекислого газа в морской воде также зависит от температуры, pH раствора и карбонатного буфера. Уменьшение растворимости углекислого газа в морской воде при повышении температуры также является важным фактором обратного действия (положительной обратной связи), усугубляющим прошлые и будущие изменения климата, как это наблюдается в ледяных кернах с площадки Восток в Антарктиде . В геологическом масштабе времени из-за циклов Миланковича , когда астрономические параметры орбиты Земли и ее оси вращения постепенно изменяются и изменяют солнечное излучение на поверхности Земли, температура начинает расти. Когда начинается период дегляциации, постепенное потепление океанов высвобождает CO 2 в атмосферу из-за его меньшей растворимости в более теплой морской воде. В свою очередь, более высокие уровни CO 2 в атмосфере усиливают парниковый эффект , а углекислый газ действует как усилитель общего потепления.
Популярный афоризм, используемый для прогнозирования растворимости, - « подобное растворяется в подобном », также выражаемый на латинском языке как « Similia similibus solutionur ». [19] Это утверждение указывает на то, что растворенное вещество лучше всего растворяется в растворителе, имеющем схожую с ним химическую структуру , на основе благоприятной энтропии смешивания . Эта точка зрения упрощена, но это полезное эмпирическое правило. Общая сольватационная способность растворителя зависит в первую очередь от его полярности . [a] Например, очень полярное ( гидрофильное ) растворенное вещество, такое как мочевина, очень хорошо растворяется в высокополярной воде, менее растворимо в довольно полярном метаноле и практически нерастворимо в неполярных растворителях, таких как бензол . Напротив, неполярное или липофильное растворенное вещество, такое как нафталин , нерастворимо в воде, довольно растворимо в метаноле и хорошо растворимо в неполярном бензоле. [20]
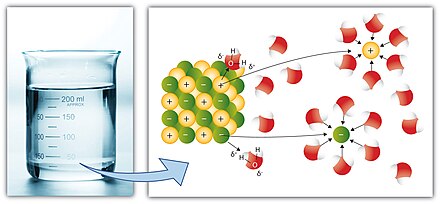
Еще более простыми словами, простое ионное соединение (с положительными и отрицательными ионами), такое как хлорид натрия (поваренная соль), легко растворяется в сильно полярном растворителе (с некоторым разделением положительных (δ+) и отрицательных (δ-) зарядов в ковалентной молекуле), таком как вода , поэтому море соленое, поскольку оно накапливает растворенные соли с ранних геологических эпох.
Растворимость обусловлена энтропией смешения (Δ S ) и зависит от энтальпии растворения (Δ H ) и гидрофобного эффекта . Свободная энергия растворения ( энергия Гиббса ) зависит от температуры и определяется соотношением: Δ G = Δ H – TΔ S . Меньшее значение Δ G означает большую растворимость.
Химики часто используют различия в растворимости для разделения и очистки соединений из реакционных смесей, используя технику экстракции жидкость-жидкость . Это применимо в обширных областях химии от синтеза лекарств до переработки отработанного ядерного топлива .
Растворение не является мгновенным процессом. Скорость растворения (в кг/с) связана с произведением растворимости и площадью поверхности материала. Скорость, с которой растворяется твердое вещество, может зависеть от его кристалличности или ее отсутствия в случае аморфных твердых веществ, а также от площади поверхности (размера кристаллита) и наличия полиморфизма . Многие практические системы иллюстрируют этот эффект, например, при разработке методов контролируемой доставки лекарств . В некоторых случаях для установления равновесия растворимости может потребоваться много времени (часы, дни, месяцы или много лет; в зависимости от природы растворенного вещества и других факторов).
Скорость растворения часто можно выразить уравнением Нойеса–Уитни или уравнением Нернста и Бруннера [21] в виде:
где:
Для растворения, ограниченного диффузией (или массопереносом , если присутствует перемешивание), равна растворимости вещества. Когда скорость растворения чистого вещества нормализуется к площади поверхности твердого тела (которая обычно изменяется со временем в процессе растворения), то она выражается в кг/м 2 с и называется «собственной скоростью растворения». Собственная скорость растворения определяется Фармакопеей США .
Скорости растворения различаются на порядки величин в разных системах. Обычно очень низкие скорости растворения соответствуют низким растворимостям, а вещества с высокой растворимостью демонстрируют высокие скорости растворения, как предполагает уравнение Нойеса-Уитни.
Константы растворимости используются для описания насыщенных растворов ионных соединений с относительно низкой растворимостью (см. равновесие растворимости ). Константа растворимости является частным случаем константы равновесия . Поскольку она является произведением концентраций ионов в равновесии, ее также называют произведением растворимости . Она описывает баланс между растворенными ионами из соли и нерастворенной солью. Константа растворимости также «применима» (т. е. полезна) к осаждению , обратной реакции растворения. Как и в случае с другими константами равновесия, температура может влиять на численное значение константы растворимости. Хотя константа растворимости не так проста, как растворимость, значение этой константы, как правило, не зависит от присутствия других видов в растворителе.
Теория растворов Флори –Хаггинса — это теоретическая модель, описывающая растворимость полимеров. Параметры растворимости Хансена и параметры растворимости Гильдебранда — это эмпирические методы прогнозирования растворимости. Также возможно прогнозировать растворимость из других физических констант, таких как энтальпия плавления .
Коэффициент распределения октанол-вода , обычно выражаемый как его логарифм (Log P), является мерой дифференциальной растворимости соединения в гидрофобном растворителе ( 1-октанол ) и гидрофильном растворителе (вода). Логарифм этих двух значений позволяет ранжировать соединения по гидрофильности (или гидрофобности).
Изменение энергии, связанное с растворением, обычно выражается в расчете на моль растворенного вещества как энтальпия раствора .
Растворимость имеет фундаментальное значение во многих научных дисциплинах и практических приложениях: от переработки руд и ядерной переработки до использования лекарств и транспортировки загрязняющих веществ.
Растворимость часто называют одним из «характерных свойств вещества», что означает, что растворимость обычно используется для описания вещества, для указания полярности вещества, для того, чтобы помочь отличить его от других веществ, и как руководство по применению вещества. Например, индиго описывается как «нерастворимое в воде, спирте или эфире, но растворимое в хлороформе, нитробензоле или концентрированной серной кислоте ». [22]
Растворимость вещества полезна при разделении смесей. Например, смесь соли ( хлорида натрия ) и кремния можно разделить, растворив соль в воде и отфильтровав нерастворенный кремний. Синтез химических соединений, миллиграммами в лаборатории или тоннами в промышленности, использует относительную растворимость желаемого продукта, а также непрореагировавших исходных материалов, побочных продуктов и продуктов для достижения разделения.
Другим примером этого является синтез бензойной кислоты из фенилмагнийбромида и сухого льда . Бензойная кислота более растворима в органическом растворителе, таком как дихлорметан или диэтиловый эфир , и при встряхивании с этим органическим растворителем в делительной воронке преимущественно растворяется в органическом слое. Другие продукты реакции, включая бромид магния, останутся в водном слое, что ясно показывает, что достигается разделение на основе растворимости. Этот процесс, известный как экстракция жидкость-жидкость , является важным методом в синтетической химии . Рециркуляция используется для обеспечения максимальной экстракции.
В проточных системах различия в растворимости часто определяют транспорт видов, обусловленный растворением-осаждением. Это происходит, когда разные части системы находятся в разных условиях. Даже слегка отличающиеся условия могут привести к значительным эффектам, если пройти достаточно времени.
Например, соединения с относительно низкой растворимостью оказываются растворимыми в более экстремальных условиях, что приводит к геохимическим и геологическим эффектам активности гидротермальных жидкостей в земной коре. Они часто являются источником высококачественных месторождений полезных ископаемых и драгоценных или полудрагоценных камней. Таким же образом, соединения с низкой растворимостью будут растворяться в течение длительного времени (геологического времени), что приводит к значительным эффектам, таким как обширные пещерные системы или карстовые поверхности земли.
Некоторые ионные соединения ( соли ) растворяются в воде, что возникает из-за притяжения между положительными и отрицательными зарядами (см.: сольватация ). Например, положительные ионы соли (например, Ag + ) притягивают частично отрицательный атом кислорода в H 2 O. Аналогично, отрицательные ионы соли (например, Cl − ) притягивают частично положительный водород в H 2 O. Примечание: атом кислорода частично отрицателен, потому что он более электроотрицателен, чем водород, и наоборот (см.: химическая полярность ).
Однако существует предел того, сколько соли может быть растворено в данном объеме воды. Эта концентрация является растворимостью и связана с произведением растворимости , K sp . Эта константа равновесия зависит от типа соли ( например , AgCl или NaCl ), температуры и общего ионного эффекта.
Количество AgCl , которое растворится в 1 литре чистой воды, можно рассчитать следующим образом:
[Ag + ] = [Cl − ], в отсутствие других солей серебра или хлорида, поэтому
Результат: 1 литр воды может растворить 1,34 × 10−5 моль AgCl при комнатной температуре. По сравнению с другими солями AgCl плохо растворяется в воде. Например, поваренная соль ( NaCl ) имеет гораздо более высокий K sp = 36 и, следовательно, более растворима. В следующей таблице дан обзор правил растворимости для различных ионных соединений .
Принцип, изложенный выше в разделе о полярности, что подобное растворяется в подобном , является обычным руководством по растворимости в органических системах. Например, вазелин растворится в бензине, поскольку и вазелин, и бензин являются неполярными углеводородами. С другой стороны, он не растворится в этиловом спирте или воде, поскольку полярность этих растворителей слишком высока. Сахар не растворится в бензине, поскольку сахар слишком полярен по сравнению с бензином. Поэтому смесь бензина и сахара можно разделить фильтрацией или экстракцией водой .
Этот термин часто используется в области металлургии для обозначения степени, в которой легирующий элемент растворяется в основном металле без образования отдельной фазы . Линия (или кривая) сольвуса или растворимости — это линия (или линии) на фазовой диаграмме , которые задают пределы добавления растворенного вещества. То есть линии показывают максимальное количество компонента, которое может быть добавлено к другому компоненту и все еще находиться в твердом растворе . В кристаллической структуре твердого тела «растворенный» элемент может либо занимать место матрицы внутри решетки (замещающее положение; например, хром в железе), либо занимать место в пространстве между точками решетки (промежуточное положение; например, углерод в железе).
В микроэлектронном производстве растворимость в твердом состоянии означает максимальную концентрацию примесей, которую можно поместить в подложку.
В твердых соединениях (в отличие от элементов) растворимость растворенного элемента может также зависеть от фаз, разделяющихся в равновесии. Например, количество Sn, растворимого в фазе ZnSb, может существенно зависеть от того, являются ли фазы, разделяющиеся в равновесии, (Zn 4 Sb 3 +Sn(L)) или (ZnSnSb 2 +Sn(L)). [24] Помимо этого, соединение ZnSb с Sn в качестве растворенного вещества может разделяться на другие комбинации фаз после достижения предела растворимости в зависимости от начального химического состава во время синтеза. Каждая комбинация дает различную растворимость Sn в ZnSb. Следовательно, исследования растворимости в соединениях, заключенные на первом случае наблюдения за разделяющимися вторичными фазами, могут недооценивать растворимость. [25] В то время как максимальное число фаз, разделяющихся одновременно в равновесии, может быть определено правилом фаз Гиббса , для химических соединений нет ограничений на число таких комбинаций разделения фаз. Следовательно, установление «максимальной растворимости» в твердых соединениях экспериментально может быть сложным, требующим уравновешивания многих образцов. Если доминирующий кристаллографический дефект (в основном междоузельные или точечные дефекты замещения), вовлеченный в твердый раствор, может быть химически интуитивно понят заранее, то использование некоторых простых термодинамических рекомендаций может значительно сократить число образцов, необходимых для установления максимальной растворимости. [26]
Многие вещества растворяются конгруэнтно (т.е. состав твердого вещества и растворенного растворенного вещества стехиометрически совпадают). Однако некоторые вещества могут растворяться неконгруэнтно , в результате чего состав растворенного вещества в растворе не соответствует составу твердого вещества. Такая растворимость сопровождается изменением «первичного твердого вещества» и возможным образованием вторичной твердой фазы. Однако, в общем, некоторое первичное твердое вещество также остается и устанавливается сложное равновесие растворимости. Например, растворение альбита может привести к образованию гиббсита . [27]
В этом случае ожидается, что растворимость альбита будет зависеть от соотношения твердого вещества к растворителю. Этот вид растворимости имеет большое значение в геологии, где он приводит к образованию метаморфических пород .
В принципе, как конгруэнтное, так и инконгруэнтное растворение может привести к образованию вторичных твердых фаз в равновесии. Таким образом, в области материаловедения растворимость для обоих случаев описывается более обобщенно на фазовых диаграммах химического состава .
Растворимость является свойством, представляющим интерес во многих аспектах науки, включая, но не ограничиваясь: экологические прогнозы, биохимию, фармацевтику, разработку лекарств, агрохимическое проектирование и связывание белковых лигандов. Растворимость в воде представляет фундаментальный интерес из-за жизненно важных биологических и транспортных функций, которые играет вода. [28] [29] [30] В дополнение к этому явному научному интересу к растворимости в воде и эффекту растворителя; точные прогнозы растворимости важны в промышленности. Возможность точно предсказать растворимость молекулы представляет собой потенциально большую финансовую экономию во многих процессах разработки химических продуктов, таких как фармацевтика. [31] В фармацевтической промышленности прогнозы растворимости являются частью процесса оптимизации на ранней стадии кандидатов на лекарства. Растворимость остается проблемой вплоть до формулирования. [31] Для таких прогнозов был применен ряд методов, включая количественные соотношения структура-активность (QSAR), количественные соотношения структура-свойство (QSPR) и интеллектуальный анализ данных . Эти модели обеспечивают эффективные прогнозы растворимости и представляют собой текущий стандарт. Недостатком таких моделей является то, что им может не хватать физического понимания. Метод, основанный на физической теории, способный достичь подобных уровней точности при разумных затратах, был бы мощным инструментом в научном и промышленном плане. [32] [33] [34] [35]
Методы, основанные на физической теории, как правило, используют термодинамические циклы, концепцию из классической термодинамики . Два распространенных термодинамических цикла включают либо расчет свободной энергии сублимации (твердого тела в газообразное состояние без прохождения через жидкое состояние) и свободной энергии сольватации газообразной молекулы (газа в раствор), либо свободной энергии плавления (твердого тела в расплавленную фазу) и свободной энергии смешивания (расплавленного в раствор). Эти два процесса представлены на следующих диаграммах.


Эти циклы использовались для попыток предсказаний на основе первых принципов (решение с использованием фундаментальных физических уравнений) с использованием физически мотивированных моделей растворителей [33] для создания параметрических уравнений и моделей QSPR [36] [34] и их комбинаций. [34] Использование этих циклов позволяет вычислять свободную энергию сольватации косвенно либо через газ (в цикле сублимации), либо через расплав (цикл синтеза). Это полезно, поскольку вычислить свободную энергию сольватации напрямую чрезвычайно сложно. Свободную энергию сольватации можно преобразовать в значение растворимости с помощью различных формул, наиболее общий случай показан ниже, где числитель — свободная энергия сольватации, R — газовая постоянная , а T — температура в градусах Кельвина . [33]
Хорошо известные подобранные уравнения для прогнозирования растворимости — это общие уравнения растворимости. Эти уравнения берут начало в работе Ялковски и др . [37] [38] Первоначальная формула приведена первой, за ней следует пересмотренная формула, которая принимает другое предположение о полной смешиваемости в октаноле. [38]
Эти уравнения основаны на принципах термоядерного цикла.