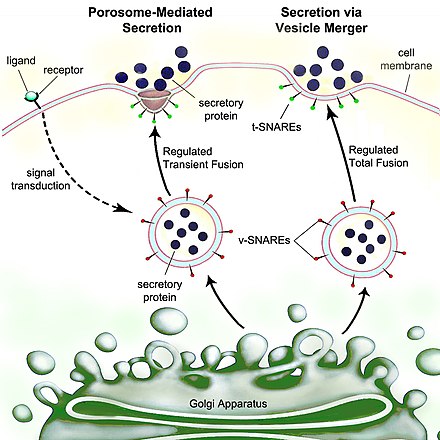
Секреция — это перемещение материала из одной точки в другую, например, секретируемого химического вещества из клетки или железы . Напротив, экскреция — это удаление определенных веществ или отходов из клетки или организма. Классический механизм секреции клетки осуществляется через секреторные порталы на плазматической мембране, называемые поросомами . [1] Поросомы — это постоянные чашеобразные липопротеиновые структуры, встроенные в клеточную мембрану, где секреторные пузырьки временно стыкуются и сливаются, чтобы высвободить внутрипузырьковое содержимое из клетки.
Секреция у видов бактерий означает транспорт или транслокацию эффекторных молекул. Например: белков , ферментов или токсинов (таких как холерный токсин у патогенных бактерий, например , Vibrio cholerae ) из внутренней части ( цитоплазмы или цитозоля ) бактериальной клетки наружу. Секреция является очень важным механизмом в функционировании бактерий и их работе в естественной окружающей среде для адаптации и выживания.

Эукариотические клетки , включая клетки человека , имеют высокоразвитый процесс секреции. Белки, предназначенные для внешней среды, синтезируются рибосомами , пристыкованными к шероховатой эндоплазматической сети (ЭР). По мере синтеза эти белки перемещаются в просвет ЭР , где они гликозилируются и где молекулярные шапероны помогают сворачиванию белков . Неправильно свернутые белки обычно идентифицируются здесь и ретротранслоцируются посредством ЭР-ассоциированной деградации в цитозоль , где они разрушаются протеасомой . Везикулы, содержащие правильно свернутые белки, затем попадают в аппарат Гольджи .
В аппарате Гольджи гликозилирование белков модифицируется, и могут происходить дальнейшие посттрансляционные модификации , включая расщепление и функционализацию. Затем белки перемещаются в секреторные пузырьки, которые перемещаются вдоль цитоскелета к краю клетки. Дополнительные модификации могут происходить в секреторных пузырьках (например, инсулин отщепляется от проинсулина в секреторных пузырьках).
В конце концов, происходит слияние везикул с клеточной мембраной в поросомах посредством процесса, называемого экзоцитозом , в результате чего их содержимое выбрасывается из среды клетки. [2]
Строгий биохимический контроль этой последовательности поддерживается с помощью градиента pH : pH цитозоля составляет 7,4, pH ЭР составляет 7,0, а pH цис-гольджи составляет 6,5. Секреторные везикулы имеют pH в диапазоне от 5,0 до 6,0; некоторые секреторные везикулы превращаются в лизосомы , которые имеют pH 4,8.
Существует много белков, таких как FGF1 (aFGF), FGF2 (bFGF), интерлейкин-1 (IL1) и т. д., которые не имеют сигнальной последовательности. Они не используют классический путь ER-Golgi. Они секретируются через различные неклассические пути.
Описано по крайней мере четыре неклассических (нетрадиционных) пути секреции белка. [3] Они включают в себя:
Кроме того, белки могут высвобождаться из клеток при механическом или физиологическом повреждении [4] и через нелетальные, транзиторные онкотические поры в плазматической мембране, образованные при промывании клеток бессывороточными средами или буферами. [5]
Многие типы клеток человека обладают способностью быть секреторными клетками. У них хорошо развит эндоплазматический ретикулум и аппарат Гольджи для выполнения этой функции. К тканям, которые вырабатывают секрецию, относятся желудочно-кишечный тракт , который выделяет пищеварительные ферменты и желудочную кислоту , легкие, которые выделяют поверхностно-активные вещества , и сальные железы , которые выделяют кожное сало для смазки кожи и волос. Мейбомиевы железы в веке выделяют мейбум для смазки и защиты глаза.
Секреция не является уникальной для эукариот – она также присутствует у бактерий и архей. Транспортеры типа АТФ-связывающей кассеты (ABC) являются общими для трех доменов жизни. Некоторые секретируемые белки транслоцируются через цитоплазматическую мембрану с помощью транслокона SecYEG , одной из двух систем транслокации, которая требует наличия N-концевого сигнального пептида на секретируемом белке. Другие транслоцируются через цитоплазматическую мембрану с помощью пути транслокации двойного аргинина (Tat). Грамотрицательные бактерии имеют две мембраны, что делает секрецию топологически более сложной. У грамотрицательных бактерий существует по крайней мере шесть специализированных систем секреции. [6]
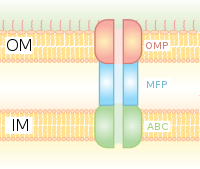
Секреция типа I — это система секреции, зависящая от шаперона, использующая кластеры генов Hly и Tol. Процесс начинается с того, что лидерная последовательность на секретируемом белке распознается HlyA и связывается с HlyB на мембране. Эта сигнальная последовательность чрезвычайно специфична для транспортера ABC. Комплекс HlyAB стимулирует HlyD, который начинает раскручиваться и достигает внешней мембраны, где TolC распознает терминальную молекулу или сигнал на HlyD. HlyD привлекает TolC к внутренней мембране, а HlyA выводится за пределы внешней мембраны через длинный туннельный белковый канал.
Система секреции типа I переносит различные молекулы, от ионов, лекарств до белков различных размеров (20–900 кДа). Молекулы, секретируемые в клетки, различаются по размеру от небольшого пептида Escherichia coli колицина V (10 кДа) до белка клеточной адгезии Pseudomonas fluorescens LapA массой 520 кДа. [7] Лучше всего охарактеризованы токсины RTX и липазы. Секреция типа I также участвует в экспорте небелковых субстратов, таких как циклические β-глюканы и полисахариды.

Белки, секретируемые через систему типа II, или главную конечную ветвь общего секреторного пути, зависят от системы Sec или Tat для первоначального транспорта в периплазму . Оказавшись там, они проходят через внешнюю мембрану через мультимерный (12–14 субъединиц) комплекс белков секретина, формирующих поры. В дополнение к белку секретина, 10–15 других внутренних и внешних мембранных белков составляют полный аппарат секреции, многие из которых имеют пока неизвестную функцию. Грамотрицательные пили типа IV используют модифицированную версию системы типа II для своего биогенеза, и в некоторых случаях определенные белки являются общими для комплекса пилей и системы типа II в пределах одного вида бактерий.
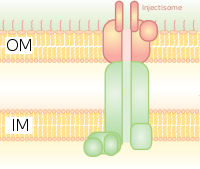
Он гомологичен базальному тельцу в бактериальных жгутиках. Он похож на молекулярный шприц, через который бактерия (например, некоторые типы Salmonella , Shigella , Yersinia , Vibrio ) может вводить белки в эукариотические клетки. Низкая концентрация Ca 2+ в цитозоле открывает ворота, которые регулируют T3SS. Один из таких механизмов обнаружения низкой концентрации кальция был проиллюстрирован антигеном lcrV (Low Calcium Response), используемым Yersinia pestis , который используется для обнаружения низких концентраций кальция и вызывает присоединение T3SS. Система Hrp в патогенах растений вводит гарпины и патогенные эффекторные белки через аналогичные механизмы в растения. Эта система секреции была впервые обнаружена в Yersinia pestis и показала, что токсины могут быть введены непосредственно из бактериальной цитоплазмы в цитоплазму клеток ее хозяина, а не просто секретироваться во внеклеточную среду. [8]
Он гомологичен конъюгативному аппарату бактерий, конъюгативным пилям . Он способен транспортировать как ДНК, так и белки. Он был обнаружен в Agrobacterium tumefaciens , который использует эту систему для введения части T-ДНК плазмиды Ti в растение-хозяина, что, в свою очередь, заставляет пораженную область развиваться в корончатый галл (опухоль). Helicobacter pylori использует систему секреции типа IV для доставки CagA в эпителиальные клетки желудка, что связано с канцерогенезом желудка. [9] Bordetella pertussis , возбудитель коклюша, выделяет токсин коклюша частично через систему типа IV. Legionella pneumophila , возбудитель легионеллеза (болезни легионеров), использует систему секреции типа IVB, известную как система icm/dot ( внутриклеточное размножение / дефект в генах органелльного трафика), для транслокации многочисленных эффекторных белков в своего эукариотического хозяина. [10] Прототипическая система секреции типа IVA представляет собой комплекс VirB Agrobacterium tumefaciens . [ 11 ]
Белки-члены этого семейства являются компонентами системы секреции типа IV. Они опосредуют внутриклеточный перенос макромолекул посредством механизма , родственного бактериальным конъюгационным аппаратам. [12] [13]
Система секреции типа IV (T4SS) является общим механизмом, посредством которого бактериальные клетки секретируют или поглощают макромолекулы. Их точный механизм остается неизвестным. T4SS кодируется в грамотрицательных конъюгативных элементах бактерий . T4SS представляют собой комплексы, охватывающие клеточную оболочку, или, другими словами, 11–13 основных белков, которые образуют канал, по которому ДНК и белки могут перемещаться из цитоплазмы донорской клетки в цитоплазму реципиентной клетки. T4SS также секретируют белки факторов вирулентности непосредственно в клетки-хозяева, а также поглощают ДНК из среды во время естественной трансформации . [14]
Как показано на рисунке выше, TraC, в частности, состоит из трехспирального пучка и свободного шаровидного отростка. [13]
T4SS имеет два эффекторных белка: во-первых, ATS-1, что означает транслоцированный субстрат 1 Anaplasma, и, во-вторых, AnkA , что означает белок A, содержащий домен повтора анкирина. Кроме того, связывающие белки T4SS — это VirD4, который связывается с VirE2. [15]
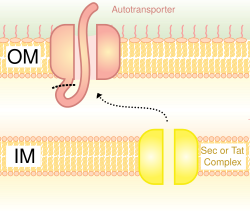
Также называемая системой аутотранспортера, [16] секреция типа V включает использование системы Sec для пересечения внутренней мембраны. Белки, которые используют этот путь, обладают способностью образовывать бета-бочку со своим C-концом, который вставляется во внешнюю мембрану, позволяя остальной части пептида (пассажирскому домену) достигать внешней стороны клетки. Часто аутотранспортеры расщепляются, оставляя домен бета-бочки во внешней мембране и освобождая пассажирский домен. Некоторые исследователи полагают, что остатки аутотранспортеров дали начало поринам, которые образуют похожие структуры бета-бочки. [ необходима цитата ] Распространенным примером аутотранспортера, который использует эту систему секреции, являются тримерные аутотранспортерные адгезины . [17]
Системы секреции типа VI были первоначально идентифицированы в 2006 году группой Джона Мекаланоса в Гарвардской медицинской школе (Бостон, США) у двух бактериальных патогенов, Vibrio cholerae и Pseudomonas aeruginosa . [18] [19] Они были идентифицированы, когда мутации в генах Hcp и VrgG у Vibrio cholerae привели к снижению вирулентности и патогенности. С тех пор системы секреции типа VI были обнаружены в четверти всех протеобактериальных геномов, включая животных, растения, патогены человека, а также почвенные, экологические или морские бактерии. [20] [21] В то время как большинство ранних исследований секреции типа VI были сосредоточены на ее роли в патогенезе высших организмов, более поздние исследования предположили более широкую физиологическую роль в защите от простых эукариотических хищников и ее роль во взаимодействиях между бактериями. [22] [23] Генные кластеры системы секреции типа VI содержат от 15 до более чем 20 генов, два из которых, Hcp и VgrG, как было показано, являются почти универсальными секретируемыми субстратами системы. Структурный анализ этих и других белков в этой системе имеет поразительное сходство с хвостовым шипом фага T4, и активность системы, как полагают, функционально напоминает фаговую инфекцию. [24]
В дополнение к использованию мультипротеиновых комплексов, перечисленных выше, грамотрицательные бактерии обладают другим методом высвобождения материала: образованием бактериальных везикул внешней мембраны . [25] Части внешней мембраны отщепляются, образуя наномасштабные сферические структуры, состоящие из липополисахаридного липидного бислоя, окружающего периплазматические материалы, и используются для перемещения мембранных везикул с целью манипулирования окружающей средой или вторжения в интерфейс хозяин-патоген . Было обнаружено, что везикулы из ряда видов бактерий содержат факторы вирулентности, некоторые обладают иммуномодулирующим действием, а некоторые могут напрямую прилипать к клеткам хозяина и отравлять их. Было продемонстрировано, что высвобождение везикул является общей реакцией на стрессовые условия, процесс загрузки грузовых белков, по-видимому, является избирательным. [26]
У некоторых видов стафилококков и стрептококков дополнительная секреторная система управляет экспортом высокоповторяющихся адгезионных гликопротеинов.
[27]