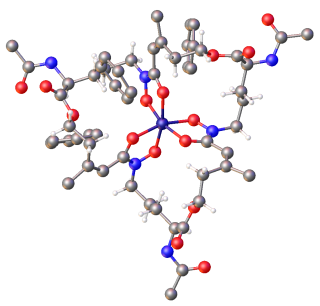
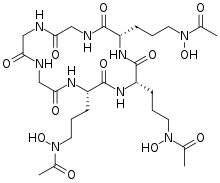
Сидерофоры (греч.: «носитель железа») — это небольшие, высокоаффинные железо - хелатирующие соединения, которые выделяются микроорганизмами, такими как бактерии и грибы. Они помогают организму накапливать железо. [2] [3] [4] [5] Хотя в настоящее время оценивается все более широкий спектр функций сидерофоров, [6] сидерофоры являются одними из самых сильных (с наивысшим сродством) известных агентов связывания Fe 3+ . Фитосидерофоры — это сидерофоры, вырабатываемые растениями.
Несмотря на то, что железо является одним из самых распространенных элементов в земной коре, оно не является легко биодоступным. В большинстве аэробных сред, таких как почва или море, железо существует в трехвалентном состоянии (Fe 3+ ), которое имеет тенденцию образовывать нерастворимые ржавоподобные твердые вещества. Чтобы быть эффективными, питательные вещества должны быть не только доступными, но и растворимыми. [7] Микробы выделяют сидерофоры для извлечения железа из этих минеральных фаз путем образования растворимых комплексов Fe 3+ , которые могут быть поглощены активными транспортными механизмами. Многие сидерофоры являются нерибосомальными пептидами , [3] [8] хотя некоторые биосинтезируются независимо. [9]
Сидерофоры также важны для некоторых патогенных бактерий для получения ими железа. [3] [4] [10] У млекопитающих-хозяев железо тесно связано с белками, такими как гемоглобин , трансферрин , лактоферрин и ферритин . Строгий гомеостаз железа приводит к свободной концентрации около 10−24 моль л −1 , [11] следовательно, на патогенные бактерии оказывается большое эволюционное давление, чтобы получить этот металл. Например, возбудитель сибирской язвы Bacillus anthracis выделяет два сидерофора, бациллибактин и петробактин , для извлечения иона железа из железосодержащих белков. В то время как бациллибактин, как было показано, связывается с белком иммунной системы сидерокалином , [12] предполагается, что петробактин уклоняется от иммунной системы и, как было показано, важен для вирулентности у мышей. [13]
Сидерофоры являются одними из самых сильных известных связывателей Fe3 + , причем энтеробактин является одним из самых сильных из них. [11] Благодаря этому свойству они привлекли внимание медицинской науки к терапии хелатирования металлов , при этом сидерофор десферриоксамин B получил широкое распространение в лечении отравления железом и талассемии . [14]
Помимо сидерофоров, некоторые патогенные бактерии продуцируют гемофоры ( гемсвязывающие белки, очищающие клетки ) или имеют рецепторы, которые напрямую связываются с железо/гемовыми белками. [ 15] У эукариот другими стратегиями повышения растворимости и поглощения железа являются подкисление окружающей среды (например, используемое корнями растений) или внеклеточное восстановление Fe 3+ до более растворимых ионов Fe 2+ .
Сидерофоры обычно образуют стабильный, гексадентатный , октаэдрический комплекс преимущественно с Fe3 + по сравнению с другими естественными распространенными ионами металлов, хотя, если имеется менее шести донорных атомов, вода также может координироваться. Наиболее эффективными сидерофорами являются те, которые имеют три бидентатных лиганда на молекулу, образуя гексадентатный комплекс и вызывая меньшее энтропийное изменение, чем вызванное хелатированием одного иона трехвалентного железа с отдельными лигандами. [16] Fe3 + является сильной кислотой Льюиса , предпочитающей сильные основания Льюиса, такие как анионные или нейтральные атомы кислорода, для координации. Микробы обычно высвобождают железо из сидерофора путем восстановления до Fe2 +, который имеет малое сродство к этим лигандам. [8] [2]
Сидерофоры обычно классифицируются по лигандам, используемым для хелатирования трехвалентного железа. Основные группы сидерофоров включают катехолаты ( феноляты), гидроксаматы и карбоксилаты (например, производные лимонной кислоты ). [3] Лимонная кислота также может действовать как сидерофор. [17] Большое разнообразие сидерофоров может быть обусловлено эволюционным давлением, оказываемым на микробы с целью создания структурно различных сидерофоров, которые не могут транспортироваться специфическими активными транспортными системами других микробов, или в случае патогенов, дезактивированных организмом-хозяином. [3] [10]
Примеры сидерофоров, продуцируемых различными бактериями и грибами :





Гидроксаматные сидерофоры
Катехолатные сидерофоры
Смешанные лиганды
Аминокарбоксилатные лиганды
Полный список структур сидерофоров (более 250) представлен в Приложении 1 в справочном материале. [3]
В ответ на ограничение железа в их среде гены, участвующие в производстве и поглощении микробных сидерофоров, депрессируются , что приводит к производству сидерофоров и соответствующих белков поглощения. У бактерий Fe 2+ -зависимые репрессоры связываются с ДНК выше генов, участвующих в производстве сидерофоров при высоких внутриклеточных концентрациях железа. При низких концентрациях Fe 2+ диссоциирует от репрессора, который, в свою очередь, диссоциирует от ДНК, что приводит к транскрипции генов. У грамотрицательных и богатых AT грамположительных бактерий это обычно регулируется репрессором Fur (регулятор поглощения железа), тогда как у богатых GC грамположительных бактерий (например, Actinomycetota ) это DtxR (репрессор дифтерийного токсина), так называемый, поскольку продукция опасного дифтерийного токсина Corynebacterium diphtheriae также регулируется этой системой. [8]
За этим следует выделение сидерофора во внеклеточную среду, где сидерофор действует, чтобы изолировать и растворить железо. [3] [18] [19] [20] Затем сидерофоры распознаются рецепторами, специфичными для клеток, на внешней мембране клетки. [2] [3] [21] У грибов и других эукариот комплекс Fe-сидерофор может быть восстановлен внеклеточно до Fe2 + , в то время как во многих случаях весь комплекс Fe-сидерофор активно транспортируется через клеточную мембрану. У грамотрицательных бактерий они транспортируются в периплазму через рецепторы, зависимые от TonB , и переносятся в цитоплазму транспортерами ABC . [3] [8] [16] [22]
Попав в цитоплазму клетки, комплекс Fe3 + -сидерофор обычно восстанавливается до Fe2 +, чтобы высвободить железо, особенно в случае «слабых» лигандов сидерофора, таких как гидроксаматы и карбоксилаты. Разложение сидерофора или другие биологические механизмы также могут высвобождать железо, [16] особенно в случае катехолатов, таких как феррик-энтеробактин, восстановительный потенциал которого слишком низок для восстанавливающих агентов, таких как флавинадениндинуклеотид , поэтому для высвобождения железа необходима ферментативная деградация. [11]

Хотя в большинстве почв достаточно железа для роста растений, дефицит железа у растений является проблемой в известковой почве из-за низкой растворимости гидроксида железа (III) . Известковая почва составляет 30% сельскохозяйственных угодий мира. В таких условиях злаковые растения (травы, злаки и рис) выделяют фитосидерофоры в почву, [23] типичным примером является дезоксимугиновая кислота. Фитосидерофоры имеют другую структуру, чем грибковые и бактериальные сидерофоры, имеющие два центра связывания α-аминокарбоксилата вместе с одним α-гидроксикарбоксилатным звеном. Эта последняя бидентатная функция обеспечивает фитосидерофорам высокую селективность к железу (III). При выращивании в почве с дефицитом железа корни злаковых растений выделяют сидерофоры в ризосферу. При поглощении железа (III) комплекс железа и фитосидерофора транспортируется через цитоплазматическую мембрану с использованием механизма симпорта протонов . [24] Затем комплекс железа (III) восстанавливается до железа (II), а железо переносится в никотианамина , который, хотя и очень похож на фитосидерофоры, является селективным для железа (II) и не секретируется корнями. [25] Никотианамина переносит железо из флоэмы во все части растения.
Железо является важным питательным веществом для бактерии Pseudomonas aeruginosa , однако железо не так легкодоступно в окружающей среде. Чтобы преодолеть эту проблему, P. aeruginosa производит сидерофоры для связывания и транспортировки железа. [26] Но бактерия, которая произвела сидерофоры, не обязательно получает прямую выгоду от потребления железа. Скорее, все члены клеточной популяции с одинаковой вероятностью получат доступ к комплексам железо-сидерофор. Производство сидерофоров также требует от бактерии расходования энергии. Таким образом, производство сидерофоров можно рассматривать как альтруистическую черту, поскольку это выгодно для локальной группы, но дорого для индивидуума. Эта альтруистическая динамика требует, чтобы каждый член клеточной популяции в равной степени вносил вклад в производство сидерофоров. Но иногда могут происходить мутации, которые приводят к тому, что некоторые бактерии производят меньшее количество сидерофоров. Эти мутации дают эволюционное преимущество, поскольку бактерия может получать выгоду от производства сидерофоров, не страдая от энергетических затрат. Таким образом, больше энергии может быть выделено на рост. Члены клеточной популяции, которые могут эффективно производить эти сидерофоры, обычно называются кооператорами; члены, которые производят мало или совсем не производят сидерофоры, часто называются обманщиками. [27] Исследования показали, что когда кооператоры и обманщики выращиваются вместе, у кооператоров снижается приспособленность, а у обманщиков повышается. Замечено, что величина изменения приспособленности увеличивается с увеличением ограничения железа. [28] С увеличением приспособленности обманщики могут превзойти кооператоров; это приводит к общему снижению приспособленности группы из-за отсутствия достаточного производства сидерофоров.
В недавнем исследовании [29] было изучено производство пиовердина (PVD), типа сидерофора, в бактерии Pseudomonas aeruginosa . Это исследование было сосредоточено на построении, моделировании и динамическом моделировании биосинтеза PVD, [30] фактора вирулентности, посредством системного подхода. Этот подход предполагает, что метаболический путь синтеза PVD регулируется феноменом кворум-сенсорики (QS), клеточной коммуникационной системы, которая позволяет бактериям координировать свое поведение на основе плотности их популяции.
Исследование показало, что по мере увеличения роста бактерий увеличивается и внеклеточная концентрация сигнальных молекул QS , тем самым имитируя естественное поведение P. aeruginosa PAO1. Для проведения этого исследования была построена модель метаболической сети P. aeruginosa на основе модели iMO1056, геномной аннотации штамма P. aeruginosa PAO1 и метаболического пути синтеза PVD. Эта модель включала синтез PVD, транспортные реакции, обмен и сигнальные молекулы QS.
Полученная модель, названная CCBM1146, [31] показала, что явление QS напрямую влияет на метаболизм P. aeruginosa в направлении биосинтеза PVD в зависимости от изменения интенсивности сигнала QS. Эта работа является первым отчетом in silico об интегративной модели, которая включает в себя регуляторную сеть гена QS и метаболическую сеть P. aeruginosa, предоставляя подробное представление о том, как на продукцию пиовердина и сидерофоров в Pseudomonas aeruginosa влияет явление кворум-сенсинга
Более того, интратуморальная P. aeruginosa может поглощать железо, вырабатывая пиовердин, который косвенно защищает опухолевые клетки от ферроптоза («смерти железа»), что подчеркивает необходимость индукторов ферроптоза (тиострептона) для лечения рака. [32]
Сидерофоры становятся важными в экологической нише, определяемой низкой доступностью железа, поскольку железо является одним из критических факторов, ограничивающих рост практически всех аэробных микроорганизмов. Существует четыре основных экологических среды обитания: почва и поверхностные воды, морская вода, растительная ткань (патогены) и животная ткань (патогены).
Почва является богатым источником бактериальных и грибковых родов. Распространенными грамположительными видами являются те, которые принадлежат к Actinomycetales и видам родов Bacillus , Arthrobacter и Nocardia . Многие из этих организмов производят и секретируют ферриоксамины, которые приводят к стимуляции роста не только продуцирующих организмов, но и других микробных популяций, которые способны использовать экзогенные сидерофоры. Почвенные грибы, включая Aspergillus и Penicillium, в основном производят феррихромы. Эта группа сидерофоров состоит из циклических гексапептидов и, следовательно, обладает высокой устойчивостью к деградации окружающей среды, связанной с широким спектром гидролитических ферментов, которые присутствуют в гуминовой почве. [33] Почвы, содержащие разлагающийся растительный материал, имеют значения pH всего лишь 3–4. В таких условиях организмы, которые производят гидроксаматные сидерофоры, имеют преимущество из-за чрезвычайной кислотной стабильности этих молекул. Микробная популяция пресной воды похожа на популяцию почвы, действительно, многие бактерии вымываются из почвы. Кроме того, пресноводные озера содержат большие популяции видов Pseudomonas , Azomonas , Aeromonas и Alcaligenes . [34] Поскольку сидерофоры выделяются в окружающую среду, сидерофоры могут быть обнаружены бактериоядными хищниками, включая Caenorhabditis elegans , что приводит к миграции нематод к бактериальной добыче. [35]
В отличие от большинства пресноводных источников, уровни железа в поверхностной морской воде чрезвычайно низки (от 1 нМ до 1 мкМ в верхних 200 м) и намного ниже, чем у V, Cr, Co, Ni, Cu и Zn. Практически все это железо находится в состоянии железа (III) и связано с органическими лигандами. [36] Эти низкие уровни железа ограничивают первичное производство фитопланктона и привели к гипотезе железа [37] , в которой предполагалось, что приток железа будет способствовать росту фитопланктона и тем самым уменьшать содержание CO2 в атмосфере . Эта гипотеза была проверена более чем в 10 различных случаях, и во всех случаях наблюдалось массовое цветение. Однако цветение сохранялось в течение различных периодов времени. Интересное наблюдение, сделанное в некоторых из этих исследований, состояло в том, что концентрация органических лигандов увеличивалась в течение короткого промежутка времени, чтобы соответствовать концентрации добавленного железа, что подразумевает биологическое происхождение и, учитывая их сродство к железу, возможно, сидерофорную или сидерофороподобную природу. [38] Примечательно, что гетеротрофные бактерии также заметно увеличивали свою численность в вызванном железом цветении. Таким образом, существует элемент синергизма между фитопланктоном и гетеротрофными бактериями. Фитопланктону требуется железо (предоставляемое бактериальными сидерофорами), а гетеротрофным бактериям требуются источники углерода, отличные от CO 2 (предоставляемые фитопланктоном).
Разбавленная природа пелагической морской среды способствует большим диффузионным потерям и делает эффективность обычных стратегий поглощения железа на основе сидерофоров проблематичной. Однако многие гетеротрофные морские бактерии производят сидерофоры, хотя и со свойствами, отличными от свойств, производимых наземными организмами. Многие морские сидерофоры являются поверхностно-активными и имеют тенденцию образовывать молекулярные агрегаты, например, аквахелины. Наличие жирной ацильной цепи придает молекулам высокую поверхностную активность и способность образовывать мицеллы . [39] Таким образом, при секреции эти молекулы связываются с поверхностями и друг с другом, тем самым замедляя скорость диффузии от секретирующего организма и поддерживая относительно высокую локальную концентрацию сидерофоров. Фитопланктон имеет высокие потребности в железе, и все же большинство (а возможно, и все) не производят сидерофоры. Однако фитопланктон может получать железо из комплексов сидерофоров с помощью мембраносвязанных редуктаз [40] и, конечно, из железа(II), образующегося посредством фотохимического разложения сидерофоров железа(III). Таким образом, большая часть железа (возможно, все железо), поглощаемого фитопланктоном, зависит от производства бактериальных сидерофоров. [41]


Большинство фитопатогенов проникают в апоплазму, выделяя пектолитические ферменты, которые способствуют распространению вторгающегося организма. Бактерии часто заражают растения, проникая в ткань через устьица . Попав в растение, они распространяются и размножаются в межклеточных пространствах. При бактериальных сосудистых заболеваниях инфекция распространяется внутри растений через ксилему .
Попав в растение, бактерии должны иметь возможность извлекать железо из двух основных лигандов, транспортирующих железо, никотинамина и цитрата. [42] Для этого они производят сидерофоры, таким образом, энтеробактерия Erwinia chrysanthemi производит два сидерофора, хризобактин и ахромобактин. [43] Группа фитопатогенов Xanthomonas производит сидерофоры ксантоферрина для извлечения железа. [44]
Как и у людей, у растений также есть белки, связывающие сидерофоры, которые участвуют в защите хозяина, например, основной аллерген пыльцы березы Bet v 1 , которые обычно секретируются и обладают структурой, подобной липокалину . [41]
Патогенные бактерии и грибки выработали средства выживания в тканях животных. Они могут проникать в желудочно-кишечный тракт ( Escherichia , Shigella и Salmonella ), легкие ( Pseudomonas , Bordetella , Streptococcus и Corynebacterium ), кожу ( Staphylococcus ) или мочевыводящие пути ( Escherichia и Pseudomonas ). Такие бактерии могут колонизировать раны ( Vibrio и Staphylococcus ) и вызывать септицемию ( Yersinia и Bacillus ). Некоторые бактерии выживают в течение длительного времени во внутриклеточных органеллах, например, Mycobacterium (см. таблицу). Из-за этого постоянного риска бактериальной и грибковой инвазии животные выработали ряд линий защиты, основанных на иммунологических стратегиях, системе комплемента, выработке железо-сидерофор-связывающих белков и общем «выводе» железа. [45]
У большинства животных присутствуют два основных типа связывающих железо белков, которые обеспечивают защиту от микробного вторжения: внеклеточная защита достигается семейством белков трансферрина, а внутриклеточная защита достигается ферритином. Трансферрин присутствует в сыворотке в концентрации приблизительно 30 мкМ и содержит два участка связывания железа, каждый из которых имеет чрезвычайно высокое сродство к железу. В нормальных условиях он насыщен примерно на 25–40%, что означает, что любое свободно доступное железо в сыворотке будет немедленно утилизировано, тем самым предотвращая рост микробов. Большинство сидерофоров не способны удалять железо из трансферрина. Млекопитающие также вырабатывают лактоферрин, который похож на сывороточный трансферрин, но обладает еще более высоким сродством к железу. [46] Лактоферрин присутствует в секреторных жидкостях, таких как пот, слезы и молоко, тем самым сводя к минимуму бактериальную инфекцию.
Ферритин присутствует в цитоплазме клеток и ограничивает внутриклеточный уровень железа примерно до 1 мкМ. Ферритин — гораздо более крупный белок, чем трансферрин, и способен связывать несколько тысяч атомов железа в нетоксичной форме. Сидерофоры не способны напрямую мобилизовать железо из ферритина.
В дополнение к этим двум классам железосвязывающих белков, гормон гепсидин участвует в контроле высвобождения железа из абсорбирующих энтероцитов, гепатоцитов, запасающих железо, и макрофагов. [47] Инфекция приводит к воспалению и высвобождению интерлейкина-6 (ИЛ-6), который стимулирует экспрессию гепсидина. У людей продукция ИЛ-6 приводит к низкому уровню сывороточного железа, что затрудняет заражение вторгающимися патогенами. Было показано, что такое истощение железа ограничивает рост бактерий как во внеклеточных, так и во внутриклеточных местах. [45]
В дополнение к тактике «изъятия железа» млекопитающие вырабатывают связывающий железо-сидерофор белок, сидерохелин. Сидерохелин является членом семейства белков липокалина, которые, хотя и разнообразны по последовательности, демонстрируют высококонсервативную структурную складку, 8-цепочечный антипараллельный β-цилиндр, который образует сайт связывания с несколькими соседними β-нитями. Сидерокалин (липокалин 2) имеет 3 положительно заряженных остатка, также расположенных в гидрофобном кармане, и они создают сайт связывания с высоким сродством для железа (III)-энтеробактина. [11] Сидерокалин является мощным бактериостатическим средством против E. coli . В результате инфекции он секретируется как макрофагами, так и гепатоцитами, энтеробактин удаляется из внеклеточного пространства.
Сидерофоры применяются в медицине для терапии перегрузки железом и алюминием, а также в антибиотиках для улучшения нацеливания. [10] [48] [3] Понимание механистических путей сидерофоров открыло возможности для разработки низкомолекулярных ингибиторов, которые блокируют биосинтез сидерофоров и, следовательно, рост и вирулентность бактерий в средах с ограниченным содержанием железа. [49] [50]
Сидерофоры полезны в качестве лекарств для облегчения мобилизации железа у людей, особенно при лечении заболеваний, связанных с железом, из-за их высокого сродства к железу. Одним из потенциально мощных приложений является использование способности сидерофоров переносить железо для переноса лекарств в клетки путем приготовления конъюгатов между сидерофорами и антимикробными агентами. Поскольку микробы распознают и используют только определенные сидерофоры, ожидается, что такие конъюгаты будут иметь селективную антимикробную активность. [10] [16] Примером является цефалоспориновый антибиотик цефидерокол . [51]
Доставка лекарств, опосредованная микробным транспортом железа (сидерофором), использует распознавание сидерофоров как агентов доставки железа, чтобы микроб ассимилировал конъюгаты сидерофора с прикрепленными лекарствами. Эти лекарства смертельны для микроба и вызывают апоптоз микроба, когда он ассимилирует конъюгат сидерофора. [10] Благодаря добавлению железосвязывающих функциональных групп сидерофоров в антибиотики их эффективность значительно возросла. Это связано с системой поглощения железа бактериями, опосредованной сидерофором.
Poaceae (злаки), включая сельскохозяйственно важные виды, такие как ячмень и пшеница , способны эффективно секвестрировать железо, выделяя фитосидерофоры через свои корни в окружающую почвенную ризосферу . [18] Химические соединения, вырабатываемые микроорганизмами в ризосфере, также могут увеличивать доступность и усвоение железа. Такие растения, как овес, способны усваивать железо через эти микробные сидерофоры. Было показано, что растения способны использовать сидерофоры гидроксаматного типа феррихром, родоторуловую кислоту и ферриоксамин B; сидерофоры катехольного типа, агробактин; и сидерофоры смешанного лиганда катехол-гидроксамат-гидроксикислота, биосинтезированные сапрофитными бактериями, колонизирующими корни. Все эти соединения вырабатываются штаммами ризосферных бактерий, которые имеют простые потребности в питании и встречаются в природе в почвах, листве, пресной воде, отложениях и морской воде. [52]
Флуоресцентные псевдомонады были признаны агентами биологического контроля против некоторых патогенов растений, передающихся через почву. Они производят желто-зеленые пигменты ( пиовердины ), которые флуоресцируют под УФ-светом и функционируют как сидерофоры. Они лишают патогены железа, необходимого для их роста и патогенеза. [53]
Сидерофоры, природные или синтетические, могут хелатировать ионы металлов, отличные от ионов железа. Примерами являются алюминий , [2] [21] [52] [54] галлий , [2] [21] [52] [54] хром , [21] [52] медь , [21] [52] [54] цинк , [21] [54] свинец , [21] марганец , [21] кадмий , [21] ванадий , [21] цирконий , [55] индий , [21] [54] плутоний , [56] берклий , калифорний , [57] и уран . [56]
Альтернативными способами усвоения железа являются поверхностное восстановление, снижение pH, использование гема или извлечение металла, связанного с белком. [2] Последние данные свидетельствуют о том, что молекулы, хелатирующие железо, со свойствами, аналогичными сидерофорам, были произведены морскими бактериями в условиях ограничения роста фосфатом. В природе фосфат связывается с различными типами минералов железа, и поэтому была выдвинута гипотеза, что бактерии могут использовать молекулы, подобные сидерофорам, для растворения такого комплекса с целью доступа к фосфату. [58]
{{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite book}}: |journal=проигнорировано ( помощь )