Стронций — химический элемент ; он имеет символ Sr и атомный номер 38. Щелочноземельный металл стронций представляет собой мягкий серебристо-белый желтоватый металлический элемент, обладающий высокой химической активностью . Металл образует темный оксидный слой при контакте с воздухом. Стронций имеет физические и химические свойства, аналогичные свойствам двух его вертикальных соседей в таблице Менделеева, кальция и бария . В природе он встречается в основном в минералах целестин и стронцианит и в основном добывается из них.
И стронций, и стронцианит названы в честь Стронциана , деревни в Шотландии, возле которой минерал был обнаружен в 1790 году Адэром Кроуфордом и Уильямом Крукшенком ; В следующем году он был идентифицирован как новый элемент по его малиново-красному цвету при испытании в пламени . Стронций был впервые выделен в виде металла в 1808 году Хамфри Дэви с использованием недавно открытого процесса электролиза . В 19 веке стронций в основном использовался при производстве сахара из сахарной свеклы (см. Стронциановый процесс ). На пике производства телевизионных электронно-лучевых трубок до 75% потребления стронция в США использовалось для изготовления стекла лицевой панели. [9] С заменой электронно-лучевых трубок другими методами отображения потребление стронция резко сократилось. [9]
В то время как природный стронций (который в основном представляет собой изотоп стронций-88) стабилен, синтетический стронций-90 радиоактивен и является одним из наиболее опасных компонентов ядерных осадков , поскольку стронций усваивается организмом аналогично кальцию. С другой стороны, природный стабильный стронций не опасен для здоровья.

Стронций — двухвалентный серебристый металл с бледно-желтым оттенком, свойства которого в основном промежуточные между кальцием и барием и сходны со свойствами его соседей по группе . [10] Он мягче кальция и тверже бария. Его температуры плавления (777 °С) и кипения (1377 °С) ниже, чем у кальция (842 °С и 1484 °С соответственно); барий продолжает эту тенденцию к снижению температуры плавления (727 °C), но не точки кипения (1900 °C). Плотность стронция (2,64 г/см 3 ) также занимает промежуточное положение между плотностью кальция (1,54 г/см 3 ) и бария (3,594 г/см 3 ). [11] Существуют три аллотропа металлического стронция с точками перехода при 235 и 540 °C. [ нужна цитата ]
Стандартный электродный потенциал для пары Sr 2+ /Sr составляет -2,89 В, что примерно посередине между потенциалами пар Ca 2+ /Ca (-2,84 В) и Ba 2+ /Ba (-2,92 В) и близко к потенциалу соседних щелочных металлов . [12] Стронций занимает промежуточное положение между кальцием и барием по своей реакционной способности по отношению к воде, с которой он реагирует при контакте с образованием гидроксида стронция и газообразного водорода. Металлический стронций сгорает на воздухе с образованием как оксида стронция , так и нитрида стронция , но поскольку он не реагирует с азотом при температуре ниже 380 ° C, при комнатной температуре он самопроизвольно образует только оксид. [11] Помимо простого оксида SrO, пероксид SrO 2 может быть получен путем прямого окисления металлического стронция под высоким давлением кислорода, и есть некоторые свидетельства существования желтого супероксида Sr(O 2 ) 2 . [13] Гидроксид стронция , Sr(OH) 2 , является сильным основанием, хотя и не таким сильным, как гидроксиды бария или щелочных металлов. [14] Известны все четыре дигалогенида стронция. [15]
Из-за большого размера тяжелых элементов s-блока , включая стронций, известен широкий диапазон координационных чисел : от 2, 3 или 4 до 22 или 24 в SrCd 11 и SrZn 13 . Ион Sr 2+ довольно велик, поэтому, как правило, высокие координационные числа. [16] Большой размер стронция и бария играет значительную роль в стабилизации комплексов стронция с полидентатными макроциклическими лигандами, такими как краун-эфиры : например, в то время как 18-краун-6 образует относительно слабые комплексы с кальцием и щелочными металлами, его стронций и комплексы бария гораздо прочнее. [17]
Стронциевые соединения содержат одну или несколько связей стронций-углерод. Сообщалось, что они являются промежуточными продуктами реакций типа Барбье . [18] [19] [20] Хотя стронций относится к той же группе, что и магний, а магнийорганические соединения очень часто используются в химии, стронцийорганические соединения не так широко распространены, поскольку их труднее получить и они более реакционноспособны. Стронцийорганические соединения имеют тенденцию быть более похожими на органо- европий или органо- самарий из-за схожих ионных радиусов этих элементов (Sr 2+ 118 пм; Eu 2+ 117 пм; Sm 2+ 122 пм). Большинство этих соединений можно получить только при низких температурах; объемистые лиганды имеют тенденцию способствовать стабильности. Например, дициклопентадиенил стронция , Sr(C 5 H 5 ) 2 , должен быть получен путем прямой реакции металлического стронция с меркуоценом или самим циклопентадиеном ; замена лиганда C 5 H 5 более объемистым лигандом C 5 (CH 3 ) 5, с другой стороны, увеличивает растворимость, летучесть и кинетическую стабильность соединения. [21]
Из-за своей чрезвычайной реакционной способности с кислородом и водой стронций встречается в природе только в соединениях с другими элементами, например, в минералах стронцианите и целестине . Его хранят в жидком углеводороде , таком как минеральное масло или керосин , чтобы предотвратить окисление ; Свежеобнаруженный металлический стронций быстро приобретает желтоватый цвет с образованием оксида. Мелко измельченный металлический стронций пирофорен , что означает, что он самопроизвольно воспламеняется на воздухе при комнатной температуре. Летучие соли стронция придают пламени ярко-красный цвет и используются в пиротехнике и при производстве сигнальных ракет . [11] Подобно кальцию и барию, а также щелочным металлам и двухвалентным лантанидам европию и иттербию , металлический стронций растворяется непосредственно в жидком аммиаке , образуя темно-синий раствор сольватированных электронов. [10]
Природный стронций представляет собой смесь четырех стабильных изотопов : 84 Sr, 86 Sr, 87 Sr и 88 Sr. [11] Среди этих изотопов 88 Sr является наиболее распространенным, составляет около 82,6% всего природного стронция, хотя содержание варьируется из-за образования радиогенного 87 Sr как дочернего элемента долгоживущего бета-распадающегося 87 Rb . [22] Это является основой рубидий-стронциевого датирования . Из нестабильных изотопов основным способом распада изотопов легче 85 Sr является захват электронов или эмиссия позитронов на изотопы рубидия, а для изотопов тяжелее 88 Sr — эмиссия электронов на изотопы иттрия . Особо следует отметить 89 Sr и 90 Sr. Первый имеет период полураспада 50,6 дней и используется для лечения рака костей из-за химического сходства стронция и, следовательно, способности заменять кальций. [23] [24] Хотя 90 Sr (период полураспада 28,90 лет) использовался аналогичным образом, он также является изотопом, вызывающим озабоченность при выпадении ядерного оружия и ядерных авариях из-за его производства в качестве продукта деления . Его присутствие в костях может вызвать рак костей, рак близлежащих тканей и лейкемию . [25] Чернобыльская ядерная авария 1986 года привела к загрязнению около 30 000 км 2 90 Sr в концентрации более 10 кБк/м 2 , что составляет около 5% от 90 Sr, находившегося в активной зоне реактора. [26]

Стронций назван в честь шотландской деревни Стронциан ( шотландский гэльский : Sròn an t-Sìthein ), где он был обнаружен в рудах свинцовых рудников. [27]
В 1790 году Адэр Кроуфорд , врач, занимавшийся получением бария, и его коллега Уильям Круикшенк признали, что стронцианские руды обладают свойствами, отличающимися от свойств других источников «тяжелого шпата». [28] Это позволило Кроуфорду сделать вывод на стр. 355: «... действительно вероятно, что шотландский минерал представляет собой новый вид земли, который до сих пор недостаточно изучен». Врач и коллекционер минералов Фридрих Габриэль Зульцер вместе с Иоганном Фридрихом Блюменбахом проанализировал минерал из стронциана и назвал его стронцианитом. Он также пришел к выводу, что он отличается от витерита и содержит новую землю (neue Grunderde). [29] В 1793 году Томас Чарльз Хоуп , профессор химии в Университете Глазго, изучил минерал [30] [31] и предложил название стронтиты . [32] [33] [34] Он подтвердил более раннюю работу Кроуфорда и рассказал: «... Считая это своеобразной землей, я счел необходимым дать ей имя. Я назвал ее стронтитами по месту ее обнаружения. По моему мнению, это способ происхождения, столь же подходящий, как и любое качество, которым оно может обладать, что является нынешней модой». Этот элемент был в конечном итоге выделен сэром Хамфри Дэви в 1808 году путем электролиза смеси, содержащей хлорид стронция и оксид ртути , и объявлен им в лекции в Королевском обществе 30 июня 1808 года. [35] В соответствии с названием элемента другие щелочноземельные земли он изменил название на стронций . [36] [37] [38] [39] [40]
Первое крупномасштабное применение стронция было при производстве сахара из сахарной свеклы . Хотя процесс кристаллизации с использованием гидроксида стронция был запатентован Огюстеном-Пьером Дюбрунфо в 1849 году [41], широкомасштабное внедрение произошло с усовершенствованием процесса в начале 1870-х годов. Немецкая сахарная промышленность использовала этот процесс вплоть до 20 века. До Первой мировой войны свеклосахарная промышленность использовала для этого процесса от 100 000 до 150 000 тонн гидроксида стронция в год. [42] Гидроксид стронция был переработан в процессе, но потребность в возмещении потерь во время производства была достаточно высока, чтобы создать значительный спрос, инициировавший добычу стронцианита в Мюнстерланде . Добыча стронцианита в Германии закончилась с началом разработки месторождений целестина в Глостершире . [43] Эти шахты поставляли большую часть мировых поставок стронция с 1884 по 1941 год. Хотя месторождения целестина в бассейне Гранады были известны в течение некоторого времени, крупномасштабная добыча началась только в 1950-х годах. [44]
Во время испытаний ядерного оружия в атмосфере было замечено, что стронций-90 является одним из продуктов ядерного деления с относительно высоким выходом. Сходство с кальцием и вероятность того, что стронций-90 может накапливаться в костях, сделали исследования метаболизма стронция важной темой. [45] [46]

Стронций обычно встречается в природе, являясь 15-м по распространенности элементом на Земле (его более тяжелый родственный барий занимает 14-е место), его содержание в среднем составляет примерно 360 частей на миллион в земной коре [47] и встречается главным образом в виде сульфатного минерала целестина (SrSO). 4 ) и карбонатный стронцианит (SrCO 3 ). Из этих двух целестин гораздо чаще встречается в месторождениях, достаточных для добычи полезных ископаемых. Поскольку стронций чаще всего используется в карбонатной форме, стронцианит был бы более полезным из двух распространенных минералов, но обнаружено мало месторождений, пригодных для разработки. [48] Из-за того, как стронций реагирует с воздухом и водой, в природе он существует только в сочетании с минералами. Встречающийся в природе стронций стабилен, но его синтетический изотоп Sr-90 образуется только в результате ядерных выпадений.
В подземных водах стронций ведет себя по химическому составу так же, как кальций. При pH от среднего до кислого Sr 2+ является доминирующей разновидностью стронция. В присутствии ионов кальция стронций обычно образует соосаждения с минералами кальция, такими как кальцит и ангидрит, при повышенном pH. При pH от среднего до кислого растворенный стронций связывается с частицами почвы посредством катионного обмена . [49]
Среднее содержание стронция в океанской воде составляет 8 мг/л. [50] [51] При концентрации стронция от 82 до 90 мкмоль/л концентрация значительно ниже, чем концентрация кальция, которая обычно составляет от 9,6 до 11,6 ммоль/л. [52] [53] Тем не менее, она намного выше, чем у бария, 13 мкг/л. [11]
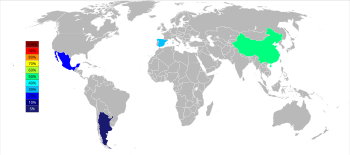
Тремя основными производителями стронция в виде целестина по состоянию на 2015 год являются Китай (150 000 т ), Испания (90 000 т) и Мексика (70 000 т); Аргентина (10 000 т) и Марокко (2 500 т) являются меньшими производителями. Хотя месторождения стронция широко распространены в Соединенных Штатах, их не добывают с 1959 года. [54]
Большая часть добытого целестина (SrSO 4 ) превращается в карбонат двумя способами. Либо целестин непосредственно выщелачивают раствором карбоната натрия, либо целестин обжигают углем с образованием сульфида. На втором этапе получается материал темного цвета, содержащий в основном сульфид стронция . Этот так называемый «черный пепел» растворяют в воде и фильтруют. Карбонат стронция осаждают из раствора сульфида стронция введением углекислого газа . [55] Сульфат восстанавливается до сульфида путем карботермического восстановления :
Ежегодно таким способом перерабатывается около 300 000 тонн. [56]
Металл производят в промышленных масштабах восстановлением оксида стронция алюминием . Стронций отгоняют из смеси. [56] Металлический стронций также можно получить в небольших масштабах электролизом раствора хлорида стронция в расплавленном хлориде калия : [12]

Стронций, занимающий 75% производства, в основном использовался в производстве стекла для электронно-лучевых трубок цветного телевидения [56] , где он предотвращал рентгеновское излучение. [57] [58] Это применение стронция сокращается, поскольку ЭЛТ заменяются другими методами отображения. Это снижение оказывает существенное влияние на добычу и переработку стронция. [48] Все части ЭЛТ должны поглощать рентгеновские лучи. В горловине и воронке трубки для этой цели используется свинцовое стекло, но этот тип стекла проявляет эффект потемнения из-за взаимодействия рентгеновских лучей со стеклом. Поэтому передняя панель сделана из другой смеси стекла со стронцием и барием для поглощения рентгеновских лучей. Средние значения для стеклянной смеси, определенные в ходе исследования по переработке в 2005 году, составляют 8,5% оксида стронция и 10% оксида бария . [59]
Поскольку стронций очень похож на кальций, он встраивается в кости. Включены все четыре стабильных изотопа, примерно в тех же пропорциях, которые встречаются в природе. Однако фактическое распределение изотопов имеет тенденцию сильно различаться от одного географического местоположения к другому. Таким образом, анализ кости человека может помочь определить регион, из которого она произошла. [60] [61] Этот подход помогает определить древние модели миграции и происхождение смешанных человеческих останков в местах захоронений на полях сражений. [62]
Отношения 87 Sr/ 86 Sr обычно используются для определения вероятных областей происхождения отложений в природных системах, особенно в морской и речной среде. Даш (1969) показал, что в поверхностных отложениях Атлантики наблюдаются отношения 87 Sr/ 86 Sr, которые можно рассматривать как средние значения отношений 87 Sr/ 86 Sr в геологических ландшафтах прилегающих массивов суши. [63] Хорошим примером речной-морской системы, к которой были успешно применены исследования происхождения изотопов Sr, является система река Нил-Средиземноморье. [64] Из-за разного возраста горных пород, составляющих большую часть Голубого и Белого Нила , с помощью изотопных исследований стронция можно различить водосборные площади меняющегося происхождения отложений, достигающих дельты реки Нил и Восточного Средиземноморья. Такие изменения климатически контролируются в позднечетвертичное время . [64]
Совсем недавно соотношение 87 Sr/ 86 Sr также использовалось для определения источника древних археологических материалов, таких как древесина и кукуруза в каньоне Чако, Нью-Мексико . [65] [66] Соотношение 87 Sr/ 86 Sr в зубах также можно использовать для отслеживания миграций животных . [67] [68]
Алюминат стронция часто используется в светящихся в темноте игрушках, поскольку он химически и биологически инертен. [69]
.jpg/440px-Ignis_Brunensis_2010-05-22_(5).jpg)
Карбонат стронция и другие соли стронция добавляют в фейерверки, чтобы придать им темно-красный цвет. [70] Этот же эффект обнаруживает катионы стронция в испытании пламенем . Фейерверки потребляют около 5% мирового производства. [56] Карбонат стронция используется в производстве твердых ферритовых магнитов. [71] [72]
Хлорид стронция иногда используется в зубных пастах для чувствительных зубов. Одна популярная марка содержит 10% гексагидрата хлорида стронция по весу. [73] Небольшие количества используются при рафинировании цинка для удаления небольших количеств примесей свинца. [11] Сам металл имеет ограниченное применение в качестве газопоглотителя для удаления нежелательных газов в вакууме путем реакции с ними, хотя для этой цели также можно использовать барий. [12]
Сверхузкий оптический переход между основным электронным состоянием [Kr]5s 2 1 S 0 и метастабильным возбужденным состоянием [Kr]5s5p 3 P 0 87 Sr является одним из ведущих кандидатов на будущее переопределение второго в термины оптического перехода в отличие от нынешнего определения, полученного из микроволнового перехода между различными основными сверхтонкими состояниями 133 Cs. [74] Современные оптические атомные часы , работающие на этом переходе, уже превосходят по точности и точности нынешнее определение секунды. [75]
89 Sr является активным ингредиентом Метастрона , [76] радиофармацевтического препарата , используемого при болях в костях, вторичных по отношению к метастатическому раку костей . Стронций перерабатывается организмом так же, как кальций, преимущественно включая его в кость в местах повышенного остеогенеза . Такая локализация фокусирует радиационное воздействие на раковое поражение. [24]

90 Sr использовался в качестве источника питания для радиоизотопных термоэлектрических генераторов (РИТЭГ). 90 Sr производит примерно 0,93 Вт тепла на грамм (это меньше для формы 90 Sr, используемой в РИТЭГах, которая представляет собой фторид стронция ). [77] Однакосрок службы 90 Sr составляет в три раза меньше, а плотность ниже, чем у 238 Pu , другого топлива для РИТЭГов. Главное преимущество 90 Sr состоит в том, что он дешевле 238 Pu и содержится в ядерных отходах . Советский Союз разместил около 1000 таких РИТЭГов на своем северном побережье в качестве источника энергии для маяков и метеорологических станций. [78] [79]
Acantharea , относительно большая группа морских простейших радиолярий , образует сложные минеральные скелеты , состоящие из сульфата стронция . [81] В биологических системах кальций в небольшой степени замещается стронцием. [82] В организме человека большая часть поглощенного стронция откладывается в костях. Соотношение стронция к кальцию в костях человека составляет от 1:1000 до 1:2000, примерно в том же диапазоне, что и в сыворотке крови. [83]
Организм человека поглощает стронций, как если бы это был его более легкий аналог кальций. Поскольку элементы химически очень похожи, стабильные изотопы стронция не представляют значительной угрозы для здоровья. Среднестатистический человек потребляет около двух миллиграммов стронция в день. [84] У взрослых потребляемый стронций имеет тенденцию прикрепляться только к поверхности костей, но у детей стронций может заменять кальций в минералах растущих костей и, таким образом, приводить к проблемам с ростом костей. [85]
Биологический период полураспада стронция у человека составляет от 14 до 600 дней, [86] [87] 1000 дней, [88] 18 лет, [89] 30 лет [90] и, в крайнем случае, 49 лет. [91] Широкий диапазон опубликованных биологических значений периода полураспада объясняется сложным метаболизмом стронция в организме. Однако, если усреднить все пути выведения, общий биологический период полураспада оценивается примерно в 18 лет. [92] На скорость выведения стронция сильно влияют возраст и пол из-за различий в костном метаболизме . [93]
Препарат стронция ранелат способствует росту костей , увеличивает плотность костей и снижает частоту переломов позвонков, периферических костей и бедра . [94] [95] Однако стронция ранелат также увеличивает риск венозной тромбоэмболии, легочной эмболии и серьезных сердечно-сосудистых заболеваний, включая инфаркт миокарда. Поэтому его использование в настоящее время ограничено. [96] Его положительные эффекты также сомнительны, поскольку повышенная плотность костей частично вызвана повышенной плотностью стронция по сравнению с кальцием, который он заменяет. Стронций также биоаккумулируется в организме. [97] Несмотря на ограничения на использование ранелата стронция , стронций все еще содержится в некоторых добавках. [98] [99] Научных данных о рисках, связанных с пероральным приемом хлорида стронция, не так много. Тем, у кого в личном или семейном анамнезе есть нарушения свертываемости крови, рекомендуется избегать употребления стронция. [98] [99]
Было показано, что стронций подавляет сенсорное раздражение при местном применении на коже. [100] [101] Было показано, что при местном применении стронций ускоряет скорость восстановления эпидермального барьера проницаемости (кожного барьера). [102]
Стронций-90 — радиоактивный продукт деления, вырабатываемый ядерными реакторами , используемыми в атомной энергетике . Это основной компонент высокого уровня радиоактивности ядерных отходов и отработанного ядерного топлива . Его 29-летний период полураспада достаточно короток, чтобы его теплота распада использовалась для питания арктических маяков, но достаточно продолжительна, чтобы его распад до безопасного уровня мог занять сотни лет. Воздействие загрязненной воды и продуктов питания может увеличить риск лейкемии , рака костей [103] и первичного гиперпаратиреоза . [104]
Водоросли продемонстрировали селективность в отношении стронция в исследованиях, в которых большинство растений, используемых в биоремедиации , не проявили селективности между кальцием и стронцием, часто насыщаяся кальцием, которого больше в количестве и который также присутствует в ядерных отходах. [103]
Исследователи изучили биоаккумуляцию стронция водорослями Scenedesmus spinosus в смоделированных сточных водах. В исследовании утверждается, что S. spinosus обладает высокоселективной биосорбционной способностью в отношении стронция , что позволяет предположить, что он может быть полезен для очистки ядерных сточных вод. [105]
Исследование прудовой водоросли Closterium moniliferum с использованием нерадиоактивного стронция показало, что изменение соотношения бария и стронция в воде улучшает селективность стронция. [103]
{{cite web}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка ){{cite web}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка ){{cite book}}: |journal=игнорируется ( помощь )