Синдром Вольфа-Паркинсона-Уайта ( WPWS ) — это расстройство, вызванное определенным типом проблемы с электрической системой сердца, включающим дополнительный путь, способный проводить электрический ток между предсердиями и желудочками , таким образом, обходя атриовентрикулярный узел . [2] [3] Примерно у 60% людей с электрической проблемой развивались симптомы, [5] которые могут включать ненормально быстрое сердцебиение , учащенное сердцебиение , одышку , головокружение или обморок . [1] Редко может произойти остановка сердца . [1] Наиболее распространенный тип нерегулярного сердцебиения , который возникает, известен как пароксизмальная наджелудочковая тахикардия . [1]
Причина WPW обычно неизвестна и, вероятно, обусловлена комбинацией случайных и генетических факторов. [2] Небольшое количество случаев обусловлено мутацией гена PRKAG2 , которая может наследоваться по аутосомно-доминантному типу. [2] Основной механизм включает дополнительный путь электрической проводимости между предсердиями и желудочками . [1] Он связан с другими состояниями, такими как аномалия Эбштейна и гипокалиемический периодический паралич . [1] Диагноз WPW ставится при сочетании сердцебиения и когда электрокардиограмма (ЭКГ) показывает короткий интервал PR и дельта-волну. [3] Это тип синдрома преждевременного возбуждения . [3]
Синдром WPW можно контролировать или лечить либо с помощью лекарств, либо с помощью абляции (разрушения тканей), например, с помощью радиочастотной катетерной абляции . [4] Он поражает от 0,1 до 0,3% населения. [1] Риск смерти у лиц без симптомов составляет около 0,5% в год у детей и 0,1% в год у взрослых. [5] В некоторых случаях неинвазивный мониторинг может помочь более тщательно стратифицировать пациентов по риску в категорию с более низким риском. [6] У лиц без симптомов может быть целесообразным постоянное наблюдение. [5] У лиц с WPW, осложненным мерцательной аритмией , можно использовать кардиоверсию или лекарство прокаинамид . [7] Состояние названо в честь Луиса Вольфа , Джона Паркинсона и Пола Дадли Уайта , которые описали результаты ЭКГ в 1930 году. [3]
Люди с WPW обычно не имеют симптомов, если у них нет быстрого сердечного ритма. Однако люди могут испытывать учащенное сердцебиение , головокружение , одышку или иногда синкопе (обморок или состояние, близкое к обмороку) во время эпизодов наджелудочковой тахикардии . WPW также связан с очень небольшим риском внезапной смерти из-за более опасных нарушений сердечного ритма. [8]

Электрическая активность в нормальном человеческом сердце начинается, когда потенциал сердечного действия возникает в синоатриальном (СА) узле, который расположен в правом предсердии . Оттуда электрический стимул передается по межузловым путям в атриовентрикулярный (АВ) узел. После короткой задержки в АВ узле стимул проходит через пучок Гиса в левую и правую ножки пучка, а затем в волокна Пуркинье и эндокард на верхушке сердца, затем, наконец, в желудочковый миокард . [ необходима цитата ]
AV-узел выполняет важную функцию «привратника», ограничивая электрическую активность, достигающую желудочков. В ситуациях, когда предсердия генерируют чрезмерно быструю электрическую активность (например, мерцательная аритмия или трепетание предсердий ), AV-узел ограничивает количество сигналов, проводимых к желудочкам. Например, если предсердия электрически активируются с частотой 300 ударов в минуту, половина этих электрических импульсов может блокироваться AV-узлом, так что желудочки стимулируются только с частотой 150 ударов в минуту, что приводит к пульсу в 150 ударов в минуту. Другим важным свойством AV-узла является то, что он замедляет отдельные электрические импульсы. Это проявляется на электрокардиограмме как интервал PR (время от электрической активации предсердий до электрической активации желудочков ), который обычно сокращается до менее чем 120 миллисекунд по продолжительности. [ необходима цитата ]
У людей с WPW есть дополнительный путь, который сообщается между предсердиями и желудочками, в дополнение к АВ-узлу. [6] Этот дополнительный путь известен как пучок Кента. Этот дополнительный путь не разделяет свойства замедления частоты АВ-узла и может проводить электрическую активность со значительно более высокой скоростью, чем АВ-узел. Например, в приведенном выше примере, если у человека частота предсердий составляет 300 ударов в минуту, дополнительный пучок может проводить все электрические импульсы от предсердий к желудочкам, заставляя желудочки сокращаться со скоростью 300 ударов в минуту. Чрезвычайно высокая частота сердечных сокращений, такая как эта, может привести к гемодинамической нестабильности или кардиогенному шоку . В некоторых случаях сочетание дополнительного пути и аномальных сердечных ритмов может вызвать фибрилляцию желудочков , основную причину внезапной сердечной смерти. [ необходима ссылка ]
Синдром WPW может быть связан с PRKAG2 , ферментом протеинкиназы , кодируемым геном PRKAG2 . [9]

Пучок Кента — это аномальный дополнительный или вспомогательный путь проведения между предсердиями и желудочками, который присутствует у небольшого процента (от 0,1 до 0,3%) общей популяции. [10] [11] [12] Этот путь может сообщаться между левым предсердием и левым желудочком, в этом случае он называется «предвозбуждением типа А», или между правым предсердием и правым желудочком, в этом случае он называется «предвозбуждением типа В» в старой, в настоящее время заброшенной классификации. [13] Проблемы возникают, когда этот путь создает электрическую цепь , которая обходит АВ-узел. АВ-узел способен замедлять скорость проведения электрических импульсов к желудочкам, тогда как пучок Кента лишен этой возможности. Когда аберрантное электрическое соединение осуществляется через пучок Кента, могут возникнуть тахиаритмии. [ необходима цитата ]

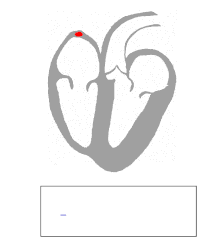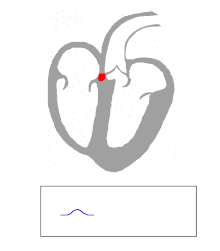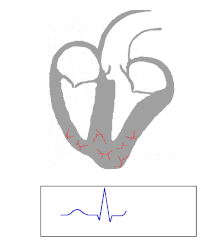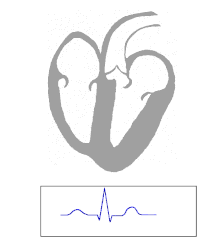
Синдром WPW обычно диагностируется на основе электрокардиограммы у бессимптомного человека. В этом случае он проявляется как дельта-волна, которая представляет собой невнятный подъем в комплексе QRS, связанный с коротким интервалом PR. Короткий интервал PR и невнятность комплекса QRS отражают раннее поступление импульса в желудочки (через дополнительный путь) без обычной задержки, наблюдаемой в АВ-узле. [ необходима цитата ]
Если у человека с WPW случаются эпизоды мерцательной аритмии, на ЭКГ регистрируется быстрая полиморфная тахикардия с широкими комплексами (без torsades de pointes ). Такое сочетание мерцательной аритмии и WPW считается опасным, и большинство антиаритмических препаратов противопоказаны. [ необходима цитата ]
Когда у человека нормальный синусовый ритм , ЭКГ-характеристиками WPW являются короткий интервал PR (продолжительностью менее 120 миллисекунд), расширенный комплекс QRS (продолжительностью более 120 миллисекунд) с нечеткой восходящей частью комплекса QRS и вторичные изменения реполяризации (отражающиеся в изменениях сегмента ST - зубца T ). [ необходима ссылка ]
У людей с синдромом WPW электрическая активность, которая инициируется в узле SA, проходит через дополнительный путь, а также через AV-узел, чтобы активировать желудочки через оба пути. Поскольку дополнительный путь не обладает свойствами замедления импульса AV-узла, электрический импульс сначала активирует желудочки через дополнительный путь, а затем сразу же через AV-узел. Это дает короткий интервал PR и невнятный подъем комплекса QRS, известный как дельта-волна. [ необходима цитата ]
В случае преждевременного возбуждения типа А (левые атриовентрикулярные соединения) положительный зубец R виден в отведении V1 («положительная дельта») на прекардиальных отведениях электрокардиограммы, тогда как при преждевременном возбуждении типа В (правые атриовентрикулярные соединения) в отведении V1 наблюдается преимущественно отрицательная дельта-волна («отрицательная дельта»). [13]
У людей с WPW может быть более одного дополнительного пути – в некоторых случаях было обнаружено до восьми аномальных путей. Это было замечено у людей с аномалией Эбштейна . [14]
Синдром Вольфа-Паркинсона-Уайта иногда ассоциируется с наследственной оптической нейропатией Лебера , формой митохондриального заболевания . [15]

WPW несет небольшой риск внезапной смерти, предположительно из-за быстро проводимой фибрилляции предсердий, вызывающей фибрилляцию желудочков. В то время как общий риск составляет приблизительно 2,4 на 1000 человеко-лет, риск у отдельного человека зависит от свойств дополнительного пути, вызывающего преждевременное возбуждение. [8]
Более высокий риск дополнительного пути может быть предположен по истории обмороков, но стратификация риска лучше всего выполняется путем оценки того, как часто путь может проводить импульс к желудочкам, обычно с помощью программируемой электрической стимуляции (ПЭС) в лаборатории электрофизиологии сердца . Это инвазивная, но, как правило, малорисковая процедура, во время которой предсердия стимулируются, чтобы попытаться вызвать тахикардию. Если тахикардия, связанная с дополнительным путем, может быть вызвана, кардиолог может затем оценить, насколько быстро дополнительный путь может проводить. Чем быстрее он может проводить, тем выше вероятность того, что дополнительный путь может проводить достаточно быстро, чтобы вызвать летальную тахикардию. [ необходима цитата ]
Высокорисковые признаки, которые могут присутствовать во время ПЭС, включают эффективный рефрактерный период дополнительного пути менее 250 мс, множественные пути, септальное расположение пути и индуцируемость наджелудочковой тахикардии ( АВРТ , мерцательная аритмия). Лица с любым из этих высокорисковых признаков, как правило, считаются имеющими повышенный риск внезапной сердечной смерти или симптоматической тахикардии и должны лечиться соответствующим образом (например, катетерная абляция). [16]
Неясно, необходима ли инвазивная стратификация риска (с ПЭС) у бессимптомных лиц. [17] В то время как некоторые группы выступают за ПЭС для стратификации риска у всех лиц моложе 35 лет, другие предлагают ее только лицам, имеющим анамнез, указывающий на тахиаритмию, поскольку частота внезапной сердечной смерти очень низкая (менее 0,6% в некоторых отчетах). [12] [18] [19]
Другие методы стратификации риска включают наблюдение за частотой желудочкового ритма во время спонтанной фибрилляции предсердий на 12-канальной ЭКГ. Интервалы RR менее 250 мс предполагают более высокий риск. Во время нагрузочного тестирования резкая потеря предвозбуждения при увеличении частоты сердечных сокращений также предполагает более низкий риск. [8] Однако этот подход затруднен нормальным улучшением проводимости АВ-узла во время упражнений, которое также может маскировать предвозбуждение, несмотря на продолжающуюся проводимость по дополнительному пути. [20]
Согласно протоколу ACLS , людям с синдромом WPW, у которых наблюдаются быстрые аномальные сердечные ритмы ( тахиаритмии ), может потребоваться синхронизированная электрическая кардиоверсия, если у них наблюдаются серьезные признаки или симптомы (например, низкое артериальное давление или летаргия с измененным психическим статусом ). Если они относительно стабильны, можно использовать лекарства. [21]
Паттерн WPW с гемодинамической стабильностью и ортодромной AVRT, приводящей к регулярной узкокомплексной тахикардии, можно лечить аналогично другим регулярным узкокомплексным наджелудочковым тахикардиям: сначала с помощью вагальных маневров, а затем пробного применения аденозина (терапия первой линии). Руководящие принципы ACC/AHA/HRS 2015 года рекомендуют бета-блокаторы или блокаторы кальциевых каналов в качестве препаратов второй линии, электрическая кардиоверсия зарезервирована для рефрактерных аритмий. Однако, если есть какие-либо сомнения относительно диагноза ортодромной AVRT или если наблюдается аберрантное проведение, приводящее к широкому комплексу QRS, может быть разумным лечить как недифференцированную ширококомплексную тахикардию. [22]
Людей с мерцательной аритмией и быстрым желудочковым ответом можно лечить амиодароном [7] или прокаинамидом [23] для стабилизации частоты сердечных сокращений. Прокаинамид и кардиоверсия являются общепринятыми методами лечения тахикардии, обнаруженной при WPW. [24] Амиодарон при мерцательной аритмии с WPW связан с желудочковой фибрилляцией и, таким образом, может быть хуже, чем прокаинамид. [7]
Блокаторы АВ-узла следует избегать при мерцательной аритмии и трепетании предсердий с синдромом WPW или его анамнезе; к ним относятся аденозин , дилтиазем , верапамил , другие блокаторы кальциевых каналов и бета-блокаторы . [25] Они могут усугубить синдром, блокируя нормальный электрический путь сердца (тем самым способствуя проведению 1:1 от предсердия к желудочку через путь предвозбуждения, что потенциально приводит к нестабильным желудочковым аритмиям). [22]
Окончательным лечением WPW является разрушение аномального электрического пути с помощью катетерной абляции . Два основных типа катетерной абляции включают радиочастотную абляцию с помощью тепла или криоабляцию с помощью холодной энергии. [6] Эта процедура выполняется кардиоэлектрофизиологами и имеет высокий уровень успеха в руках опытного электрофизиолога. [26] Результаты с 1994 года указывают на то, что уровень успеха достигает 95% у людей, прошедших лечение радиочастотной катетерной абляцией WPW. [27] Если радиочастотная катетерная абляция выполнена успешно, состояние обычно считается излеченным. Частота рецидивов обычно составляет менее 5% после успешной абляции. [26] У некоторых пациентов, например, с фоновой аномалией Эбштейна и наследственными кардиомиопатиями , может быть несколько дополнительных путей. [28]
Пучок Кента назван в честь британского физиолога Альберта Фрэнка Стэнли Кента (1863–1958), который описал боковые ветви в атриовентрикулярной борозде сердца обезьяны (ошибочно полагая, что они составляют нормальную атриовентрикулярную проводящую систему). [29] [30]
В 1915 году Фрэнк Норман Уилсон (1890–1952) стал первым, кто описал состояние, позже названное синдромом Вольфа–Паркинсона–Уайта. [31] Альфред М. Уэдд (1887–1967) был следующим, кто описал это состояние в 1921 году. [32] Кардиологи Луис Вольф (1898–1972), Джон Паркинсон (1885–1976) и Пол Дадли Уайт (1886–1973) считаются авторами окончательного описания расстройства в 1930 году. [33]