Синдром гипоплазии левых отделов сердца ( HLHS ) — редкий врожденный порок сердца , при котором левая сторона сердца сильно недоразвита и неспособна поддерживать системное кровообращение. [2] По оценкам, он составляет 2–3 % всех врожденных пороков сердца. [3] Ранние признаки и симптомы включают плохое питание, цианоз и ослабленный пульс на конечностях. [4] Считается, что этиология является многофакторной и возникает в результате сочетания генетических мутаций и дефектов, приводящих к изменению кровотока в сердце. [5] [6] [7] Могут быть затронуты несколько структур, включая левый желудочек , аорту , аортальный клапан или митральный клапан , что приводит к снижению системного кровотока. [8]
Диагностика может быть проведена до рождения с помощью УЗИ или вскоре после рождения с помощью эхокардиографии. [5] Первоначальное лечение направлено на поддержание проходимости артериального протока — соединения между легочной артерией и аортой, которое закрывается вскоре после рождения. [9] После этого пациенту в течение следующих нескольких лет жизни проводится трехэтапная паллиативная реконструкция. [10] Процедура Норвуда обычно выполняется в течение нескольких дней после рождения. [10] Процедура Гленна обычно выполняется в возрасте от трех до шести месяцев. [10] Наконец, процедура Фонтена выполняется в возрасте от двух до пяти лет. [10]
Если не лечить, пациенты с HLHS умирают в течение первых недель жизни, в то время как 70% тех, кто перенес трехэтапную паллиативную операцию, достигают взрослого возраста. После операции дети с HLHS обычно испытывают задержку неврологического развития, а также моторики и подвергаются повышенному риску сердечной недостаточности во взрослом возрасте. [11] [12]
HLHS встречается примерно у 1 из 3841 живорождений в Соединенных Штатах, или примерно у 1025 живорождений в год в США. [13] [14] В целом, по оценкам, он составляет 2-3% всех случаев врожденного порока сердца и является наиболее распространенным дефектом одного желудочка. [3] Считается, что он чаще встречается у младенцев мужского пола, в 1,5 раза чаще, чем у младенцев женского пола. [15] Недавний систематический обзор обнаружил небольшое снижение распространенности HLHS с 0,689/1000 в 1995–1999 годах до 0,475/1000 в 2010–2017 годах. [3] Считается, что это связано с улучшениями в пренатальной диагностике и пренатальном консультировании при последующих беременностях.

Закрытие артериального протока в сердце, которое сильно недоразвито слева, приводит к цианозу и респираторному дистрессу, которые могут прогрессировать до кардиогенного шока и смерти. Ранние симптомы могут включать плохое питание или цианоз, который не реагирует на введение кислорода. Периферический пульс может быть слабым, а конечности холодными на ощупь. [5]
СГЛС часто сочетается с низкой массой тела при рождении и преждевременными родами. [5]
У новорожденных с небольшим дефектом межпредсердной перегородки, называемым «рестриктивным», происходит недостаточное смешивание оксигенированной и дезоксигенированной крови. У таких новорожденных быстро наступает декомпенсация, и развивается ацидоз и цианоз. [5]
На ЭКГ отклонение оси вправо и гипертрофия правого желудочка являются обычными, но не являются признаками HLHS. Рентген грудной клетки может показать большое сердце ( кардиомегалию ) или увеличенную легочную сосудистую сеть. У новорожденных с HLHS обычно нет шума в сердце , но в некоторых случаях может быть слышен шум легочного потока или шум трикуспидальной регургитации . [5]
Сопутствующая трикуспидальная регургитация или дисфункция правого желудочка могут привести к развитию гепатомегалии . [5]
Большинство случаев HLHS являются спорадическими, то есть они возникают у пациентов без семейного анамнеза HLHS. [4] Некоторые случаи могут иметь генетический компонент, поскольку было показано, что HLHS является наследственным и связан с определенными мутациями генов. [16] [17] Возможные способствующие факторы могут включать внутриутробный инфаркт, инфекционные изменения и селективную кардиомиопатию левого желудочка.
Генетические локусы, связанные с HLHS, включают GJA1 (коннексин 43) , HAND1 , NKX2.5 , 10q22 и 6q23. [15] [18] [6] Существует небольшой риск рецидива при будущих беременностях, оцениваемый в 2–4%, который увеличивается до 25% в семьях с двумя больными детьми. [4] Считается, что это опосредовано генетическими мутациями с неполной пенетрантностью . [15]
HLHS также связан с несколькими генетическими синдромами, включая трисомию 13 (синдром Патау) , трисомию 18 (синдром Эдвардса) , частичную трисомию 9 , синдром Тернера (XO) , синдром Якобсена (синдром делеции 11q) , синдром Холта-Орама и синдром Смита-Лемли-Опица . [15] [18]
Популярная теория, называемая гипотезой «нет потока, нет роста», предполагает, что первичные анатомические дефекты аортального и митрального клапанов приводят к порокам развития левого желудочка и его выводного тракта. [9] Эти первичные дефекты можно разделить на те, которые приводят к обструкции выводного тракта или уменьшению наполнения левого желудочка. [7] Обструкция выводного тракта приводит к гипертрофии левого желудочка и уменьшению просвета левого желудочка. Одним из примеров этого может быть случай аортального стеноза. Аортальный стеноз, возникающий во время развития плода, приводит к дополнительной нагрузке на левый желудочек в утробе матери. Это в конечном итоге может привести к снижению перфузии через левый желудочек, что, как полагают, подавляет рост желудочка. [19]
При рождении артериальный проток все еще открыт, и в легких наблюдается более высокое, чем обычно, сопротивление кровотоку. Это обеспечивает адекватную оксигенацию путем смешивания между предсердиями и нормальным внешним видом при рождении. Когда артериальный проток начинает закрываться и сопротивление легочных сосудов уменьшается, кровоток через проток ограничивается, а приток в легкие увеличивается. [5]
В типичной анатомии левая часть сердца получает богатую кислородом кровь из легких и перекачивает ее в остальную часть тела. Пациенты с HLHS могут иметь ряд сердечных пороков, которые в конечном итоге приводят к уменьшению левого желудочка, который не может обеспечить достаточный приток крови к остальной части тела. [20] Существует три основных анатомических варианта заболевания, различающихся либо стенозом, либо атрезией аортального и митрального клапана. [20]
Подтип митральной атрезии и аортальной атрезии (MA-AA) является наиболее тяжелой формой HLHS, приводящей к полному отсутствию притока крови к левому желудочку, что приводит к отсутствию возможности выброса левого желудочка. [20] При подтипе митрального стеноза и аортальной атрезии (MS-AA) кровь способна заполнять левый желудочек, однако она не может быть доставлена в системный кровоток через гипоплазированную восходящую аорту. [20] Наконец, самая легкая форма - подтип митрального стеноза и аортального стеноза (MS-AS). [20] У этих пациентов, хотя левый желудочек способен поставлять некоторый приток крови к остальной части тела, общий системный выброс левого желудочка остается недостаточным. [20]
Во всех этих случаях кровь не может быть перекачана в остальную часть тела левым желудочком. Новорожденный зависит от крови, текущей через дефект межпредсердной перегородки , чтобы смешивать оксигенированную и дезоксигенированную кровь, и от открытого артериального протока, чтобы позволить крови достичь аорты и системного кровообращения через правый желудочек. Это то, что определяет HLHS как дефект « одного желудочка ». [15]
Из-за недоразвития левой стороны сердца в утробе матери повышенная постнагрузка вызывает гипертензию левого предсердия, отек легких и, следовательно, повреждение легких у плода еще до рождения. [19]
Синдром гипоплазии левого сердца можно диагностировать пренатально или после рождения с помощью эхокардиографии. Типичные результаты включают небольшой левый желудочек и аорту, аномалии митрального и аортального клапанов, ретроградный поток в поперечной дуге аорты и поток слева направо между предсердиями. Часто распознается во втором триместре беременности, между 18 и 24 неделями беременности. [5]
Рентгенография грудной клетки также может быть использована для диагностики синдрома гипоплазии левого сердца и обычно показывает увеличенный силуэт сердца вместе с признаками легочной гипертензии. Анализ крови и генетическое тестирование также остаются очень важными и должны включать полный анализ крови, электролиты, лактат и газы артериальной крови для оценки кислотно-щелочного состояния и оксигенации. Генетическое тестирование может быть полезным для получения и было связано с множественными хромосомными аномалиями, включая синдром Тернера, ДиДжорджи и Дауна. [21]
Без продлевающих жизнь вмешательств HLHS фатален, но с вмешательством младенец может выжить. Кардиоторакальный хирург может провести ряд операций или полную пересадку сердца . В то время как хирургическое вмешательство стало стандартом лечения в Соединенных Штатах, другие национальные системы здравоохранения, в частности во Франции, подходят к диагностике HLHS более консервативно, делая упор на прерывание беременности или сострадательный уход после родов. [8]
Перед операцией проток должен быть открыт, чтобы обеспечить приток крови с помощью лекарств, содержащих простагландин . [9] Воздух с меньшим содержанием кислорода, чем обычно, используется для младенцев с синдромом гипоплазии левых отделов сердца. Эти низкие уровни кислорода увеличивают легочное сосудистое сопротивление (ЛСС) и, таким образом, улучшают приток крови к остальной части тела из-за большей разницы давления между легкими и телом. Достижение уровня кислорода ниже атмосферного требует использования вдыхаемого азота. [22] Оксид азота является мощным легочным вазодилататором и, таким образом, снижает ЛСС и улучшает венозный возврат. Любой фактор, который увеличивает ЛСС, будет препятствовать правостороннему потоку. [23] [24]
Хирургические операции по оказанию помощи при гипоплазии левого сердца сложны и должны быть индивидуализированы для каждого пациента. Кардиолог должен оценить все медицинские и хирургические варианты в каждом конкретном случае. [ необходима цитата ]
В настоящее время младенцы подвергаются либо поэтапной реконструктивной хирургии ( процедура Норвуда или Сано в течение нескольких дней после рождения, процедура Гленна или Хеми-Фонтена в возрасте от 3 до 6 месяцев и процедура Фонтена в возрасте от 1 1/2 до 5 лет), либо трансплантации сердца. [10] В настоящее время ожидается, что 70% людей с HLHS могут достичь зрелого возраста. [18] Многие исследования показывают, что чем выше объем (количество проведенных операций) в больнице, тем ниже уровень смертности (смерти). [25] [26] Факторы, которые увеличивают риск для младенца, включают в себя меньшую массу тела при рождении, дополнительные врожденные аномалии, генетический синдром или тех, у кого сильно ограничена межпредсердная перегородка. [27] Для пациентов без этих дополнительных факторов риска 5-летняя выживаемость в настоящее время приближается к 80%. [27] Исследования показывают, что около 75% детей, переживших операцию, демонстрируют задержки развития в одной или нескольких областях, таких как двигательные, когнитивные или языковые нарушения, при этом около трети детей с одним желудочком без генетического синдрома имеют значительные нарушения. [28] Текущие исследования сосредоточены на выявлении связей между травмами, связанными с развитием нервной системы, хирургическими и интенсивными процедурами, а также генетической восприимчивостью с целью модификации вмешательств, которые ухудшают результаты развития нервной системы и психосоциальные результаты. [29] Альтернативой традиционной процедуре Норвуда является гибридная процедура. [30]
Некоторые врачи предлагают сострадательный уход вместо операций, которые приводят к смерти ребенка, обычно в течение 2 недель после рождения. Сострадательный уход контролируется врачом и может осуществляться как в больнице, так и на дому. Однако из-за значительного улучшения хирургического вмешательства, когда во многих больницах достигается более 90% выживаемости, ведутся споры о том, следует ли по-прежнему предлагать семьям сострадательный уход. [31] Исследование, проведенное в 2003 году, пришло к выводу, что выборка врачей, являющихся экспертами в уходе за детьми с HLHS, разделилась поровну, когда их спросили, что бы они сделали, если бы их собственные дети родились с HLHS, причем 1/3 заявили, что выбрали бы операцию, 1/3 заявили, что выбрали бы паллиативное (сострадательное) лечение без операции, и 1/3 заявили, что не уверены, какой выбор они сделают. [32]
Трехэтапная процедура является паллиативной (не лечебной), поскольку кровообращение ребенка осуществляется только с помощью двух из четырех камер сердца. [ необходима цитата ]

Первый шаг — процедура Норвуда . [33] В этой процедуре правый желудочек используется для перекачивания крови в системный кровоток. Поскольку правый желудочек больше не перекачивает кровь напрямую в легкие, требуется шунт для пропускания дезоксигенированной крови через легкие. Либо подключичная артерия может быть подключена к малому кругу кровообращения ( шунт Блэлока-Тауссига ), либо шунт делается непосредственно из правого желудочка в малый круг кровообращения ( шунт Сано ). Узкая аорта увеличивается с помощью заплаты для улучшения притока крови к телу. [34]
В это время ребенок может быть слабым с медицинской точки зрения и иметь проблемы с кормлением, поскольку сердце работает очень напряженно. В правом желудочке наблюдается значительная степень венозного смешивания, что приводит к снижению насыщения кислородом. Кроме того, как шунт Blalock-Taussig, так и шунт Sano подвергают легкие системному артериальному давлению, что приводит к длительной легочной гипертензии и, в конечном итоге, сердечной недостаточности. [33]
Гибридная процедура может использоваться вместо процедуры Норвуда. [33] [35] [36] Гибридная процедура не требует использования сердечно-легочного шунтирования или выполнения стернотомии . Вместо шестичасовой операции гибридная обычно занимает один-два часа. В ходе этой процедуры стент помещается в артериальный проток для поддержания его проходимости, а бандажи помещаются как на левую, так и на правую ветви легочной артерии для ограничения давления и чрезмерного кровообращения в легких. [37] Результаты гибридного подхода сопоставимы с результатами при Норвуде. [38]
Вторая стадия — двунаправленная операция Гленна или Хеми-Фонтана (см. также процедуру Кавашимы ) — устраняет некоторые проблемы, вызванные паллиативным лечением на первой стадии. [33] В ходе этой операции верхняя полая вена перевязывается от сердца и соединяется с легочным кровообращением. В это время шунт Блэлока-Тауссига или Сано удаляется. Легкие больше не подвергаются системному артериальному давлению, но подвергаются гораздо более низкому венозному давлению. Хотя венозная кровь из верхней половины тела больше не смешивается с оксигенированной кровью в правом желудочке, венозное смешивание из нижней половины тела все еще происходит, что приводит к некоторой степени десатурации кислорода. [33]
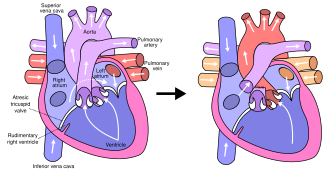
Последняя процедура, операция Фонтена , завершает восстановление гипоплазии левого сердца. [33] Хотя существует несколько вариаций, функциональный эффект заключается в перенаправлении венозной крови из нижней части тела (через нижнюю полую вену) от правого предсердия к легочной артерии. Это должно исключить любое смешивание оксигенированной и дезоксигенированной крови в правом желудочке. Правый желудочек выполняет традиционную работу левого, снабжая организм оксигенированной кровью, в то время как пассивное системное венозное давление выполняет традиционную работу правого, передавая дезоксигенированную кровь в легкие. [33]
Вмешательства, проводимые во время развития плода, находятся на стадии изучения. Когда признаки HLHS обнаруживаются пренатально с помощью УЗИ, чрескожная процедура, включающая введение баллонного катетера, может открыть дефект межпредсердной перегородки, чтобы предотвратить гипертензию левого предсердия и способствовать улучшению развития сердца. [39] [40]
95% нелеченных младенцев с синдромом гиперчувствительности умирают в первые недели жизни. [5]
Ранняя выживаемость улучшилась с введением процедуры Норвуда. [18] Поскольку долгосрочных исследований взрослых с HLHS не проводилось, статистические данные обычно берутся у пациентов после операции Фонтена; предполагается, что 70% пациентов с HLHS могут достичь зрелого возраста. [18]
Прогноз зависит от здоровья ребенка, поскольку у младенцев во время распространенных детских болезней наблюдается повышенная потребность в дыхании и частоте сердечных сокращений. Эта хрупкая популяция имеет небольшой сердечный резерв для удовлетворения этих потребностей и обеспечения гемодинамической стабильности во время болезней. [41]
Дети с HLHS и другими сопоставимыми состояниями одного желудочка, как группа, имеют худшие результаты нейроразвития, чем их здоровые сверстники. Были продемонстрированы дефициты языка, исполнительных функций и более высокие показатели тревожных и депрессивных расстройств. [42] Некоторые из этих результатов могут быть следствием генетических факторов, связанных с HLHS, а другие могут быть изменены путем изменения процедур и среды здравоохранения. Возникает клинический консенсус относительно важности непрерывного наблюдения за нейроразвитием с самых ранних лет до взрослой жизни. [11] [43] Кроме того, недавний метаанализ, сравнивающий двадцать два исследования, показал, что 64,7% исследований сообщили о задержке моторного развития у детей с физиологией одного желудочка, такой как синдром гипоплазии левого сердца. [12]
Как и у пациентов с другими типами пороков сердца, включающими деформацию клапанов, [44] у пациентов с HLHS высокий риск развития эндокардита , и они должны находиться под наблюдением кардиолога в течение всей оставшейся жизни для проверки функции сердца. [ необходима цитата ]
Трансплантация сердца может быть показана, как правило, после завершения операции Фонтена. [18] В одном многоцентровом исследовании (пациентов, перенесших операцию Фонтена с 1993 по 2001 год) сообщалось о 76%-ной годовой выживаемости у пациентов, которые дожили до трансплантации. [45]
Систематический обзор обнаружил 23 статьи, опубликованные с 2010 года, а также девять соответствующих клинических испытаний, связанных с врожденным пороком сердца и недавними достижениями в терапии стволовыми клетками. [46] Доклинические исследования были сосредоточены на нескольких типах стволовых клеток, включая: мезенхимальные стволовые клетки (МСК), аутологичные клетки пуповинной крови, сердечные стволовые клетки c-kit+ и неонатальные мезенхимальные стволовые клетки тимуса. [46] Эти типы клеток показали способность дифференцироваться в сердечную ткань, что делает их идеальными для сердечной регенеративной терапии. Первое использование аутологичных клеток пуповинной крови было проведено в клинике Майо в 2015 году, и было обнаружено, что они увеличили функцию правого желудочка у пациента после процедуры. [46] Первое использование сердечных клеток-предшественников произошло в ходе исследования Транскоронарной инфузии сердечных клеток-предшественников у пациентов с физиологией одного желудочка (TICAP) в 2011 году. [46]
В настоящее время проводится несколько исследований, в которых изучается осуществимость и эффективность терапии стволовыми клетками при заболеваниях одного желудочка, таких как синдром гипертрофированного желудочка сердца. [46] В этих исследованиях основное внимание уделяется тому, какие стволовые клетки являются наиболее эффективными, какое время является наилучшим при трехэтапном восстановлении и какой является оптимальный метод доставки.
Важно помнить, что пациенты с HLHS имеют повышенный риск развития сердечной недостаточности во взрослом возрасте. Остается неизвестным, снизят ли эти потенциальные методы лечения будущий риск сердечной недостаточности у этих пациентов.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite journal}}: Цитировать журнал требует |journal=( помощь )