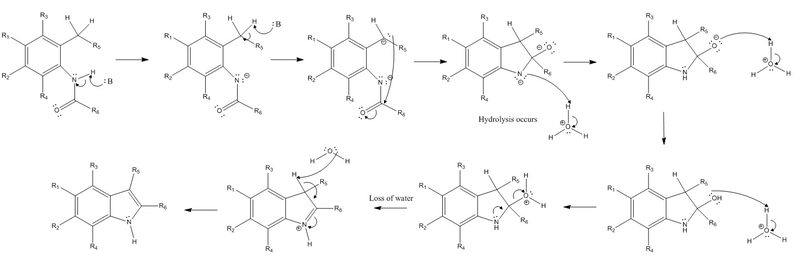
В органической химии синтез Маделунга представляет собой химическую реакцию , которая производит (замещенные или незамещенные) индолы путем внутримолекулярной циклизации N -фениламидов с использованием сильного основания при высокой температуре. Синтез Маделунга был описан в 1912 году Вальтером Маделунгом, когда он наблюдал, что 2-фенилиндол был синтезирован с использованием N -бензоил-о- толуидина и двух эквивалентов этоксида натрия в нагретой безвоздушной реакции. Обычные условия реакции включают использование алкоголята натрия или калия в качестве основания в растворителях гексана или тетрагидрофурана при температурах в диапазоне от 200 до 400 °C. В синтезе также требуется стадия гидролиза . Синтез Маделунга важен, поскольку это одна из немногих известных реакций, которые производят индолы из катализируемой основанием термической циклизации N-ацил-о-толуидинов.

Возможны варианты с другими основаниями или дополнительными заместителями, но метод в основном ограничивается получением 2-алкинилиндолов (нелегко доступных через электрофильное ароматическое замещение ) из-за жестких условий реакции. Подробный механизм реакции для синтеза Маделунга приведен ниже.
Реакция начинается с извлечения водорода из азота заместителя амида и извлечения бензильного водорода из заместителя орто в заместитель амида сильным основанием. Затем карбанион, полученный в результате извлечения бензильного водорода, осуществляет нуклеофильную атаку на электрофильный карбонильный углерод амидной группы. Когда это происходит, пи-связь амида преобразуется в неподеленную пару , создавая отрицательно заряженный кислород . После этих начальных шагов сильное основание больше не требуется, и должен произойти гидролиз. Отрицательно заряженный азот протонируется, чтобы восстановить свой нейтральный заряд, а кислород протонируется дважды, чтобы иметь положительный заряд, чтобы стать хорошей уходящей группой . Неподеленная пара от азота образует пи-связь, чтобы вытеснить положительно заряженную уходящую группу, а также заставляет азот иметь положительный заряд. Заключительный этап реакции — реакция элиминирования (в частности, реакция E2 ), которая включает в себя извлечение другого водорода, который когда-то был бензильным, до образования бициклического соединения , электроны которого преобразуются в новую пи-связь в кольцевой системе. Это позволяет пи-связи, образованной азотом на предыдущем этапе, снова преобразоваться в неподеленную пару на азоте, чтобы восстановить нейтральный заряд азота.
Различные методы были применены для увеличения выхода желаемого индольного продукта. Когда ароматическое кольцо имеет электронодонорные заместители, получаются более высокие выходы, и обратное верно, когда ароматическое кольцо имеет электроноакцепторные заместители. [1] Однако, когда заместитель R5 является электроноакцепторным заместителем, выход увеличивается, а не уменьшается. Кроме того, эффективность реакции также сильно зависит от объемности заместителя R6. Чем объемнее эта группа, тем менее эффективна реакция. Условия, требуемые для синтеза Маделунга, довольно суровы. К счастью, вышеупомянутые модификации с тех пор применялись для повышения его практичности, работая над снижением требуемой температуры, при которой проводится реакция, и увеличением выхода желаемого продукта. Например, когда электронодонорные заместители помещаются в ароматическое кольцо N-фениламида, а электроноакцепторный заместитель заменяется на R5, требуемая температура для реакции снижается примерно до 25 °C. [1] Еще более впечатляющим является то, что исследователи обнаружили, что требуемая температура для синтеза Маделунга снижается до температурного диапазона −20 – 25 °C, когда используются основания бутиллития (BuLi) и диизопропиламида лития (LDA), а также когда в качестве растворителя используется тетрагидрофуран. [2] Эта конкретная модификация, использование любого из этих оснований, опосредованных металлом, называется вариацией Маделунга-Хулихана. [3]
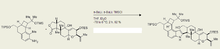
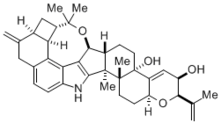
Синтез Маделунга имеет множество важных применений в химии , биохимии и промышленной химии . Эта реакция оказалась полезной в синтезе с выходом 81% архитектурно сложного треморгенного индольного алкалоида (-)-пенитрема D, молекулы, естественным образом вырабатываемой грибком спорыньи , который вызывает различные мышечные и неврологические заболевания у скота . [4] Поскольку этот токсин в конечном итоге вызывает значительные экономические проблемы в животноводческой отрасли, понимание того, как синтезировать и легко разлагать алкалоид (-)-пенитрем D, имеет большое значение. Тем не менее, синтез такой сложной молекулы сам по себе был невероятным подвигом.
Еще одна грань, в которой синтез Маделунга оказался полезным, — это синтез 2,6-дифенил-1,5-диаза-1,5-дигидро-s-индацена из 2,5-диметил-1,4-фенилендиамина. [5]
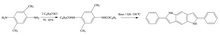
Этот синтез был выполнен без изменений в синтезе Маделунга, с использованием основания этилата натрия при температуре 320–330 °C. Этот индацен показал себя как органический светодиод , который может иметь важные приложения для недорогих световых дисплеев в коммерческой промышленности.
Синтез Маделунга, модифицированный Смитом, также называемый синтезом индола Смита, был открыт в 1986 году Амосом Смитом и его исследовательской группой. Этот синтез использует реакцию конденсации литийорганических реагентов, полученных из 2-алкил-N- триметилсилил анилинов с помощью сложных эфиров или карбоновых кислот для получения замещенных индолов. [6] Этот синтез оказался применимым к широкому спектру замещенных анилинов, включая те, которые содержат алкильные , метокси и галогенидные группы, и может реагировать с неенолизируемыми сложными эфирами или лактонами для получения промежуточных соединений N-литиокетамина. Затем эти промежуточные соединения подвергаются внутримолекулярному гетероатомному олефинированию Петерсона для получения индолининов, которые затем таутомеризуются в 2-замещенные индолы. Синтез индола Смита является одной из наиболее важных модификаций синтеза Маделунга.
Синтез индола Смита начинается с использования двух эквивалентов литийорганического реагента (поскольку литийорганические реагенты являются очень сильными основаниями) для извлечения водорода как из алкильного заместителя, так и из азота, что приводит к отрицательному заряду на обоих. Синтез продолжается с нуклеофильной атакой карбаниона на электрофильный карбонильный углерод эфира или карбоновой кислоты. Когда это происходит, пи-связь электрофила преобразуется в неподеленную пару на кислороде. Эти неподеленные пары затем снова преобразуются обратно в пи-связь, что приводит к вытеснению группы -OR. Затем отрицательно заряженный азот осуществляет нуклеофильную атаку на соседний электрофильный карбонильный углерод, снова заставляя пи-связь электрофила преобразовываться в неподеленную пару на кислороде. Этот отрицательно заряженный кислород затем осуществляет нуклеофильную атаку на атом кремния триметилсилильной (TMS) группы, в результате чего образуется трициклическое соединение, а также положительно заряженный атом кремния и нейтральный атом кислорода. Синтез протекает через внутримолекулярное гетероатомное олефинирование Петерсона, в конечном итоге приводящее к реакции элиминирования, которая вытесняет группу TMSO и образует пи-связь в пятичленном кольце у атома азота. Затем происходит кето-енольная таутомерия, в результате чего получается желаемый продукт.
