ДНК хлоропластов ( хпДНК ) — это ДНК, расположенная в хлоропластах, фотосинтетических органеллах, расположенных внутри клеток некоторых эукариотических организмов. Хлоропласты, как и другие типы пластид , содержат геном, отдельный от генома в ядре клетки . Существование ДНК хлоропластов было идентифицировано биохимически в 1959 г. [1] и подтверждено электронной микроскопией в 1962 г. [2] Открытие того, что хлоропласт содержит рибосомы [3] и осуществляет синтез белка [4], показало, что хлоропласт генетически полу- автономный. Первые полные последовательности генома хлоропластов были опубликованы в 1986 году: Nicotiana tabacum (табак) Сугиурой и его коллегами и Marchantia polymorpha (печеночник) Озеки и др. [5] [6] С тех пор было секвенировано большое количество ДНК хлоропластов различных видов .
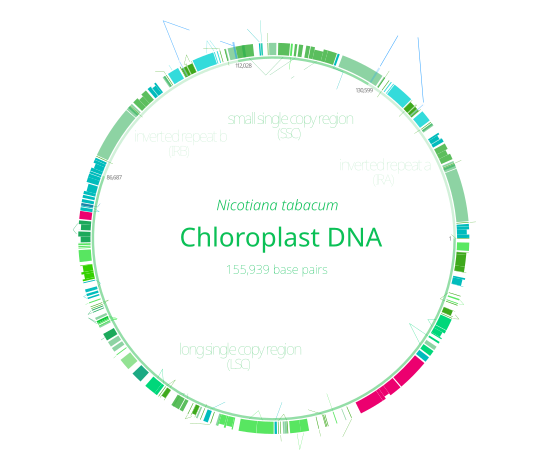
ДНК хлоропластов имеют круглую форму и обычно имеют длину 120 000–170 000 пар оснований . [7] [8] [9] Они могут иметь длину контура около 30–60 микрометров и массу около 80–130 миллионов дальтон . [10]
У большинства хлоропластов весь хлоропластный геном объединен в одно большое кольцо, хотя геном динофитовых водорослей является заметным исключением: их геном разбит примерно на сорок небольших плазмид , каждая из которых имеет длину 2 000–10 000 пар оснований . [11] Каждое миникольцо содержит от одного до трёх генов, [11] но также были обнаружены пустые плазмиды, не содержащие кодирующей ДНК .
Долгое время считалось, что ДНК хлоропластов имеет кольцевую структуру, но некоторые данные свидетельствуют о том, что ДНК хлоропластов чаще принимает линейную форму. [12] Было замечено , что более 95% хлоропластной ДНК в хлоропластах кукурузы имеют разветвленную линейную форму, а не отдельные круги. [11]
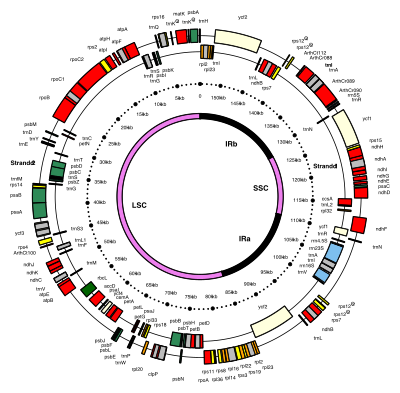
ДНК многих хлоропластов содержат два инвертированных повтора , которые отделяют длинный однокопийный участок (LSC) от короткого однокопийного участка (SSC). [9]
Инвертированные повторы сильно различаются по длине: от 4000 до 25 000 пар оснований каждый. [11] Инвертированные повторы у растений, как правило, находятся в верхней части этого диапазона, каждый из которых имеет длину 20 000–25 000 пар оснований. [9] [13] Области инвертированных повторов обычно содержат три гена рибосомальной РНК и два гена тРНК , но они могут быть расширены или уменьшены , чтобы содержать от четырех до более 150 генов. [11] Хотя данная пара инвертированных повторов редко бывает полностью идентична, они всегда очень похожи друг на друга, что, по-видимому, является результатом согласованной эволюции . [11]
Области инвертированных повторов высококонсервативны среди наземных растений и накапливают мало мутаций. [9] [13] Подобные инвертированные повторы существуют в геномах цианобактерий и двух других линий хлоропластов ( glaucophyta и rhodophyceæ ), что позволяет предположить, что они предшествуют хлоропластам, [11] хотя некоторые ДНК хлоропластов, такие как ДНК гороха и некоторых красных водорослей , [11] с тех пор утратили инвертированные повторы. [13] [14] Другие, например, красная водоросль Порфира, перевернули один из своих инвертированных повторов (сделав их прямыми повторами). [11] Вполне возможно, что инвертированные повторы помогают стабилизировать остальную часть генома хлоропластов, поскольку ДНК хлоропластов, потерявшие некоторые сегменты инвертированных повторов, имеют тенденцию к большей перестройке. [14]
Каждый хлоропласт содержит около 100 копий своей ДНК в молодых листьях, а в старых листьях их количество снижается до 15–20 копий. [15] Они обычно упакованы в нуклеоиды , которые могут содержать несколько идентичных колец ДНК хлоропластов. В каждом хлоропласте можно обнаружить множество нуклеоидов. [10]
Хотя ДНК хлоропластов не связана с настоящими гистонами , [16] в красных водорослях был обнаружен гистоноподобный хлоропластный белок (HC), кодируемый ДНК хлоропластов, который плотно упаковывает каждое кольцо ДНК хлоропласта в нуклеоид . [17]
У примитивных красных водорослей нуклеоиды ДНК хлоропластов сгруппированы в центре хлоропласта, тогда как у зеленых растений и зеленых водорослей нуклеоиды рассеяны по всей строме . [17]
Было секвенировано более 5000 геномов хлоропластов , и они доступны через базу данных геномов органелл NCBI. [18] Первые геномы хлоропластов были секвенированы в 1986 году из табака ( Nicotiana tabacum ) [ 19 ] и печеночника ( Marchantia полиморфа ). [20] Сравнение последовательностей генов цианобактерий Synechocystis с последовательностями хлоропластов Arabidopsis подтвердило эндосимбиотическое происхождение хлоропластов. [21] [22] Это также продемонстрировало значительную степень переноса генов от цианобактериального предка к ядерному геному.
У большинства видов растений геном хлоропластов кодирует около 120 генов. [23] [24] Гены в первую очередь кодируют основные компоненты фотосинтетического аппарата и факторы, участвующие в их экспрессии и сборке. [25] Среди видов наземных растений набор генов, кодируемых геномом хлоропластов, достаточно консервативен. Сюда входят четыре рибосомальные РНК , примерно 30 тРНК , 21 рибосомальный белок и 4 субъединицы пластид-кодируемого комплекса РНК-полимеразы , которые участвуют в экспрессии пластидных генов. [25] Большая субъединица Рубиско и 28 фотосинтетических белков тилакоидов закодированы в геноме хлоропластов. [25]
Со временем многие части генома хлоропласта были перенесены в ядерный геном хозяина, [7] [8] [26] этот процесс называется эндосимбиотическим переносом генов . В результате геном хлоропластов сильно редуцирован по сравнению с геномом свободноживущих цианобактерий. Хлоропласты могут содержать 60–100 генов, тогда как цианобактерии часто имеют в своем геноме более 1500 генов. [27] Напротив, известно лишь несколько случаев, когда гены были перенесены в хлоропласт от различных доноров, включая бактерии. [28] [29] [30]
Эндосимбиотический перенос генов — это то, как мы узнаем об утраченных хлоропластах во многих линиях хромальвеолатов . Даже если хлоропласт в конечном итоге теряется, гены, которые он пожертвовал ядру бывшего хозяина, сохраняются, что доказывает существование утраченного хлоропласта. Например, в то время как диатомовые водоросли ( гетероконтофит ) теперь имеют хлоропласт, полученный из красных водорослей , присутствие многих генов зеленых водорослей в ядре диатомовых водорослей свидетельствует о том, что предок диатомовых водорослей (вероятно, также предок всех хромальвеолатов) имел хлоропласт, полученный из зеленых водорослей . некоторая точка, которая впоследствии была заменена красным хлоропластом. [31]
У наземных растений около 11–14% ДНК в их ядрах можно отнести к хлоропластам, [32] до 18% у Arabidopsis , что соответствует примерно 4500 генам, кодирующим белки. [33] Недавно было несколько случаев переноса генов из ДНК хлоропластов в ядерный геном наземных растений. [8]
Из примерно трех тысяч белков, обнаруженных в хлоропластах, около 95% кодируются ядерными генами. Многие белковые комплексы хлоропластов состоят из субъединиц как генома хлоропласта, так и ядерного генома хозяина. В результате синтез белка должен быть скоординирован между хлоропластом и ядром. Хлоропласты в основном находятся под ядерным контролем, хотя хлоропласты также могут выдавать сигналы, регулирующие экспрессию генов в ядре, так называемые ретроградные сигналы . [34]
Синтез белка в хлоропластах основан на РНК-полимеразе , кодируемой собственным геномом хлоропласта, которая родственна РНК-полимеразам, обнаруженным у бактерий. Хлоропласты также содержат загадочную вторую РНК-полимеразу, которая кодируется ядерным геномом растения. Две РНК-полимеразы могут распознавать и связываться с различными типами промоторов в геноме хлоропластов. [35] Рибосомы в хлоропластах похожи на бактериальные рибосомы. [36]
Редактирование РНК — это вставка, удаление и замена нуклеотидов в транскрипте мРНК перед трансляцией в белок. Высокоокислительная среда внутри хлоропластов увеличивает скорость мутаций, поэтому для сохранения функциональных последовательностей необходима посттранскрипционная репарация. Эдитосома хлоропласта заменяет C -> U и U -> C в очень специфических местах транскрипта. Это может изменить кодон аминокислоты или восстановить нефункциональный псевдоген путем добавления стартового кодона AUG или удаления преждевременного стоп-кодона UAA. [37]
Эдитосома распознает и связывается с цис-последовательностью, расположенной выше сайта редактирования. Расстояние между сайтом связывания и сайтом редактирования зависит от гена и белков, участвующих в эдитосоме. Сотни различных белков PPR ядерного генома участвуют в процессе редактирования РНК. Эти белки состоят из 35-мерных повторяющихся аминокислот, последовательность которых определяет цис-связывающий сайт редактируемого транскрипта. [37]
Базальные наземные растения, такие как печеночники, мхи и папоротники, имеют сотни различных мест редактирования, тогда как у цветковых растений их обычно от тридцати до сорока. У паразитических растений, таких как Epifagus Virginiana, наблюдается потеря редактирования РНК, что приводит к потере функции генов фотосинтеза. [38]
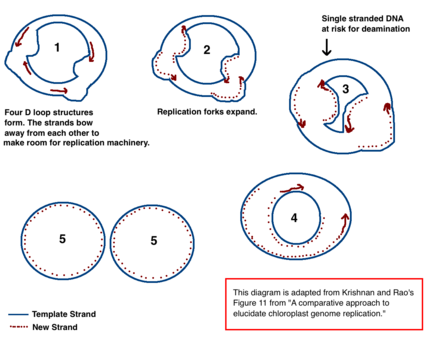
Механизм репликации ДНК хлоропластов (хпДНК) окончательно не определен, но были предложены две основные модели. Ученые пытались наблюдать репликацию хлоропластов с помощью электронной микроскопии с 1970-х годов. [39] [40] Результаты микроскопических экспериментов привели к идее, что ДНК хлоропластов реплицируется с использованием петли двойного смещения (D-петли). Когда D-петля движется по кольцевой ДНК, она принимает промежуточную тета-форму, также известную как промежуточный продукт репликации Кэрнса, и завершает репликацию с помощью механизма катящегося круга. [39] [12] Репликация начинается в определенных точках происхождения. Множественные репликационные вилки открываются, позволяя механизму репликации реплицировать ДНК. По мере продолжения репликации вилки растут и в конечном итоге сходятся. Новые структуры хпДНК разделяются, образуя дочерние хромосомы хпДНК.
В дополнение к ранним экспериментам по микроскопии, эта модель также подтверждается количеством дезаминирования , наблюдаемым в хпДНК. [39] Дезаминирование происходит при потере аминогруппы и представляет собой мутацию , которая часто приводит к изменению оснований. При дезаминировании аденина он превращается в гипоксантин (H). Гипоксантин может связываться с цитозином , и когда пара оснований HC реплицируется, он становится GC (таким образом, происходит замена оснований A → G). [41]

В хпДНК существует несколько градиентов дезаминирования A → G. ДНК становится восприимчивой к событиям дезаминирования, когда она одноцепочечная. Когда образуются репликационные вилки, некопируемая цепь является одноцепочечной и, следовательно, подвергается риску дезаминирования A → G. Следовательно, градиенты дезаминирования указывают на то, что репликационные вилки, скорее всего, присутствовали, а также на направление, в котором они первоначально открывались (самый высокий градиент, скорее всего, находится ближе всего к стартовому сайту, поскольку он был одноцепочечным в течение самого длительного периода времени). [39] Этот механизм по-прежнему является ведущей теорией сегодня; однако вторая теория предполагает, что большая часть хпДНК на самом деле линейна и реплицируется посредством гомологичной рекомбинации. Далее утверждается, что лишь незначительная часть генетического материала хранится в кольцевых хромосомах, тогда как остальная часть находится в разветвленных, линейных или других сложных структурах. [39] [12]
Одна из основных конкурирующих моделей хпДНК утверждает, что большая часть хпДНК является линейной и участвует в структурах гомологичной рекомбинации и репликации, подобных бактериофагу Т4 . [12] Было установлено, что некоторые растения имеют линейную хпДНК, например кукуруза, а другие еще содержат сложные структуры, которые ученые еще не понимают; [12] однако сегодня преобладает точка зрения, что большая часть хпДНК является кольцевой. Когда были проведены оригинальные эксперименты с хпДНК, ученые заметили линейные структуры; однако они приписывали эти линейные формы разорванным кругам. [12] Если разветвленные и сложные структуры, наблюдаемые в экспериментах с хпДНК, реальны, а не являются артефактами сцепленной кольцевой ДНК или разорванных кругов, то механизма репликации D-петли недостаточно, чтобы объяснить, как эти структуры будут реплицироваться. [12] В то же время гомологичная рекомбинация не объясняет множественные градиенты A → G, наблюдаемые в пластомах. [39] Этот недостаток является одним из самых больших для теории линейной структуры.
Перемещение такого большого количества генов хлоропластов в ядро означает, что многие белки хлоропластов , которые должны были транслироваться в хлоропластах, теперь синтезируются в цитоплазме. Это означает, что эти белки должны быть направлены обратно в хлоропласт и импортированы как минимум через две мембраны хлоропласта. [42]
Любопытно, что около половины белковых продуктов перенесенных генов даже не доставляются обратно в хлоропласты. Многие из них стали экзаптациями , взяв на себя новые функции, такие как участие в делении клеток , маршрутизации белков и даже устойчивости к болезням . Несколько генов хлоропластов нашли новый дом в митохондриальном геноме — большинство из них стали нефункциональными псевдогенами , хотя несколько генов тРНК все еще работают в митохондриях . [27] Некоторые перенесенные белковые продукты ДНК хлоропластов направляются по секреторному пути [27] (хотя многие вторичные пластиды ограничены внешней мембраной, полученной из клеточной мембраны хозяина , и, следовательно, топологически вне клетки, поскольку для достижения хлоропласта из цитозоль , вам придется пересечь клеточную мембрану , как если бы вы направлялись во внеклеточное пространство . В этих случаях белки , нацеленные на хлоропласты, первоначально перемещаются по секреторному пути). [43]
Поскольку клетка, приобретающая хлоропласт, уже имела митохондрии (и пероксисомы , а также клеточную мембрану для секреции), новому хозяину-хлоропласту пришлось разработать уникальную систему нацеливания на белки , чтобы избежать отправки белков хлоропласта в неправильную органеллу . [42]
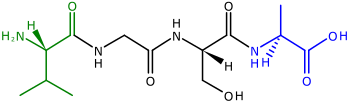
Полипептиды , предшественники белков , представляют собой цепочки аминокислот . Два конца полипептида называются N-концом , или амино-концом , и С-концом , или карбоксильным концом . [44] Для многих (но не всех) [45] белков хлоропластов, кодируемых ядерными генами, к N-концам полипептидов добавляются расщепляемые транзитные пептиды , которые используются для направления полипептида в хлоропласт для импорта [42] [46] (N-концевые транзитные пептиды также используются для направления полипептидов в митохондрии растений ). [47] N-концевые транзитные последовательности также называют препоследовательностями [42] , поскольку они расположены на «переднем» конце полипептида — рибосомы синтезируют полипептиды от N-конца к C-концу. [44]
Транзитные пептиды хлоропластов демонстрируют огромные различия по длине и аминокислотной последовательности . [46] Они могут иметь длину от 20 до 150 аминокислот [42] — необычно большая длина, позволяющая предположить, что транзитные пептиды на самом деле представляют собой наборы доменов с различными функциями. [46] Транзитные пептиды, как правило, положительно заряжены , [42] богаты гидроксилированными аминокислотами, такими как серин , треонин и пролин , и бедны кислыми аминокислотами, такими как аспарагиновая кислота и глутаминовая кислота . [46] В водном растворе транзитная последовательность образует случайный клубок. [42]
Однако не все белки хлоропластов содержат N-концевой расщепляемый транзитный пептид. [42] Некоторые включают транзитную последовательность в функциональную часть самого белка. [42] Вместо этого к С-концу некоторых из них присоединяется транзитная последовательность . [48] Большинство полипептидов, у которых отсутствуют N-концевые направляющие последовательности, - это те полипептиды, которые направляются на внешнюю мембрану хлоропласта , плюс по крайней мере один направляется на внутреннюю мембрану хлоропласта . [42]
После того, как полипептид хлоропласта синтезируется на рибосоме в цитозоле , энергия АТФ может быть использована для фосфорилирования или добавления фосфатной группы ко многим (но не всем) из них в их транзитных последовательностях. [42] Серин и треонин (оба очень распространены в транзитных последовательностях хлоропластов и составляют 20–30% последовательности) [49] часто являются аминокислотами , которые принимают фосфатную группу . [47] [49] Фермент , осуществляющий фосфорилирование, специфичен для полипептидов хлоропластов и игнорирует те, которые предназначены для митохондрий или пероксисом . [49]
Фосфорилирование изменяет форму полипептида [49] , облегчая прикрепление белков 14-3-3 к полипептиду. [42] [50] У растений белки 14-3-3 связываются только с пребелками хлоропластов. [47] Он также связывается с белком шока Hsp70 , который предотвращает преждевременное сворачивание полипептида . [42] Это важно, поскольку предотвращает принятие хлоропластными белками активной формы и выполнение своих хлоропластных функций не в том месте — цитозоле . [47] [50] В то же время они должны сохранять достаточную форму, чтобы их можно было распознать и импортировать в хлоропласт. [47]
Белок теплового шока и белки 14-3-3 вместе образуют цитозольный направляющий комплекс, который облегчает импорт полипептида хлоропласта в хлоропласт. [42]
Альтернативно, если транзитный пептид пребелка хлоропласта не фосфорилирован, пребелок хлоропласта все равно может присоединяться к белку теплового шока или Toc159. Эти комплексы могут связываться с комплексом TOC на внешней мембране хлоропласта, используя энергию GTP . [42]
Комплекс ТОС , или транслокон на внешней мембране хлоропласта , представляет собой совокупность белков, которые импортируют пребелки через внешнюю оболочку хлоропласта . Идентифицировано пять субъединиц комплекса ТОС — два GTP -связывающих белка Toc34 и Toc159, туннель импорта белка Toc75, а также белки Toc64 [42] и Toc12. [45]
Первые три белка образуют основной комплекс, состоящий из одного Toc159, четырех-пяти Toc34 и четырех Toc75, которые образуют четыре отверстия в диске диаметром 13 нанометров . Весь основной комплекс весит около 500 килодальтон . Два других белка, Toc64 и Toc12, связаны с основным комплексом, но не являются его частью. [45]
![Toc34 из растения гороха. Toc34 имеет три почти идентичные молекулы (показаны слегка разными оттенками зеленого), каждая из которых образует димер с одной из соседних молекул. Часть сайта связывания молекулы GDP выделена розовым цветом.[51]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e4/TOC34.png/350px-TOC34.png)
Toc34 представляет собой интегральный белок внешней мембраны хлоропласта, закрепленный в ней гидрофобным [ 52] С-концевым хвостом. [42] [50] Однако большая часть белка, включая его большой гуанозинтрифосфат (GTP)-связывающий домен , выступает в строму. [50]
Задача Toc34 — поймать некоторые пребелки хлоропластов в цитозоле и передать их остальной части комплекса TOC. [42] Когда GTP , энергетическая молекула, подобная АТФ , присоединяется к Toc34, белок становится гораздо более способным связываться со многими пребелками хлоропластов в цитозоле . [42] Присутствие препротеина хлоропластов заставляет Toc34 расщеплять GTP на гуанозиндифосфат (GDP) и неорганический фосфат . Эта потеря GTP заставляет белок Toc34 высвобождать пребелок хлоропласта, передавая его следующему белку TOC. [42] Затем Toc34 высвобождает истощенную молекулу ВВП, вероятно, с помощью неизвестного фактора обмена ВВП . Домен Toc159 может быть фактором обмена, выполняющим удаление ВВП. Затем белок Toc34 может поглотить другую молекулу GTP и начать цикл заново. [42]
Toc34 можно отключить посредством фосфорилирования . Протеинкиназа , дрейфующая по внешней мембране хлоропласта, может использовать АТФ для добавления фосфатной группы к белку Toc34, не позволяя ему получить другую молекулу GTP , ингибируя активность белка. Это может дать возможность регулировать импорт белка в хлоропласты. [42] [50]
Arabidopsis thaliana имеет два гомологичных белка, AtToc33 и AtToc34 ( At означает Arabidopsis t haliana ), [42] [50] , каждый из которых примерно на 60% идентичен по аминокислотной последовательности Toc34 гороха (называемый ps Toc34). [50] AtToc33 является наиболее распространенным у Arabidopsis , [50] и является функциональным аналогом Toc34, поскольку его можно отключить фосфорилированием. С другой стороны, AtToc34 не может фосфорилироваться. [42] [50]
Toc159 — это еще одна субъединица TOC, связывающая GTP , такая же, как Toc34. Toc159 имеет три домена . На N- конце находится А-домен, богатый кислыми аминокислотами и занимающий около половины длины белка. [42] [52] A-домен часто отщепляется , оставляя фрагмент массой 86 килодальтон , называемый Toc86. [52] В середине находится его GTP- связывающий домен, который очень похож на гомологичный GTP-связывающий домен в Toc34. [42] [52] На С- конце находится гидрофильный М-домен, [42] который закрепляет белок на внешней мембране хлоропласта. [52]
Toc159, вероятно, работает во многом аналогично Toc34, распознавая белки в цитозоле с помощью GTP . Его можно регулировать посредством фосфорилирования , но с помощью другой протеинкиназы , отличной от той, которая фосфорилирует Toc34. [45] Его М-домен образует часть туннеля, по которому проходят пребелки хлоропластов, и, по-видимому, обеспечивает силу, которая проталкивает пребелки, используя энергию ГТФ . [42]
Toc159 не всегда обнаруживается как часть комплекса TOC — его также обнаруживают в растворенном виде в цитозоле . Это предполагает, что он может действовать как челнок, который находит пребелки хлоропластов в цитозоле и переносит их обратно в комплекс ТОС. Однако прямых доказательств такого поведения не так много. [42]
Семейство белков Toc159: Toc159, Toc132, Toc120 и Toc90 было обнаружено у Arabidopsis thaliana . Они различаются по длине своих A-доменов, которых в Toc90 полностью нет. Toc132, Toc120 и Toc90, похоже, имеют специализированные функции по импорту таких веществ, как нефотосинтетические пребелки, и не могут заменить Toc159. [42]

Toc75 является наиболее распространенным белком на внешней оболочке хлоропласта. Это трансмембранная трубка, которая образует большую часть самой поры ТОС. Toc75 представляет собой β-цилиндрический канал, выстланный 16 β-складчатыми пластинками . [42] Отверстие, которое оно образует, имеет ширину около 2,5 нанометра на концах и сужается до 1,4–1,6 нанометра в диаметре в самом узком месте — достаточно широкой, чтобы позволить частично свернутым пребелкам хлоропласта пройти через него. [42]
Toc75 также может связываться с пребелками хлоропластов, но делает это намного хуже, чем Toc34 или Toc159. [42]
Arabidopsis thaliana имеет несколько изоформ Toc75, названия которых соответствуют хромосомным положениямкодирующих их генов . AtToc75 III является наиболее распространенным из них. [42]
Транслокон TIC , или транслокон на внутренней мембране хлоропласта , транслокон [42] представляет собой еще один белковый комплекс, который импортирует белки через внутреннюю оболочку хлоропласта . Полипептидные цепи хлоропластов, вероятно, часто проходят через два комплекса одновременно, но комплекс TIC также может восстанавливать пребелки, потерянные в межмембранном пространстве . [42]
Как и транслокон TOC, транслокон TIC имеет большой основной комплекс , окруженный некоторыми слабо связанными периферическими белками, такими как Tic110, Tic40 и Tic21. [53] Основной комплекс весит около миллиона дальтон и содержит Tic214, Tic100, Tic56 и Tic20 I, возможно, по три каждого. [53]
Tic20 представляет собой интегральный белок, имеющий четыре трансмембранные α-спирали . [42] Он обнаружен в комплексе TIC массой 1 миллион дальтон . [53] Поскольку он подобен бактериальным переносчикам аминокислот и белку импорта митохондрий Tim17 [ 42 ] ( транслоказа на внутренней митохондриальной мембране ), [ 54] было предложено быть частью канала импорта TIC . [42] Однако доказательств этого in vitro нет . [42] Известно, что у Arabidopsis thaliana примерно на каждые пять белков Toc75 во внешней мембране хлоропласта приходится два белка Tic20 I (основная форма Tic20 у Arabidopsis ) во внутренней мембране хлоропласта. [53]
В отличие от Tic214, Tic100 или Tic56, Tic20 имеет гомологичных родственников среди цианобактерий и почти всех линий хлоропластов, что позволяет предположить, что он развился до первого эндосимбиоза хлоропластов. Tic214, Tic100 и Tic56 уникальны для хлоропластов хлоропластидана , что позволяет предположить, что они развились позже. [53]
Tic214 — это еще один белок ядра комплекса TIC, названный так потому, что он весит чуть менее 214 килодальтон . Его длина составляет 1786 аминокислот , и считается, что на его N- конце имеется шесть трансмембранных доменов . Tic214 примечателен тем, что кодируется ДНК хлоропластов, а точнее первой открытой рамкой считывания ycf1 . Tic214 и Tic20 вместе, вероятно, составляют часть комплекса TIC размером в один миллион дальтон , который охватывает всю мембрану . Tic20 скрыт внутри комплекса, тогда как Tic214 открыт по обе стороны внутренней мембраны хлоропласта . [53]
Tic100 — это белок , кодируемый ядерным кодом , длиной 871 аминокислота . Все 871 аминокислота в совокупности весят чуть меньше 100 тысяч дальтон , и поскольку зрелый белок, вероятно, не теряет ни одной аминокислоты при импорте в хлоропласт (у него нет расщепляемого транзитного пептида ), он получил название Tic100. Tic100 находится по краям комплекса массой 1 миллион дальтон на стороне, обращенной к межмембранному пространству хлоропластов . [53]
Tic56 также является белком , кодируемым ядром . Препротеин , кодируемый его геном, имеет длину 527 аминокислот и весит около 62 тысяч дальтон ; зрелая форма, вероятно, подвергается обработке, которая уменьшает ее массу до 56 тысяч дальтон, когда она импортируется в хлоропласт. Tic56 в значительной степени встроен в комплекс массой 1 миллион дальтон. [53]
Tic56 и Tic100 высоко консервативны среди наземных растений, но они не похожи ни на один белок, функция которого известна. Ни один из них не имеет трансмембранных доменов . [53]
количество копий цДНК на хлоропласт.