
Теория растворов Флори-Хаггинса представляет собой решетчатую модель термодинамики растворов полимеров , которая учитывает большое различие размеров молекул при адаптации обычного выражения для энтропии смешения . В результате получается уравнение изменения свободной энергии Гиббса при смешивании полимера с растворителем . Хотя он делает упрощающие предположения, он дает полезные результаты для интерпретации экспериментов.
Термодинамическое уравнение изменения энергии Гиббса при смешивании при постоянной температуре и (внешнем) давлении имеет вид
Изменение, обозначаемое , представляет собой значение переменной для раствора или смеси за вычетом значений для чистых компонентов, рассматриваемых отдельно. Цель состоит в том, чтобы найти явные формулы для и приращений энтальпии и энтропии , связанных с процессом смешивания .
Результат, полученный Флори [1] и Хаггинсом [2], таков:
Правая часть — функция количества молей и объемной доли растворителя ( компонента ) , количества молей и объемной доли полимера (компонента ), с введением параметра для учета энергии взаимодиспергирующего полимера. и молекулы растворителя. – газовая постоянная , – абсолютная температура . Объемная доля аналогична мольной доле , но взвешена с учетом относительных размеров молекул. Для небольшого растворенного вещества вместо этого появятся мольные доли, и эта модификация является новшеством Флори и Хаггинса. В наиболее общем случае параметр смешивания представляет собой параметр свободной энергии, включающий, таким образом, энтропийную составляющую. [1] [2]
Сначала мы вычисляем энтропию смешивания , увеличение неопределенности относительно местоположения молекул при их рассредоточении. В чистых конденсированных фазах — растворителе и полимере — куда бы мы ни посмотрели, мы находим молекулу. [3] Конечно, любая идея «найти» молекулу в заданном месте — это мысленный эксперимент , поскольку мы на самом деле не можем исследовать пространственные местоположения размером с молекулу. Выражение энтропии смешения малых молекул в мольных долях больше не является разумным, когда растворенное вещество представляет собой макромолекулярную цепь . Мы учитываем эту диссимметрию размеров молекул, предполагая, что отдельные сегменты полимера и отдельные молекулы растворителя занимают узлы в решетке . Каждый узел занят ровно одной молекулой растворителя или одним мономером полимерной цепи, поэтому общее число узлов равно
– количество молекул растворителя и – количество молекул полимера, каждая из которых имеет сегменты. [4]
Для случайного блуждания по решетке [3] мы можем рассчитать изменение энтропии (увеличение пространственной неопределенности ) в результате смешивания растворенного вещества и растворителя.
где – постоянная Больцмана . Определите объемные доли решетки и
Это также вероятности того, что данный узел решетки, выбранный случайно , занят молекулой растворителя или сегментом полимера соответственно. Таким образом
Для небольшого растворенного вещества, молекулы которого занимают всего один узел решетки, равный одному, объемные доли уменьшаются до молекулярных или мольных долей , и мы восстанавливаем обычную энтропию смешения .
Помимо энтропийного эффекта, мы можем ожидать изменения энтальпии . [5] Следует учитывать три молекулярных взаимодействия: растворитель-растворитель , мономер-мономер (не ковалентная связь , а между разными участками цепи) и мономер-растворитель . Каждый из последних происходит за счет среднего значения двух других, поэтому приращение энергии на контакт мономер-растворитель составляет
Общее количество таких контактов
где – координационное число, число ближайших соседей узла решетки, каждый из которых занят либо одним сегментом цепи, либо молекулой растворителя. То есть, каково общее количество полимерных сегментов (мономеров) в растворе, равно и число ближайших соседей ко всем полимерным сегментам. Умножив на вероятность того, что любой такой сайт занят молекулой растворителя, [6] получим общее число молекулярных взаимодействий полимер-растворитель. Следуя этой процедуре, делается аппроксимация в соответствии с теорией среднего поля , тем самым сводя сложную проблему многих взаимодействий к более простой проблеме одного взаимодействия.
Изменение энтальпии равно изменению энергии на взаимодействие мономера полимера с растворителем, умноженному на количество таких взаимодействий.
Параметр взаимодействия полимер-растворитель chi определяется как
Он зависит от природы растворителя и растворенного вещества и является единственным параметром модели , зависящим от материала . Изменение энтальпии становится
С точки зрения ассемблера, полное изменение свободной энергии равно
где мы преобразовали выражение из молекул в моли и переведя константу Авогадро в газовую постоянную .
Значение параметра взаимодействия можно оценить по параметрам растворимости Хильдебранда и
где – реальный объем полимерного сегмента.
В наиболее общем случае взаимодействие и возникающий в результате параметр смешивания , являются параметром свободной энергии и, таким образом, включают энтропийную составляющую. [1] [2] Это означает, что помимо обычной энтропии смешения существует еще один энтропийный вклад от взаимодействия растворителя и мономера. Этот вклад иногда очень важен для количественного предсказания термодинамических свойств.
Существуют более продвинутые теории решения, такие как теория Флори – Кригбаума.
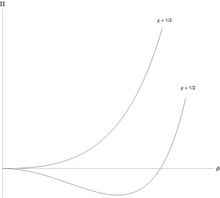
Полимеры могут отделяться от растворителя, и делают это характерным образом. [4] Свободную энергию Флори-Хаггинса на единицу объема для полимера с мономерами можно записать в простой безразмерной форме.
для объемной доли мономеров и . Осмотическое давление (в приведенных единицах) равно .
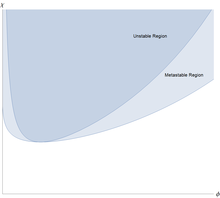
Раствор полимера устойчив по отношению к небольшим колебаниям, когда вторая производная этой свободной энергии положительна. Эта вторая производная
и решение сначала становится неустойчивым, когда и эта, и третья производная равны нулю. Затем немного алгебры показывает, что раствор полимера сначала становится нестабильным в критической точке при
Это означает, что при всех значениях взаимодействия мономер-растворитель эффективное взаимодействие является слабоотталкивающим, но оно слишком слабое, чтобы вызвать разделение жидкость/жидкость. Однако при этом происходит разделение на две сосуществующие фазы, одна из которых богаче полимером, но беднее растворителем, чем другая.
Необычной особенностью разделения фаз жидкость/жидкость является то, что оно сильно асимметрично: объемная доля мономеров в критической точке составляет примерно 0,000 , что очень мало для крупных полимеров. Количество полимера в сосуществующей фазе с высоким содержанием растворителя и низким содержанием полимера чрезвычайно мало для длинных полимеров. Фаза, обогащенная растворителем, близка к чистому растворителю. Это свойственно полимерам, смесь малых молекул можно аппроксимировать выражением Флори-Хаггинса с , и тогда и обе сосуществующие фазы далеко не чистые.
Синтетические полимеры редко состоят из цепей одинаковой длины в растворителе. Плотность свободной энергии Флори-Хаггинса можно обобщить [5] на N-компонентную смесь полимеров с длиной
Для бинарной полимерной смеси , где один вид состоит из мономеров, а другой из мономеров, это упрощается до
Как и в случае с разбавленными растворами полимеров, первые два члена в правой части представляют собой энтропию смешения. Для крупных полимеров эти члены пренебрежимо малы. Это означает, что для существования стабильной смеси , а также для смешивания полимеров A и B, их сегменты должны притягиваться друг к другу. [6]
Теория Флори-Хаггинса имеет тенденцию хорошо согласовываться с экспериментами в режиме полуразбавленной концентрации и может использоваться для подбора данных для еще более сложных смесей с более высокими концентрациями. Теория качественно предсказывает разделение фаз, тенденцию к несмешиванию высокомолекулярных частиц, зависимость взаимодействия от температуры и другие особенности, обычно наблюдаемые в полимерных смесях. Однако немодифицированная теория Флори-Хаггинса не может предсказать более низкую критическую температуру растворения , наблюдаемую в некоторых полимерных смесях, и отсутствие зависимости критической температуры от длины цепи . [7] Кроме того, можно показать, что для бинарной смеси полимеров с одинаковой длиной цепи критическая концентрация должна составлять ; однако наблюдались смеси полимеров, в которых этот параметр сильно асимметричен. В некоторых смесях энтропия смешения может доминировать над взаимодействием мономеров. Приняв приближение среднего поля, была исключена сложная зависимость параметров от температуры , состава смеси и длины цепи. В частности, взаимодействия за пределами ближайшего соседа могут иметь большое значение для поведения смеси, а распределение сегментов полимера не обязательно является однородным, поэтому в определенных узлах решетки могут возникать энергии взаимодействия, отличные от тех, которые аппроксимируются теорией среднего поля.
Одним из хорошо изученных [4] [6] эффектов на энергии взаимодействия, которым пренебрегает немодифицированная теория Флори Хаггинса, является цепная корреляция. В разбавленных полимерных смесях, где цепи хорошо разделены, внутримолекулярные силы между мономерами полимерной цепи доминируют и вызывают расслоение, приводящее к образованию областей с высокой концентрацией полимера. По мере увеличения концентрации полимера цепи имеют тенденцию перекрываться, и эффект становится менее значимым. Фактически, граница между разбавленными и полуразбавленными растворами обычно определяется концентрацией, при которой полимеры начинают перекрываться, что можно оценить как
Здесь m — масса одной полимерной цепи, а — радиус вращения цепи .