Babesia , [3] [4] также называемая Nuttallia , [5] является апикомплексным паразитом, который заражает красные кровяные клетки и передается клещами . Первоначально обнаруженный румынским бактериологом Виктором Бабешем в 1888 году, с тех пор было идентифицированоболее 100 видов Babesia . [6] [7]
Бабезия объединяет более 100 видов паразитов, переносимых клещами, которые заражают эритроциты (красные кровяные клетки) у многих позвоночных хозяев. [8]
Виды бабезии поражают домашний скот по всему миру, диких и домашних позвоночных животных, а иногда и людей, вызывая у них заболевание бабезиоз . [9] [7] В Соединенных Штатах B. microti является наиболее распространенным штаммом из немногих, которые, как было задокументировано, вызывают заболевания у людей.

Babesia — это простейший паразит, который, как установлено, заражает позвоночных животных, в основном домашний скот, млекопитающих и птиц, но иногда и людей. Распространенные названия болезни, которую вызывает Babesia microti , — техасская лихорадка крупного рогатого скота, лихорадка Редуотер, клещевая лихорадка и лихорадка Нантакета. [7] Заболевание, которое она вызывает у людей, бабезиоз, также называется пироплазмозом. [9]
Однако Babesia microti не является частью рода Babesia . Из-за исторических ошибок в классификации простейшее было помечено многими названиями, включая Nuttallia, [5] и было переименовано из Babesia microti в Theileria microti на основе доказательств 2006 года. Его генетическая последовательность , опубликованная в 2012 году, показывает, что вид не принадлежит ни к Babesia , ни к Theileria, а вместо этого к отдельному роду. [10] Другая «западная» группа также отделена от основного Babesia . [2]
Виды бабезий птиц характеризуются наличием кольцевых и амебоидных форм, а также веерообразных или крестообразных (крестообразных) тетрадных шизонтов . Развитие паразитов было отмечено только в эритроцитах. [11]
На протяжении столетий эта болезнь животных считалась серьезным заболеванием для диких и домашних животных, особенно крупного рогатого скота. В 1888 году Виктор Бабеш впервые идентифицировал возбудителя в Румынии и считал, что он вызван бактерией, которую он назвал Haematococcus bovis . Он задокументировал болезнь, описав признаки тяжелой гемолитической болезни, наблюдаемой исключительно у крупного рогатого скота и овец. [7] [12]
В 1893 году американцы Теобальд Смит и Фред Килборн определили паразита как причину техасской лихорадки крупного рогатого скота, той же болезни, которую описал Бабеш. Они также определили клеща как передающего агента, открытие, которое впервые ввело концепцию членистоногих, функционирующих как переносчики болезней . [13]
Считалось, что это болезнь, которая поражает только млекопитающих, не являющихся людьми, но в 1957 году был зафиксирован первый случай бабезиоза у человека. [9] Человеку была сделана спленэктомия , как и всем людям, у которых диагностировали бабезиоз до 1969 года, когда первый случай бабезиоза был диагностирован у человека, у которого все еще была селезенка . Это доказало, что паразит был потенциальным патогеном для любого человека. [14]
Babesia проявляет специфичность к хозяину , что позволяет появиться многим различным подвидам Babesia , каждый из которых заражает различные виды позвоночных. [15] В то время как B. bovis и Babesia bigemina предпочитают заражать крупный рогатый скот в тропических условиях, они могут заражать и других животных, таких как белохвостый олень . [15] Таким образом, хотя организм обладает способностью проявлять специфичность к хозяину и, таким образом, увеличивать эффективность передачи, он все равно может заражать различных хозяев. [15] Это достигается посредством мутаций и естественного отбора. В различных условиях отдельные простейшие могут развивать мутации, которые, когда они увеличивают приспособленность простейших , позволяют популяции увеличивать свою численность. Эта специфичность объясняет, почему у Babesia такое большое генетическое разнообразие. [15]
Babesia эгоистично сохраняется в организме хозяина в течение длительного времени: хозяин не получает никакой выгоды от вторжения паразита и только страдает. Это позволяет паразиту использовать все ресурсы, предлагаемые хозяином, увеличиваться в числе и увеличивать скорость передачи. [15] Слишком смертельная инфекция приводит к смерти хозяина, и паразит не может распространяться, что является потерей с эволюционной точки зрения. [15] Различные виды Babesia способны выдерживать стресс иммунной системы хозяина. Инфекция обычно стимулирует врожденную иммунную систему , а не гуморальную иммунную систему . [15] Это приводит к контролю над инфекцией, но также к персистенции, а не к выведению паразита. [15]
Геном B. microti был секвенирован и показал, что этот вид не принадлежит ни к Babesia , ни к Theileria, а к отдельному роду. [10] По состоянию на 2013 год [обновлять]известно, что митохондриальный геном является линейным, как и другие секвенированные митохондриальные геномы Apicomplexa , хотя первоначально сообщалось, что он является кольцевым. [16]
Частичное секвенирование РНК пироплазм собак позволило идентифицировать ряд дополнительных видов. [ необходима ссылка ]
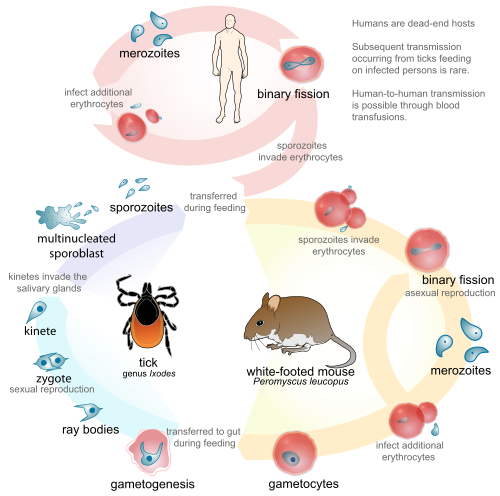
Жизненный цикл B. microti , типичный для паразитов этого рода, требует биологической стадии в хозяине -грызуне или олене . Он передается клещами семейства Ixodidae между этими хозяевами. Для начала клещ как окончательный хозяин сам заражается, поскольку он захватывает гаметоциты при прикреплении для питания кровью. Он также вводит Babesia в промежуточного хозяина (например, крупный рогатый скот) при питании кровью. Когда Babesia попадает в красные кровяные клетки животного (эритроциты), они называются спорозоитами . Внутри эритроцита простейшие становятся циклическими и развиваются в трофозоитное кольцо. Трофозоиты линяют в мерозоиты , которые имеют тетрадную структуру, придуманную как форма мальтийского креста . [17] Рост трофозоитов и мерозоитов разрывает эритроцит хозяина, что приводит к высвобождению вермикул, инфекционных паразитических тел, которые быстро распространяют простейших по всей крови. [9] Вместо того, чтобы производить все больше и больше трофозоитов, некоторые из мерозоитов производят гаметоциты . Гаметы оплодотворяются в кишечнике клеща и развиваются в спорозоиты в слюнных железах. Это спорозоиты, которые зараженный клещ вводит, когда кусает промежуточного хозяина. Даже в качестве случайного хозяина фазовые изменения, которые происходят у паразита, у людей такие же, как и у биологических хозяев. Бабезия может быть диагностирована на стадии трофозоита, и также может передаваться от человека к человеку через клеща-переносчика, через переливание крови или через врожденную передачу (от инфицированной матери к своему ребенку). [18] [6]
Холодная погода полностью прерывает передачу. [19] Было обнаружено, что возникновение клещевых заболеваний совпадает с изменением климата. [20] Известно, что корреляция между изменением климата и заболеваемостью клещевыми заболеваниями недостаточно сильна, чтобы считаться основным фактором. [20]
Высокая влажность и количество осадков способствуют появлению клещей, переносящих Babesia . [21] Это может объяснить, почему инфекция B. bigemina у крупного рогатого скота в холмистом регионе Мегхалая увеличилась. [21] Продолжительность жизни и количество поколений Babesia microplus коррелируют с увеличением продолжительности жизни личинок и количеством ежегодных поколений. [21] Теплая сухая погода мешает жизненному циклу Babesia внутри клеща. [19] Теплая влажная погода увеличивает интенсивность заражения — популяция может процветать благодаря относительно текучей среде, что делает воду и питательные вещества более доступными. [19]
Виды Babesia распространяются через слюну клеща при укусе. Уже на стадии нимфы клещ впивается в кожу для питания кровью. Клещ, если его не удалить, остается прикрепленным в течение трех-четырех дней, причем более длительные периоды питания связаны с более высокой вероятностью приобретения паразита. Паразит может выживать в клеще, пока он линяет на различных стадиях развития, в результате чего все стадии клеща являются потенциально заразными. Некоторые виды Babesia могут передаваться от самки клеща ее потомству, прежде чем мигрировать в слюнные железы для питания. [9] B. microti , наиболее распространенный вид у людей, не был показан для передачи трансовариально . [6]
Клещи домашних животных , которые переносят бабезию и вызывают множество заболеваний, включают очень распространенных клещей крупного рогатого скота, Rhipicephalus (Boophilus) microplus и R.(B.) decoloratus . У этих клещей строгий цикл питания одним хозяином на крупном рогатом скоте, поэтому бабезия может передаваться только трансовариальным путем.
В Америке наиболее распространенным переносчиком является Ixodes scapularis . Этот твердый клещ, обычно известный как олений клещ, также является переносчиком других заболеваний, связанных с клещами, таких как болезнь Лайма . Многие виды Babesia заражают только млекопитающих, не являющихся людьми, чаще всего крупный рогатый скот, лошадей и овец. B. microti и B. divergens являются двумя основными патогенными видами у людей. Предполагается, что их резервуарами являются белоногая мышь ( Peromyscus leucopus ), полевки из рода Microtus и белохвостый олень ( Odocoileus virginianus ). [22] Эти лесные виды являются предполагаемыми резервуарами, поскольку, хотя известно, что они являются переносчиками заболевания, полная компетентность резервуара еще не доказана. [23]
Большинство случаев передачи от человека к человеку приписывается клещу-переносчику. По состоянию на 2003 год Центры по контролю и профилактике заболеваний (CDC) признали более 40 случаев бабезиоза, полученных при переливании эритроцитарной массы (PRBC), а также два случая заражения при трансплантации органов. Переливания PRBC, вызывающие инфекции, были выявлены путем тестирования донора крови на антитела B. microti . [24] Распространение передачи бабезии через переливание PRBC крови оказывает давление на правительственные организации (такие как CDC) с целью ужесточения стандартных мер по скринингу донорской крови . [ необходима цитата ]
Передача также возможна через врожденную передачу (от инфицированной матери к ее ребенку). Поскольку симптомы могут не проявляться, многие женщины могут не знать, что они инфицированы во время беременности, и поэтому измерение частоты врожденной передачи на данный момент неизвестно. [18]
В настоящее время переносчики птичьей бабезии не выявлены, но предполагается, что ими являются клещи. [11] Виды бабезии требуют компетентных позвоночных и беспозвоночных хозяев для поддержания циклов передачи. [25]
Из всех видов, инфицирующих людей, B. microti наиболее распространен в Америке, тогда как B. divergens является преобладающим штаммом, обнаруженным в Европе. Эндемичные районы — это регионы обитания клещей, включая лесные районы северо-востока США и умеренные регионы Европы. [26] Ixodidae, клещевые переносчики B. microti , также передают более известную Borrelia burgdorferi , возбудителя болезни Лайма. По причинам, которые остаются неясными, в районах, эндемичных как по болезни Лайма, так и по бабезиозу, преобладает передача болезни Лайма, и она более распространена в регионе. [9] Распространенность бабезиоза в эндемичных по малярии регионах остается неизвестной из-за вероятности ошибочной диагностики как малярии. [27] Поскольку заболевание приводит к большому числу бессимптомных лиц, многие популяции могут обладать высокой серопревалентностью без особой документации о заболевании. Например, в Род-Айленде и Нантакете серопревалентность была измерена на уровне 20–25%. [9] Распространенность бабезиоза в основном документируется в период с мая по сентябрь, когда активность клещей в эндемичных регионах высока. [26]
Существует 15 видов Babesia, относящихся к птицам, и четыре Babesia были обнаружены у морских хозяев. Babesia poelea была описана у бурых олуш ( Sula leucogaster ) на острове Сэнд, атолл Джонстон, центральная часть Тихого океана. [28] B. poelea была обнаружена у маскированной олуши ( Sula dactylatra melanops ) с острова Десноф , Амирантские острова , Сейшельские острова . [29] Babesia peircei была обнаружена у 2 видов пингвинов: пингвина-осла ( Sphenicus demersus ) из Южной Африки и малого пингвина ( Eduyptula minor ) из южной Австралии. [30] [31] Babesia bennetti была обнаружена у желтоногой чайки ( Larus cachinnans ) с острова Бенидорм у побережья Испании. [31] Babesia uriae была обнаружена у тонкоклювых кайр в Калифорнии.
В Европе было зарегистрировано около 40 случаев бабезиоза человека, вызванного интраэритроцитарными простейшими (простейшими внутри эритроцитов) рода Babesia . [32]
Бабезиоз крупного рогатого скота, вызываемый B. bovis, является серьезным препятствием для животноводства во всем мире. [ необходима ссылка ]
Признаки заражения B. microti обычно возникают через одну-восемь недель после укуса инфекционного клеща. [26] Инфекции, вызванные B. divergens , имеют более короткий латентный период, обычно от одной до трех недель. [27] Тяжесть заражения B. microti варьируется. В 25% случаев у взрослых и 50% случаев у детей заболевание протекает бессимптомно или в легкой форме с симптомами, похожими на грипп. В других случаях симптомы характеризуются нерегулярной лихорадкой, ознобом, головными болями, общей вялостью, болью и недомоганием . [9] В тяжелых случаях были зарегистрированы последствия размножения паразитов, такие симптомы, как гемолитическая анемия , желтуха , одышка и гемоглобинурия . [7] [27] Люди с нормальной иммунной функцией и здоровой селезенкой часто выздоравливают без лечения. [9]
Пациенты, перенесшие спленэктомию, более восприимчивы к заражению этой болезнью и могут умереть в течение пяти-восьми дней с момента появления симптомов. [26] У них тяжелая гемолитическая анемия, а также иногда регистрируется гепатомегалия . Уровень паразитемии может достигать 85% у пациентов без селезенки по сравнению с 1–10% у лиц с селезенкой и эффективной иммунной системой. [27]
Осложнения включают острую дыхательную недостаточность , застойную сердечную недостаточность и почечную недостаточность . Инфекции могут быть смертельными у 5–10% госпитализированных пациентов, с повышенным риском смерти у иммунодефицитных , пожилых людей и тех, кто также инфицирован болезнью Лайма . [27] Инфекции B. divergens имеют гораздо более высокий уровень смертности (42%) и проявляются более тяжелыми симптомами. Инфицированные люди испытывают гемоглобинурию, за которой следует желтуха, постоянно высокая температура, озноб и потливость. Если их не лечить, инфекции B. divergens могут развиться в симптомы, похожие на шок, с отеком легких и почечной недостаточностью. [27]
У птиц
Патогенность B. uriae для кайр в настоящее время неизвестна. У птиц были обнаружены поражения , анемия и затрудненное дыхание, а также были поражены ткани птиц-хозяев. [11] Инфекции Babesia peircei могут вызывать легкую анемию, лейкоцитоз и нарушение функции печени у африканских пингвинов . [33]
Поскольку бабезия является простейшим паразитом, наиболее эффективным способом выявления инфекции является анализ крови .
Виды Babesia проникают в эритроциты (эритроциты) на стадии спорозоита. Внутри эритроцита простейшие становятся циклическими и развиваются в кольцо трофозоита. Трофозоиты линяют в мерозоиты, которые имеют тетрадную структуру, называемую формой мальтийского креста . [17] Эта тетрадная морфология, наблюдаемая при окрашивании тонкого мазка крови по Гимзе, уникальна для Babesia и отличает ее от Plasmodium falciparum , простейшего со схожей морфологией, вызывающего малярию. Рост трофозоита и мерозоита разрывает эритроцит хозяина, что приводит к высвобождению вермикул, инфекционных паразитических тел, которые быстро распространяют простейших по всей крови. [9] Важно обращать внимание на особую морфологию Babesia в мазках крови из-за ее большого сходства с малярийным паразитом Plasmodium falciparum . Это привело к тому, что многим пациентам с бабезиозом был поставлен неправильный диагноз. Несколько отличительных факторов для Babesia включают простейших с различными формами и размерами, потенциал содержать вакуоли и отсутствие пигментной продукции. Трофозоиты, появляющиеся в тетрадном образовании внутри эритроцита, также указывают на Babesia . [ необходима цитата ]
Несмотря на многочисленные исследования бабезиоза и малярии, ошибочная диагностика с помощью мазка крови может быть частой и проблематичной. В дополнение к мазку крови, диагнозы следует ставить с помощью непрямого флуоресцентного теста на антитела (IFA). Тестирование IFA имеет гораздо более высокую специфичность , чем окрашенные мазки крови, с обнаружением антител у 88-96% инфицированных пациентов. [6] Диагностические меры с помощью тестирования на антитела также особенно полезны для определения распространенности сыворотки у бессимптомных лиц. Из-за способности Babesia передаваться через переливание крови, тестирование IFA будет эффективным средством скрининга на заболевание в донорской крови.
Исторически диагностика бабезиоза проводилась с помощью ксенодиагностики у хомяков на B. microti и у песчанок на B. divergens . [9] От этого диагностического метода отказались в пользу более быстрых диагностических мер.
Существует несколько методов лечения и контроля бабезиоза у животных. [ необходима ссылка ]
У людей многие спонтанно выздоравливают, испытывая только легкие симптомы, не диагностированные как болезнь. Это почти всегда наблюдается при инфекциях B. microti , которые, как правило, более распространены в Соединенных Штатах. Для B. divergens и более тяжелых инфекций B. microti стандартным лечением для симптоматических лиц исторически был пероральный или внутривенный клиндамицин с пероральным хинином . [6] Однако с результатами исследований, завершенных в 2000 году, схемы лечения все больше склоняются к пероральному атовакуону с пероральным азитромицином . Последние являются предпочтительными, поскольку они одинаково эффективны во всех случаях, кроме самых тяжелых, и вызывают меньше сопутствующих побочных реакций . [34] В тяжелых случаях для снижения паразитарной нагрузки у человека проводились обменные переливания крови . [9] Другие меры включают устранение и коррекцию аномальных клинических признаков. [7]
У морских птиц примахин использовался в исследовании, чтобы показать эффективное лечение инфицированных хозяев. [35] Лечение бабезиоза состояло из примахина (1 мг/кг перорально каждые 24 часа в течение 10 дней; примахина фосфат 1,76% м/об в стабилизированном растворе, Primaquin Solution, MedPet Ltd, Benrose , Южная Африка). После этого лечение сопровождалось фосфолипидной добавкой (1 капсула/птица перорально каждые 24 часа в течение 12 дней; обезжиренные, обогащенные фосфолипиды из соевых бобов, 300 мг/капсула, Essentiale Extreme, Sanofi Aventis Ltd, Мидранд , Южная Африка); как попытка смягчить потенциальные гепатотоксические эффекты примахина. Для предотвращения передачи бабезии и других клещевых патогенов всех птиц с видимыми эктопаразитами обрабатывают пестицидным порошком ( карбарил 50 г/кг) при поступлении, а помещения тщательно убирают ежедневно. [35]
В 1906 году в США были предприняты попытки искоренить клеща — переносчика бычьего бабезиоза. Спустя четыре десятилетия эта ликвидация была успешно завершена. [7]
Эффективный контроль может быть достигнут путем вакцинации живыми ослабленными фенотипами паразита. Вакцины имеют ряд недостатков, поэтому лучшие, более безопасные вакцины все еще исследуются. [ необходима цитата ] В последние [ когда? ] годы был обнаружен ряд паразитарных белков с иммуногенным потенциалом. С помощью полимеразной цепной реакции , генетического секвенирования и биоинформатического анализа генов была обнаружена высокая степень консервации (98–100%) среди бразильских изолятов B. bovis и изолята T2Bo. Таким образом, эти гены рассматриваются для включения в рекомбинантную коктейльную вакцину против бабезиоза крупного рогатого скота, вызванного B. bovis . [ необходима цитата ]
Наиболее эффективной мерой общественного здравоохранения для Babesia является предотвращение контакта с клещами. Это может быть сделано посредством личной профилактики, такой как избегание территорий, зараженных клещами (особенно в высокий сезон клещей с мая по сентябрь), ношение легкой одежды, поиск клещей после пребывания на открытом воздухе и удаление обнаруженных клещей с кожи. [27] Другие меры включают применение ДЭТА , распространенного репеллента, который эффективен против клещей и насекомых. (Людям, которые негативно реагируют на ДЭТА, следует использовать альтернативные репелленты от насекомых.) На уровне штата, если департаменты здравоохранения особенно мотивированы, уничтожение клещей является возможным. В 1906 году были предприняты усилия по искоренению клещей — переносчиков бычьей формы бабезиоза в Соединенных Штатах. Это искоренение было зарегистрировано как успешно завершенное четыре десятилетия спустя. [7]
Полная ликвидация путем борьбы с переносчиками станет долгосрочным проектом, который значительно сократит распространенность как бабезиоза, так и болезни Лайма, но, поскольку департаменты общественного здравоохранения часто испытывают нехватку финансирования, более рекомендуются профилактические меры. [ необходима цитата ]
Из-за относительно низкой распространенности этого заболевания у людей и наличия нескольких резервуаров, бабезиоз не является кандидатом на вакцинацию. В регионах, где клещи домашних животных регулярно контролируются химическими акарицидами для снижения заболеваемости B. bovis и B. bigemina , риск для людей от этих паразитов будет снижен.
Рисунок 2. Панель электронных изображений, полученных с помощью компьютера, микрофотографий эритроцитов, инфицированных
Babesia,на
мазке периферической крови, окрашенном по Гимзе...