
Точка рестрикции ( R ), также известная как стартовая или контрольная точка G 1 /S , является контрольной точкой клеточного цикла в фазе G 1 цикла животных клеток , в которой клетка становится «приверженной» к клеточному циклу, и после которой внеклеточные сигналы больше не требуются для стимуляции пролиферации. [1] Определяющей биохимической особенностью точки рестрикции является активация комплексов циклин-CDK G 1 /S- и S-фазы , которые, в свою очередь, фосфорилируют белки, которые инициируют репликацию ДНК , дупликацию центросомы и другие ранние события клеточного цикла. [2] Это одна из трех основных контрольных точек клеточного цикла, две другие - контрольная точка повреждения ДНК G2-M и контрольная точка веретена .
Первоначально Говард Мартин Темин показал, что куриные клетки достигают точки, в которой они готовы реплицировать свою ДНК и не зависят от внеклеточных сигналов. [3] Примерно 20 лет спустя, в 1973 году, Артур Парди продемонстрировал, что в G 1 существует единственная точка рестрикции . Ранее G 1 определялась просто как время между митозом и S-фазой . Не было известно никаких молекулярных или морфологических маркеров положения клетки в G 1. Парди использовал метод двойного блока, в котором он перемещал клетки из одного блока клеточного цикла (например, критический отток аминокислот или отток сыворотки) в другой и сравнивал эффективность каждого блока в предотвращении перехода в S-фазу. Он обнаружил, что оба блока во всех исследованных случаях были одинаково эффективны в блокировании перехода в S-фазу, что указывает на то, что все они должны действовать в одной и той же точке в G 1 , которую он назвал «точкой рестрикции» или R-точкой. [4]
В 1985 году Зеттерберг и Ларссон обнаружили, что на всех стадиях клеточного цикла лишение сыворотки приводит к ингибированию синтеза белка. Только в постмитотических клетках (т. е. клетках в ранней фазе G 1 ) лишение сыворотки приводило клетки в состояние покоя ( G 0 ). Фактически, Зеттерберг обнаружил, что практически все различия в длине клеточного цикла можно объяснить временем, которое требуется клетке для перехода от точки рестрикции к фазе S. [5]
За исключением раннего эмбрионального развития, большинство клеток в многоклеточных организмах остаются в состоянии покоя, известном как G 0 , где пролиферация не происходит, и клетки обычно окончательно дифференцированы; другие специализированные клетки продолжают делиться во взрослом состоянии. Для обеих этих групп клеток было принято решение либо выйти из клеточного цикла и стать покоящимися (G 0 ), либо снова войти в G 1 .
Решение клетки войти или повторно войти в клеточный цикл принимается до S-фазы в G 1 в так называемой точке рестрикции и определяется комбинацией промотирующих и ингибирующих внеклеточных сигналов, которые принимаются и обрабатываются. До R-точки клетке требуются эти внеклеточные стимуляторы для начала прохождения первых трех подфаз G 1 (компетентность, вход G 1a , прогрессия G 1b ). Однако после прохождения R-точки в G 1b внеклеточные сигналы больше не требуются, и клетка необратимо готовится к дупликации ДНК . Дальнейшее продвижение регулируется внутриклеточными механизмами. Удаление стимуляторов до того, как клетка достигнет R-точки, может привести к возвращению клетки в состояние покоя. [1] [3] В этих условиях клетки фактически отбрасываются назад в клеточном цикле и потребуют дополнительного времени (примерно на 8 часов больше, чем время выведения в культуре) после прохождения точки рестрикции для входа в S-фазу. [3]
Митогенная сигнализация
Факторы роста (например, PDGF , FGF и EGF ) регулируют вступление клеток в клеточный цикл и прогрессирование до точки рестрикции. После прохождения этой подобной переключателю «точки невозврата» завершение клеточного цикла больше не зависит от присутствия митогенов. [6] [4] [7] Устойчивая передача сигналов митогенов способствует вступлению в клеточный цикл в основном за счет регуляции циклинов G1 (циклин D1-3) и их сборки с Cdk4/6, что может быть опосредовано параллельно как через пути MAPK, так и PI3K.
Сигнальный каскад MAPK
Связывание внеклеточных факторов роста с их рецепторными тирозинкиназами (RTK) запускает конформационные изменения и способствует димеризации и автофосфорилированию остатков тирозина на цитоплазматическом хвосте RTK. Эти фосфорилированные остатки тирозина облегчают стыковку белков, содержащих SH2-домен (например, Grb2 ), которые впоследствии могут привлекать другие сигнальные белки к плазматической мембране и запускать каскады сигнальных киназ. Grb2, ассоциированный с RTK, связывает Sos , который является фактором обмена гуаниновых нуклеотидов, который преобразует связанный с мембраной Ras в его активную форму (Ras-GDP Ras-GTP). [8] Активный Ras активирует каскад МАР-киназы, связывая и активируя Raf, который фосфорилирует и активирует MEK, который фосфорилирует и активирует ERK (также известный как MAPK, см. также путь MAPK/ERK ).
Затем активный ERK транслоцируется в ядро, где он активирует несколько мишеней, таких как фактор транскрипции сывороточного ответа (SRF), что приводит к экспрессии немедленных ранних генов, в частности, факторов транскрипции Fos и Myc . [8] [9] Димеры Fos/Jun составляют комплекс факторов транскрипции AP-1 и активируют гены отсроченного ответа, включая основной циклин G1 , циклин D1 . [8] Myc также регулирует экспрессию широкого спектра пропролиферативных и проростовых генов, включая некоторую индукцию циклина D2 и Cdk4 . [5] Кроме того, устойчивая активность ERK, по-видимому, важна для фосфорилирования и ядерной локализации CDK2 , [8] что дополнительно поддерживает прогрессирование через точку рестрикции.
Сигнализация пути PI3K
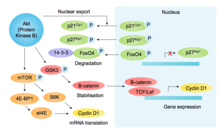
p85, другой белок, содержащий SH2-домен, связывает активированные RTK и рекрутирует PI3K (фосфоинозитид-3-киназу), фосфорилируя фосфолипид PIP2 в PIP3, что приводит к рекрутированию Akt (через его PH-домен). В дополнение к другим функциям, способствующим росту и выживанию, Akt ингибирует киназу гликогенсинтазы-3β ( GSK3β ), тем самым предотвращая фосфорилирование, опосредованное GSK3β, и последующую деградацию циклина D1 [10] ( см. рисунок [11] ). Akt далее регулирует компоненты G1/S посредством опосредованного mTOR продвижения трансляции циклина D1, [12] фосфорилирования ингибиторов Cdk p27 kip1 (предотвращая его ядерный импорт) и p21 Cip1 (снижая стабильность), а также инактивируя фосфорилирование фактора транскрипции FOXO4 (который регулирует экспрессию p27). [13] Вместе эта стабилизация циклина D1 и дестабилизация ингибиторов Cdk благоприятствует активности G1 и G1/S-Cdk.
Антимитогенная сигнализация
Антимитогены, такие как цитокин TGF-β, ингибируют прогрессирование через точку рестрикции, вызывая остановку G1. Сигнализация TGF-β активирует Smads, которые образуют комплекс с E2F4 /5 для подавления экспрессии Myc, а также связываются с Miz1 для активации экспрессии ингибитора Cdk p15 INK4b для блокирования образования и активности комплекса циклин D-Cdk. [8] [14] Клетки, остановленные TGF-β, также накапливают p21 и p27. [14]
Обзор
Как описано выше, сигналы от внеклеточных факторов роста передаются типичным образом. Фактор роста связывается с рецепторами на поверхности клетки, и множество каскадов фосфорилирования приводят к поглощению Ca 2+ и фосфорилированию белка. Уровни фосфопротеина уравновешиваются фосфатазами. В конечном итоге происходит транскрипционная активация определенных целевых генов. Внеклеточная сигнализация должна поддерживаться, и клетка также должна иметь доступ к достаточному количеству питательных веществ для поддержки быстрого синтеза белка. Накопление циклина D имеет важное значение. [15]
Циклин D-связанные Cdks 4 и 6 активируются Cdk-активирующей киназой и направляют клетку к точке рестрикции. Циклин D, однако, имеет высокую скорость оборота (t 1/2 <25 мин). Именно из-за этой быстрой скорости оборота клетка чрезвычайно чувствительна к уровням митогенной сигнализации, которые не только стимулируют выработку циклина D, но и помогают стабилизировать циклин D внутри клетки. [15] [16] Таким образом, циклин D действует как датчик митогенного сигнала. [16] Ингибиторы Cdk (CKI), такие как белки Ink4 и p21 , помогают предотвратить неправильную активность циклина-cdk.
Активные комплексы циклин D-cdk фосфорилируют белок ретинобластомы (pRb) в ядре. Нефосфорилированный Rb действует как ингибитор G 1 , предотвращая транскрипцию, опосредованную E2F . После фосфорилирования E2F активирует транскрипцию циклинов E и A. [15] [16] [17] Активный циклин E-cdk начинает накапливаться и завершает фосфорилирование pRb, как показано на рисунке. [18]
Ингибиторы Cdk и регуляция активности комплекса циклин D/Cdk
p27 и p21 являются стехиометрическими ингибиторами комплексов G1/S- и S-циклин-Cdk. В то время как уровни p21 увеличиваются во время входа в клеточный цикл, p27, как правило, инактивируется по мере того, как клетки переходят к позднему G1. [8] Высокая плотность клеток, голодание митогена и TGF-β приводят к накоплению p27 и остановке клеточного цикла. [14] Аналогично, повреждение ДНК и другие стрессоры увеличивают уровни p21, в то время как стимулированная митогеном активность ERK2 и Akt приводит к инактивации фосфорилирования p21. [19]
Ранние работы по сверхэкспрессии p27 предполагали, что он может связываться с комплексами циклин D-Cdk4/6 и комплексами циклин E/A-Cdk2 и ингибировать их in vitro и в отдельных типах клеток. [14] Однако кинетические исследования ЛаБаера и др. (1997) показали, что титрование в p21 и p27 способствует сборке комплекса циклин d-Cdk, увеличивая общую активность и ядерную локализацию комплекса. [20] Последующие исследования выяснили, что p27 может быть необходим для образования комплекса циклин D-Cdk, поскольку p27 -/- , p21 -/- MEF показали снижение комплексообразования циклин D-Cdk4, которое может быть восстановлено с помощью повторной экспрессии p27. [21]
Работа Джеймса и соавторов (2008) далее предполагает, что фосфорилирование остатков тирозина на p27 может переключать p27 между ингибирующим и неингибирующим состоянием при связывании с циклином D-Cdk4/6, предлагая модель того, как p27 способен регулировать как сборку, так и активность комплекса циклин-Cdk. [22] Ассоциация p27 с циклином D-Cdk4/6 может дополнительно способствовать прогрессированию клеточного цикла за счет ограничения пула p27, доступного для инактивации комплексов циклин E-Cdk2. [8] [23] Повышение активности циклин E-Cdk2 в поздней стадии G1 (и циклин A-Cdk2 в ранней стадии S) приводит к фосфорилированию p21/p27, что способствует их ядерному экспорту, убиквитинированию и деградации.
В статье, опубликованной группами Линчонга Ю и Джо Невинса в Университете Дьюка в 2008 году, было показано, что бистабильный гистерезисный переключатель E2F лежит в основе точки рестрикции. E2F способствует своей собственной активации, а также способствует ингибированию своего собственного ингибитора ( pRb ), образуя две петли обратной связи (среди прочих), которые важны для установления бистабильных систем. Авторы этого исследования использовали дестабилизированную систему GFP под контролем промотора E2F в качестве считывания активности E2F . Клетки с дефицитом сыворотки стимулировались различными концентрациями сыворотки, и считывание GFP регистрировалось на уровне отдельной клетки. Они обнаружили, что репортер GFP был либо включен, либо выключен, что указывает на то, что E2F был либо полностью активирован, либо деактивирован на всех различных проанализированных уровнях сыворотки. Дальнейшие эксперименты, в которых они анализировали зависимость системы E2F от истории, подтвердили, что она работает как гистерезисный бистабильный переключатель. [24]
Рак можно рассматривать как нарушение нормальной функции точки рестрикции, поскольку клетки постоянно и ненадлежащим образом повторно входят в клеточный цикл и не входят в G 0 . [1] Мутации на многих этапах пути к точке рестрикции могут привести к раковому росту клеток. Некоторые из генов, наиболее часто мутирующих при раке, включают Cdks и CKIs; сверхактивные Cdks или недостаточно активные CKIs снижают строгость точки рестрикции, позволяя большему количеству клеток обойти старение. [17]
Точка рестрикции является важным фактором при разработке новых лекарственных терапий. В нормальных физиологических условиях вся пролиферация клеток регулируется точкой рестрикции. Это можно использовать и использовать как способ защиты нераковых клеток от химиотерапевтического лечения. Химиотерапевтические препараты обычно атакуют клетки, которые быстро пролиферируют. При использовании препаратов, которые ингибируют завершение точки рестрикции, таких как ингибиторы рецепторов факторов роста , нормальные клетки не могут пролиферировать и, таким образом, защищены от химиотерапевтического лечения. [16]
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка )