
Электроотрицательность , обозначаемая как χ , является тенденцией атома данного химического элемента притягивать общие электроны (или электронную плотность ) при образовании химической связи . [1] Электроотрицательность атома зависит как от его атомного номера , так и от расстояния, на котором его валентные электроны находятся от заряженного ядра. Чем выше соответствующая электроотрицательность, тем больше атом или замещающая группа притягивают электроны. Электроотрицательность служит простым способом количественной оценки энергии связи , а также знака и величины химической полярности связи , которая характеризует связь по непрерывной шкале от ковалентной до ионной связи . Нестрого определяемый термин электроположительность является противоположностью электроотрицательности: он характеризует тенденцию элемента отдавать валентные электроны.
На самом базовом уровне электроотрицательность определяется такими факторами, как заряд ядра (чем больше протонов в атоме, тем большее «притяжение» он будет оказывать на электроны), а также числом и расположением других электронов в атомных оболочках (чем больше электронов в атоме, тем дальше от ядра будут находиться валентные электроны, и, как следствие, тем меньший положительный заряд они будут испытывать — как из-за их увеличенного расстояния от ядра, так и из-за того, что другие электроны на орбиталях ядра с более низкой энергией будут экранировать валентные электроны от положительно заряженного ядра).
Термин «электроотрицательность» был введен Йенсом Якобом Берцелиусом в 1811 году [2] , хотя эта концепция была известна и до этого и изучалась многими химиками, включая Авогадро . [2] Несмотря на свою долгую историю, точная шкала электроотрицательности не была разработана до 1932 года, когда Лайнус Полинг предложил шкалу электроотрицательности, которая зависит от энергии связи, как развитие теории валентных связей . [3] Было показано, что она коррелирует с рядом других химических свойств. Электроотрицательность не может быть измерена напрямую и должна быть рассчитана из других атомных или молекулярных свойств. Было предложено несколько методов расчета, и хотя могут быть небольшие различия в численных значениях электроотрицательности, все методы показывают одни и те же периодические тенденции между элементами . [4]
Наиболее часто используемый метод расчета — метод, первоначально предложенный Линусом Полингом. Он дает безразмерную величину , обычно называемую шкалой Полинга ( χ r ), в относительной шкале от 0,79 до 3,98 ( водород = 2,20). При использовании других методов расчета принято (хотя и не обязательно) приводить результаты в шкале, которая охватывает тот же диапазон числовых значений: это известно как электроотрицательность в единицах Полинга .
Как обычно рассчитывается, электроотрицательность не является свойством только атома, а скорее свойством атома в молекуле . [ 5] Тем не менее, электроотрицательность атома сильно коррелирует с первой энергией ионизации . Электроотрицательность слегка отрицательно коррелирует (для меньших значений электроотрицательности) и довольно сильно положительно коррелирует (для большинства и больших значений электроотрицательности) с электронным сродством . [6] Следует ожидать, что электроотрицательность элемента будет меняться в зависимости от его химического окружения, [7] но обычно ее считают переносимым свойством , то есть схожие значения будут действительны в различных ситуациях.
Наименее электроотрицательным элементом является цезий (0,79), наиболее электроотрицательным — фтор (3,98).
Полинг впервые предложил [3] концепцию электроотрицательности в 1932 году, чтобы объяснить, почему ковалентная связь между двумя различными атомами (A–B) сильнее, чем среднее значение связей A–A и B–B. Согласно теории валентных связей , известным сторонником которой был Полинг, эта «дополнительная стабилизация» гетероядерной связи обусловлена вкладом ионных канонических форм в связь.
Разница в электроотрицательности между атомами A и B определяется как: где энергии диссоциации , E d , связей A–B, A–A и B–B выражены в электронвольтах , фактор (эВ) − 1 ⁄ 2 включен для обеспечения безразмерного результата. Следовательно, разница в электроотрицательности Полинга между водородом и бромом составляет 0,73 (энергии диссоциации: H–Br, 3,79 эВ; H–H, 4,52 эВ; Br–Br 2,00 эВ)
Поскольку определены только различия в электроотрицательности, необходимо выбрать произвольную точку отсчета для построения шкалы. Водород был выбран в качестве точки отсчета, поскольку он образует ковалентные связи с большим количеством элементов: его электроотрицательность была сначала зафиксирована [3] на уровне 2,1, позже пересмотрена [8] до 2,20. Также необходимо решить, какой из двух элементов является более электроотрицательным (эквивалентно выбору одного из двух возможных знаков для квадратного корня). Обычно это делается с использованием «химической интуиции»: в приведенном выше примере бромистый водород растворяется в воде с образованием ионов H + и Br − , поэтому можно предположить, что бром более электроотрицателен, чем водород. Однако, в принципе, поскольку для любых двух связывающих соединений должны быть получены одинаковые электроотрицательности, данные фактически переопределены, и знаки являются уникальными, как только зафиксирована точка отсчета (обычно для H или F).
Для расчета электроотрицательности по Полингу для элемента необходимо иметь данные об энергиях диссоциации по крайней мере двух типов ковалентных связей, образованных этим элементом. AL Allred обновил исходные значения Полинга в 1961 году, чтобы учесть большую доступность термодинамических данных, [8] и именно эти «пересмотренные» значения электроотрицательности по Полингу используются чаще всего.
Существенным моментом электроотрицательности Полинга является то, что существует базовая, довольно точная, полуэмпирическая формула для энергий диссоциации, а именно: или иногда более точная подгонка
Это приближенные уравнения, но они выполняются с хорошей точностью. Полинг получил первое уравнение, отметив, что связь может быть приблизительно представлена как квантово-механическая суперпозиция ковалентной связи и двух ионных состояний связи. Ковалентная энергия связи является приблизительным, согласно квантово-механическим расчетам, геометрическим средним двух энергий ковалентных связей тех же молекул, и есть дополнительная энергия, которая исходит от ионных факторов, т. е. полярного характера связи.
Геометрическое среднее приблизительно равно арифметическому среднему — которое применяется в первой формуле выше — когда энергии имеют схожее значение, например, за исключением высокоэлектроположительных элементов, где существует большая разница двух энергий диссоциации; геометрическое среднее более точно и почти всегда дает положительную избыточную энергию из-за ионной связи. Квадратный корень из этой избыточной энергии, отмечает Полинг, приблизительно аддитивен, и, следовательно, можно ввести электроотрицательность. Таким образом, именно эти полуэмпирические формулы для энергии связи лежат в основе концепции электроотрицательности Полинга.
Формулы приблизительны, но это грубое приближение на самом деле относительно хорошее и дает правильную интуицию, с понятием полярности связи и некоторой теоретической основой в квантовой механике. Электроотрицательности затем определяются для наилучшего соответствия данным.
В более сложных соединениях есть дополнительная ошибка, поскольку электроотрицательность зависит от молекулярного окружения атома. Кроме того, оценка энергии может быть использована только для одинарных, но не для кратных связей. Энтальпия образования молекулы, содержащей только одинарные связи, может быть впоследствии оценена на основе таблицы электроотрицательности, и она зависит от компонентов и суммы квадратов разностей электроотрицательностей всех пар связанных атомов. Такая формула для оценки энергии обычно имеет относительную погрешность порядка 10%, но может быть использована для получения грубого качественного представления и понимания молекулы.
См. также: Электроотрицательности элементов (страница данных)
Нет надежных источников для Pm, Eu и Yb, кроме диапазона 1,1–1,2; см. Pauling, Linus (1960). Природа химической связи. 3-е изд., Cornell University Press, стр. 93.

Роберт С. Малликен предположил, что среднее арифметическое первой энергии ионизации (E i ) и сродства к электрону (E ea ) должно быть мерой тенденции атома притягивать электроны: [9] [10]
Поскольку это определение не зависит от произвольной относительной шкалы, его также называют абсолютной электроотрицательностью [11] с единицами измерения килоджоули на моль или электронвольты . Однако более привычно использовать линейное преобразование для преобразования этих абсолютных значений в значения, которые напоминают более знакомые значения Полинга. Для энергий ионизации и сродства к электрону в электронвольтах [12] и для энергий в килоджоулях на моль [13]
Электроотрицательность по Малликену можно рассчитать только для элемента, чье сродство к электрону известно. Измеренные значения доступны для 72 элементов, в то время как приблизительные значения были оценены или рассчитаны для остальных элементов.
Электроотрицательность атома по Малликену иногда называют отрицательной величиной химического потенциала . [14] Вставляя энергетические определения потенциала ионизации и сродства к электрону в электроотрицательность по Малликену, можно показать, что химический потенциал Малликена представляет собой конечно-разностную аппроксимацию электронной энергии по отношению к числу электронов, т. е.

A. Louis Allred и Eugene G. Rochow считали [15] , что электроотрицательность должна быть связана с зарядом, испытываемым электроном на «поверхности» атома: чем выше заряд на единицу площади атомной поверхности, тем больше тенденция этого атома притягивать электроны. Эффективный ядерный заряд , Z eff , испытываемый валентными электронами , можно оценить с помощью правил Слейтера , в то время как площадь поверхности атома в молекуле можно считать пропорциональной квадрату ковалентного радиуса , r cov . Когда r cov выражается в пикометрах , [16]

RT Sanderson также отметил связь между электроотрицательностью Малликена и размером атома и предложил метод расчета, основанный на обратной величине атомного объема. [17] При наличии знаний о длинах связей модель Sanderson позволяет оценивать энергии связей в широком диапазоне соединений. [18] Модель Sanderson также использовалась для расчета молекулярной геометрии, энергии s -электронов, констант спин-спиновой связи ЯМР и других параметров для органических соединений. [19] [20] Эта работа лежит в основе концепции выравнивания электроотрицательности , которая предполагает, что электроны распределяются вокруг молекулы, чтобы минимизировать или выравнивать электроотрицательность Малликена. [21] Такое поведение аналогично выравниванию химического потенциала в макроскопической термодинамике. [22]

Возможно, самое простое определение электроотрицательности дал Леланд К. Аллен, который предположил, что она связана со средней энергией валентных электронов в свободном атоме, [23] [24] [25]
где ε s,p — одноэлектронные энергии s- и p-электронов в свободном атоме, а n s,p — число s- и p-электронов в валентной оболочке.
Энергии одного электрона могут быть определены непосредственно из спектроскопических данных , и поэтому электроотрицательности, рассчитанные этим методом, иногда называют спектроскопическими электроотрицательностями . Необходимые данные доступны почти для всех элементов, и этот метод позволяет оценить электроотрицательности для элементов, которые не могут быть обработаны другими методами, например, франция , который имеет электроотрицательность Аллена 0,67. [26] Однако неясно, что следует считать валентными электронами для элементов d- и f-блоков, что приводит к неоднозначности для их электроотрицательностей, рассчитанных методом Аллена.
По этой шкале неон имеет самую высокую электроотрицательность среди всех элементов, за ним следуют фтор , гелий и кислород .

Большое разнообразие методов расчета электроотрицательностей, все из которых дают результаты, хорошо коррелирующие друг с другом, является одним из показателей количества химических свойств, на которые может влиять электроотрицательность. Наиболее очевидное применение электроотрицательностей — это обсуждение полярности связи , для которой эта концепция была введена Полингом. В общем, чем больше разница в электроотрицательности между двумя атомами, тем более полярная связь образуется между ними, причем атом с более высокой электроотрицательностью находится на отрицательном конце диполя. Полинг предложил уравнение, связывающее «ионный характер» связи с разницей в электроотрицательности двух атомов [5] , хотя оно несколько вышло из употребления.
Было показано несколько корреляций между инфракрасными частотами растяжения определенных связей и электроотрицательностью вовлеченных атомов: [27] однако, это не удивительно, поскольку такие частоты растяжения частично зависят от прочности связи, которая входит в расчет электроотрицательностей Полинга. Более убедительными являются корреляции между электроотрицательностью и химическими сдвигами в ЯМР-спектроскопии [28] или изомерными сдвигами в мессбауэровской спектроскопии [29] (см. рисунок). Оба эти измерения зависят от плотности s-электронов в ядре, и поэтому являются хорошим указанием на то, что различные меры электроотрицательности действительно описывают «способность атома в молекуле притягивать к себе электроны». [1] [5]
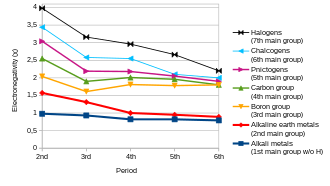
В общем, электроотрицательность увеличивается при движении слева направо по периоду и уменьшается при спуске по группе. Таким образом, фтор является наиболее электроотрицательным из элементов (не считая благородных газов ), тогда как цезий является наименее электроотрицательным, по крайней мере, из тех элементов, для которых имеются существенные данные. [26]
Из этого общего правила есть некоторые исключения. Галлий и германий имеют более высокую электроотрицательность, чем алюминий и кремний , соответственно, из-за сжатия d-блока . Элементы четвертого периода сразу после первого ряда переходных металлов имеют необычно малые атомные радиусы, поскольку 3d-электроны неэффективны в экранировании увеличенного заряда ядра, а меньший размер атома коррелирует с более высокой электроотрицательностью (см. электроотрицательность Оллреда-Рохова и электроотрицательность Сандерсона выше). Аномально высокая электроотрицательность свинца , в частности, по сравнению с таллием и висмутом , является артефактом электроотрицательности, изменяющейся в зависимости от степени окисления: его электроотрицательность лучше соответствует тенденциям, если она указана для состояния +2 со значением Полинга 1,87 вместо состояния +4.
В неорганической химии принято считать, что единственное значение электроотрицательности является действительным для большинства «нормальных» ситуаций. Хотя этот подход имеет преимущество простоты, очевидно, что электроотрицательность элемента не является неизменным атомным свойством и, в частности, увеличивается с повышением степени окисления элемента. [30]
Оллред использовал метод Полинга для расчета отдельных электроотрицательностей для различных степеней окисления нескольких элементов (включая олово и свинец), для которых имелось достаточно данных. [8] Однако для большинства элементов не существует достаточного количества различных ковалентных соединений, для которых известны энергии диссоциации связей, чтобы сделать этот подход осуществимым.
Химические эффекты этого увеличения электроотрицательности можно увидеть как в структурах оксидов и галогенидов, так и в кислотности оксидов и оксокислот. Таким образом, CrO 3 и Mn 2 O 7 являются кислотными оксидами с низкими температурами плавления , в то время как Cr 2 O 3 является амфотерным , а Mn 2 O 3 является полностью основным оксидом .
Эффект также можно ясно увидеть в константах диссоциации p K a оксокислот хлора . Эффект намного больше, чем можно было бы объяснить тем, что отрицательный заряд распределяется между большим числом атомов кислорода, что привело бы к разнице в p K a в log 10 ( 1 ⁄ 4 ) = –0,6 между хлорноватистой кислотой и хлорной кислотой . По мере увеличения степени окисления центрального атома хлора большая электронная плотность переносится с атомов кислорода на хлор, уменьшая частичный отрицательный заряд отдельных атомов кислорода. В то же время положительный частичный заряд на водороде увеличивается с более высокой степенью окисления. Это объясняет наблюдаемую повышенную кислотность с увеличением степени окисления в оксокислотах хлора.
Электроотрицательность атома изменяется в зависимости от гибридизации орбитали, используемой в связывании. Электроны на s-орбиталях удерживаются более прочно, чем электроны на p-орбиталях. Следовательно, связь с атомом, который использует гибридную орбиталь sp x для связывания, будет сильнее поляризована с этим атомом, когда гибридная орбиталь имеет более s-характер. То есть, когда электроотрицательности сравниваются для различных схем гибридизации данного элемента, сохраняется порядок χ(sp 3 ) < χ(sp 2 ) < χ(sp) (тенденция должна применяться и к нецелым индексам гибридизации ).
В органической химии электроотрицательность больше связана с различными функциональными группами, чем с отдельными атомами. Термины групповая электроотрицательность и электроотрицательность заместителя используются как синонимы. Однако принято различать индуктивный эффект и резонансный эффект , которые можно описать как σ- и π-электроотрицательности соответственно. Существует ряд линейных соотношений свободной энергии , которые использовались для количественной оценки этих эффектов, из которых наиболее известным является уравнение Гаммета . Параметры Кабачника — это групповые электроотрицательности для использования в химии фосфорорганических соединений .
Электроположительность — это мера способности элемента отдавать электроны и, следовательно, образовывать положительные ионы ; таким образом, она является антиподом электроотрицательности.
В основном, это свойство металлов , то есть, чем больше металлический характер элемента, тем больше электроположительность. Поэтому щелочные металлы являются наиболее электроположительными из всех. Это происходит потому, что у них есть один электрон на внешней оболочке, и поскольку он находится относительно далеко от ядра атома, он легко теряется; другими словами, эти металлы имеют низкую энергию ионизации . [32]
В то время как электроотрицательность увеличивается вдоль периодов в периодической таблице и уменьшается вниз по группам , электроположительность уменьшается вдоль периодов (слева направо) и увеличивается вниз по группам. Это означает, что элементы в верхнем правом углу периодической таблицы элементов (кислород, сера, хлор и т. д.) будут иметь наибольшую электроотрицательность, а элементы в нижнем левом углу (рубидий, цезий и франций) — наибольшую электроположительность.
{{cite book}}: CS1 maint: location missing publisher (link)Альтернативный URL-адрес