Пирилий — катион (положительный ион ) с формулой C5H5O + , состоящий из шестичленного кольца из пяти атомов углерода, каждый с одним атомом водорода и одним положительно заряженным атомом кислорода . Связи в кольце сопряжены , как в бензоле , что придает ему ароматический характер. В частности, из-за положительного заряда атом кислорода трехвалентен . Пирилий — моноциклическое и гетероциклическое соединение , один из ионов оксония .
Соли пирилия легко получаются из простых исходных материалов посредством реакции конденсации . [2]
Пирилиевые соли с ароматическими заместителями, такие как тетрафторборат 2,4,6-трифенилпирилия, могут быть получены из двух молей ацетофенона , одного моля бензальдегида и избытка тетрафторборной кислоты . [3] Для пирилиевых солей с алкильными заместителями, таких как соли 2,4,6-триметилпирилия, наилучшим методом является синтез Балабана - Неницеску -Прайля из третичного бутанола и уксусного ангидрида в присутствии тетрафторборной, [4] перхлорной, [5] или трифторметансульфоновой кислот. [6]
Гидроксидные основания раскрывают и гидролизуют пиридин до основания ендиона, которое циклизуется в очень сильных кислотах до катиона пирилия. [7]
Условия енолиза (сильная кислота) заставляют пироны переходить в пирилиевый таутомер. [8]
Пирилий и его производные образуют стабильные соли с различными анионами. [9] [10] [11] [12] [13] [14]
Как и другие ионы оксония , пирилий нестабилен в нейтральной воде. Однако пирилий гораздо менее реакционноспособен, чем обычные ионы оксония из-за ароматической стабилизации. Высоко электроотрицательный кислород сильно возмущает орбитали в ароматическом кольце, и производные пирилия чрезвычайно устойчивы к электрофильному ароматическому замещению . Катионы пирилия реагируют с нуклеофилами в орто- и пара -положениях , как правило, через ANRORC . [15]
Соли 2,4,6-трифенилпирилия преобразуются гидроксидными основаниями в стабильный 1,5-ендион (псевдобазование), но соли 2,4,6-триметилпирилия при обработке горячими щелочными гидроксидами дают нестабильное псевдооснование, которое подвергается внутримолекулярной конденсации, давая 3,5- диметилфенол . В теплом оксиде дейтерия соли 2,4,6-триметилпирилия подвергаются изотопному обмену 4-метилводородов быстрее, чем для 2- и 6-метильных групп, что позволяет синтезировать региоселективно дейтерированные соединения. [ необходима цитата ]
Электрофильность пирилия делает их полезными материалами для получения других соединений с более сильным ароматическим характером. Соли пирилия дают пиридины с аммиаком , [16] соли пиридиния с первичными аминами, пиридин -N -оксиды с гидроксиламином , фосфабензолы с производными фосфина , соли тиопирилия с сероводородом и производные бензола с ацетонитрилом или нитрометаном .
Многие важные катионы формально получены из пирилия путем замены различных функциональных групп на некоторые или все атомы водорода в кольце. 2,4,6-Трифенилпирилий реагирует с первичными аминами, образуя производные пиридиния, называемые « солями Катрицкого »; они обычно используются в катализируемом металлом нуклеофильном замещении амина. [15]
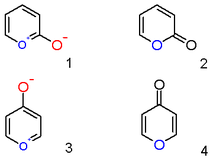
Пирилиевый катион с гидроксильным анионным заместителем в положении 2 не является цвиттерионным ароматическим соединением ( 1 ), а нейтральным ненасыщенным лактоном 2-пироном или пиран-2-оном ( 2 ). Важными представителями этого класса являются кумарины . Аналогично 4-гидроксильное пирилиевое соединение является γ-пироном или пиран-4-оном ( 4 ), к этой группе относятся такие соединения, как мальтол .
Известно, что 2-пироны реагируют с алкинами в реакции Дильса-Альдера с образованием ареновых соединений с выделением диоксида углерода , например: [17]


Один бициклический ион пирилия называется ионом бензопирилия ( ИЮПАК : ион хроменилия) (формула: C9H7O + , молярная масса : 131,15 г/моль, точная масса: 131,04968983). Его можно рассматривать как заряженное производное 2H - 1 - бензопирана ( ИЮПАК : 2H - хромен, C9H8O ) , или ( заряженное ) замещенное гетероциклическое производное нафталина ( C10H8 ) .

В биологии ион 2-фенилбензопирилия (2-фенилхроменилия) называется флавилием . Класс соединений, полученных из флавилия, — это антоцианидины и антоцианы , пигменты, которые отвечают за окраску многих цветов. [ необходима цитата ]

Существуют также более высокие полициклические производные пирилия. Хорошим примером является нафтоксантений. Этот краситель очень стабилен, ароматичен и плосок. Он поглощает в УФ- и синей области и обладает исключительными фотофизическими свойствами. Его можно синтезировать химическими или фотохимическими реакциями. [18]