Химическое уравнение — это символическое представление химической реакции в виде символов и химических формул . Реагенты указаны с левой стороны, а продукты — с правой стороны со знаком плюс между сущностями как в реагентах, так и в продуктах, и стрелкой, которая указывает на продукты, чтобы показать направление реакции. [1] Химические формулы могут быть символическими, структурными (графические диаграммы) или смешанными. Коэффициенты рядом с символами и формулами сущностей являются абсолютными значениями стехиометрических чисел. Первое химическое уравнение было схематически изображено Жаном Бегеном в 1615 году. [2]
Химическое уравнение (см. пример ниже) состоит из списка реагентов (исходных веществ) в левой части, символа стрелки и списка продуктов (веществ, образующихся в химической реакции) в правой части. Каждое вещество указывается своей химической формулой , которой может предшествовать число, называемое стехиометрическим коэффициентом . [a] Коэффициент указывает, сколько сущностей (например, молекул ) этого вещества участвует в реакции на молекулярной основе. Если явно не указано иное, коэффициент равен 1. Несколько веществ в любой части уравнения отделяются друг от друга знаком плюс .
В качестве примера уравнение реакции соляной кислоты с натрием можно записать так:
Учитывая, что формулы довольно просты, это уравнение можно прочитать как «два HCL плюс два NA дают [b] два NACL и два H». С другой стороны, и в целом для уравнений, включающих сложные химические вещества, химические формулы читаются с использованием номенклатуры ИЮПАК , которая может вербализовать это уравнение как «две молекулы соляной кислоты и два атома натрия реагируют, образуя две формульные единицы хлорида натрия и молекулу газообразного водорода ».
Для обозначения типа реакции используются различные варианты символа стрелки: [1]
Для обозначения физического состояния химического вещества к его формуле можно добавить символ в скобках: (s) для твердого вещества, (l) для жидкости, (g) для газа и (aq) для водного раствора . Это делается особенно часто, когда требуется подчеркнуть состояния или их изменения. Например, реакция водной соляной кислоты с твердым (металлическим) натрием с образованием водного хлорида натрия и газообразного водорода будет записана следующим образом:
Эта реакция имела бы другие термодинамические и кинетические свойства, если бы газообразный хлористый водород заменил соляную кислоту в качестве реагента:
В качестве альтернативы, в некоторых случаях используется стрелка без скобок для указания образования газа ↑ или осадка ↓. Это особенно полезно, если образуется только один такой вид. Вот пример, показывающий, что образуется водородный газ:
Если реакция требует энергии, это указано над стрелкой. Заглавная греческая буква дельта (Δ) или треугольник (△) [e] ставится на стрелке реакции, чтобы показать, что энергия в форме тепла добавляется к реакции. Выражение hν [f] используется как символ для добавления энергии в форме света. Другие символы используются для других конкретных типов энергии или излучения.
Аналогично, если реакция требует определенной среды с определенными специфическими характеристиками, то название кислоты или основания, которые используются в качестве среды, может быть размещено над стрелкой. Если не требуется никакой определенной кислоты или основания, другой способ обозначения использования кислой или основной среды — написать H + или OH − (или даже «кислота» или «основание») над стрелкой. Конкретные условия температуры и давления, а также наличие катализаторов могут быть указаны таким же образом.

Стандартная запись химических уравнений допускает только все реагенты с одной стороны, все продукты с другой, и все стехиометрические коэффициенты положительные. Например, обычная форма уравнения дегидратации метанола в диметилэфир :
Иногда используется расширение, когда некоторые вещества с их стехиометрическими коэффициентами перемещаются выше или ниже стрелки, предваряясь знаком плюс или ничего для реагента и знаком минус для продукта. Тогда то же самое уравнение может выглядеть так:
Такая нотация позволяет скрыть менее важные вещества по сторонам уравнения, сделать тип рассматриваемой реакции более очевидным и облегчить цепочку химических уравнений. Это очень полезно для иллюстрации многоступенчатых механизмов реакции . Обратите внимание, что вещества, находящиеся выше или ниже стрелок, в данном случае не являются катализаторами , поскольку они расходуются или производятся в реакции, как обычные реагенты или продукты.
Другое расширение, используемое в механизмах реакции, перемещает некоторые вещества в ответвления стрелки. Оба расширения используются в примере иллюстрации механизма.
Использование отрицательных стехиометрических коэффициентов по обе стороны уравнения (как в примере ниже) не получило широкого распространения и часто не рекомендуется. [5] [6]
Поскольку в химической реакции не происходит ядерных реакций , химические элементы проходят через реакцию без изменений. Таким образом, каждая сторона химического уравнения должна представлять одинаковое количество атомов любого конкретного элемента (или нуклида , если учитываются различные изотопы ). То же самое справедливо для полного электрического заряда , как указано в законе сохранения заряда . Уравнение, соответствующее этим требованиям, называется сбалансированным .
Химическое уравнение уравновешивается путем присвоения подходящих значений стехиометрическим коэффициентам. Простые уравнения могут быть уравновешены путем проверки, то есть методом проб и ошибок. Другой метод включает решение системы линейных уравнений .
Сбалансированные уравнения обычно записываются с наименьшими натуральными коэффициентами. Однако иногда может быть выгодно принять дробный коэффициент, если это упрощает другие коэффициенты. Вводный пример можно, таким образом, переписать как
В некоторых случаях дробные коэффициенты даже неизбежны. Например, реакция, соответствующая стандартной энтальпии образования, должна быть записана так, чтобы образовалась одна молекула одного продукта. Это часто потребует, чтобы некоторые коэффициенты реагентов были дробными, как в случае с образованием фторида лития :

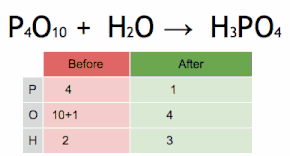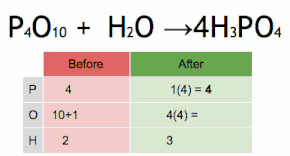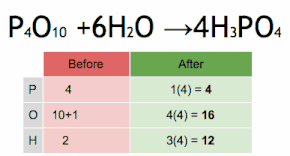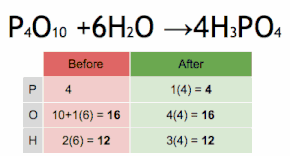
Метод проверки можно описать как установку стехиометрического коэффициента самого сложного вещества на 1 и пошаговое присвоение значений другим коэффициентам таким образом, чтобы обе стороны уравнения в конечном итоге имели одинаковое количество атомов для каждого элемента. Если в ходе этого процесса возникают какие-либо дробные коэффициенты, наличие дробей может быть устранено (в любой момент) путем умножения всех коэффициентов на их наименьший общий знаменатель .
Уравновешивание химического уравнения полного сгорания метана
достигается следующим образом:
Для каждого химического элемента (или нуклида, или неизмененной части или заряда) i его требование сохранения может быть выражено математическим уравнением
где
Это приводит к однородной системе линейных уравнений , которые легко решаются с помощью математических методов. Такая система всегда имеет тривиальное решение со всеми нулями , которое нас не интересует, но если есть какие-либо дополнительные решения, их будет бесконечное количество. Любое нетривиальное решение уравновесит химическое уравнение. «Предпочтительным» решением является решение с целыми числами , в основном положительными [g] стехиометрическими коэффициентами s j с наибольшим общим делителем, равным единице.
Присвоим переменным стехиометрические коэффициенты химического уравнения из предыдущего раздела и запишем соответствующие линейные уравнения:
Все решения этой системы линейных уравнений имеют следующий вид, где r — любое действительное число :
Выбор r = 1 дает предпочтительное решение,
что соответствует сбалансированному химическому уравнению:
Система линейных уравнений, введенная в предыдущем разделе, может быть также записана с использованием эффективного матричного формализма. Во-первых, для унификации стехиометрических коэффициентов реагента и продукта s j введем величину
называемое стехиометрическим числом , [h], которое упрощает линейные уравнения до
где J — общее число реагентов и продуктов (формул) в химическом уравнении.
Размещение значений a ij в строке i и столбце j матрицы состава
и расположение стехиометрических чисел в стехиометрическом векторе
позволяет выразить систему уравнений в виде одного матричного уравнения :
Как и ранее, любой ненулевой стехиометрический вектор ν , решающий матричное уравнение, уравновесит химическое уравнение.
Множество решений матричного уравнения представляет собой линейное пространство, называемое ядром матрицы A. Для того чтобы это пространство содержало ненулевые векторы ν , т. е. имело положительную размерность J N , столбцы матрицы состава A не должны быть линейно независимыми . Тогда задача балансировки химического уравнения становится задачей определения J N -мерного ядра матрицы состава. Важно отметить, что только при J N = 1 будет существовать единственное предпочтительное решение задачи балансировки. При J N > 1 будет существовать бесконечное число предпочтительных решений, из которых J N линейно независимы. Если J N = 0, будет только неиспользуемое тривиальное решение, нулевой вектор.
Разработаны методы [7] [8] для быстрого вычисления набора из J N независимых решений задачи балансировки, которые превосходят инспекционный и алгебраический методы [ требуется ссылка ] в том смысле, что они являются определяющими и дают все решения задачи балансировки.
Используя то же самое химическое уравнение еще раз, запишите соответствующее матричное уравнение:
Его решения имеют следующий вид, где r — любое действительное число:
Выбор r = 1 и изменение знака первых двух строк дает предпочтительное решение задачи балансировки:
Ионное уравнение — это химическое уравнение, в котором электролиты записываются в виде диссоциированных ионов . Ионные уравнения используются для реакций одинарного и двойного замещения , которые происходят в водных растворах .
Например, в следующей реакции осаждения:
полное ионное уравнение:
или, включая все физические состояния:
В этой реакции ионы Ca 2+ и NO 3 − остаются в растворе и не являются частью реакции. То есть эти ионы идентичны как на стороне реагента, так и на стороне продукта химического уравнения. Поскольку такие ионы не участвуют в реакции, их называют ионами-наблюдателями . Сокращенное ионное уравнение — это полное ионное уравнение, из которого удалены ионы-наблюдатели. [9] Сокращенное ионное уравнение протекающих реакций имеет вид:
или, в сокращенной сбалансированной форме,
В реакции нейтрализации или кислотно - основной реакции сокращенное ионное уравнение обычно имеет вид:
Существует несколько реакций кислота/основание, которые производят осадок в дополнение к молекуле воды, показанной выше. Примером является реакция гидроксида бария с фосфорной кислотой , которая производит не только воду, но и нерастворимую соль фосфат бария. В этой реакции нет ионов-наблюдателей, поэтому сокращенное ионное уравнение такое же, как и полное ионное уравнение.
Реакции двойного замещения, в которых карбонат реагирует с кислотой, имеют сокращенное ионное уравнение:
Если каждый ион является «ионом-наблюдателем», то реакция не произошла, и сокращенное ионное уравнение равно нулю.
В общем случае, если z j является кратным элементарного заряда j-й молекулы, нейтральность заряда можно записать как:
где ν j — стехиометрические коэффициенты, описанные выше. Z j может быть включен [7] [8] как дополнительная строка в матрицу a ij, описанную выше, и правильно сбалансированное ионное уравнение тогда также будет подчиняться:
Теперь г-н Пфаундлер объединил эти два явления в единое понятие, рассматривая наблюдаемый предел как результат двух противоположных реакций, приводя одну в приведенном примере к образованию морской соли [т. е. NaCl] и азотной кислоты, [а] другую к образованию соляной кислоты и нитрата натрия. Это соображение, которое подтверждается экспериментом, оправдывает выражение «химическое равновесие», которое используется для характеристики конечного состояния ограниченных реакций. Я бы предложил перевести это выражение следующим символом:
- HCl + NO 3 Na ⇄ NO 3 H + Cl Na.
Таким образом, я заменяю в этом случае знак = в химическом уравнении знаком ⇄, который в действительности не просто выражает равенство, но и показывает направление реакции. Это ясно выражает, что химическое действие происходит одновременно в двух противоположных направлениях.
Или г-н Пфаундлер — это relié ces deux phénomênes... s'accomplit en même temps dans deux sens opposiés.
{{cite web}}: CS1 maint: url-status (link)