

Цис - транс- изомерия , также известная как геометрическая изомерия , описывает определенное расположение атомов внутри молекул. Приставки « цис » и « транс » взяты из латыни: «по эту сторону» и «по ту сторону» соответственно. [1] В контексте химии цис означает, что функциональные группы (заместители) находятся на одной стороне некоторой плоскости, а транс означает, что они находятся на противоположных (поперечных) сторонах. Цис - транс- изомеры — это стереоизомеры , то есть пары молекул, имеющие одинаковую формулу, но функциональные группы которых находятся в разной ориентации в трехмерном пространстве. Цис- и транс -изомеры встречаются как в органических молекулах, так и в неорганических координационных комплексах. Цис- и транс- дескрипторы не используются в случаях конформационной изомерии , когда две геометрические формы легко преобразуются друг в друга, например, в большинстве структур с одинарной связью с открытой цепью;используются термины « син » и « анти ».
Согласно ИЮПАК , «геометрическая изомерия» является устаревшим синонимом « цис - транс- изомерии». [2]
Цис-транс или геометрическая изомерия классифицируется как один тип конфигурационной изомерии . [3]
Очень часто цис - транс- стереоизомеры содержат двойные связи или кольцевые структуры. В обоих случаях вращение облигаций ограничивается или предотвращается. [4] Когда группы заместителей ориентированы в одном направлении, диастереомер называется цис , тогда как когда заместители ориентированы в противоположных направлениях, диастереомер называется транс . Примером небольшого углеводорода, проявляющего цис - транс- изомерию, является бут-2-ен . Другим примером является 1,2-дихлорциклогексан.
Цис- и транс -изомеры имеют разные физические свойства. Их разная форма влияет на дипольные моменты , температуру кипения и особенно плавления.
Эти различия могут быть очень небольшими, как в случае с температурой кипения алкенов с прямой цепью, таких как пент-2-ен , которая составляет 37 °С у цис -изомера и 36 °С у транс -изомера. [5] Различия между цис- и транс- изомерами могут быть больше, если присутствуют полярные связи, как в 1,2-дихлорэтенах . Цис - изомер в этом случае имеет температуру кипения 60,3 °С, а транс -изомер — 47,5 °С. [6] В цис -изомере два полярных дипольных момента связи C–Cl объединяются, образуя общий молекулярный диполь, так что существуют межмолекулярные диполь-дипольные силы (или силы Кисома), которые добавляются к дисперсионным силам Лондона и повышают температуру кипения. точка. С другой стороны, в транс -изомере этого не происходит, поскольку два момента связи C-Cl компенсируются, и молекула имеет чистый нулевой дипольный момент (однако она имеет ненулевой квадрупольный момент ).
Различные свойства двух изомеров бутендиовой кислоты часто сильно различаются.
Полярность является ключом к определению относительной точки кипения, поскольку сильные межмолекулярные силы повышают температуру кипения. Точно так же симметрия является ключом к определению относительной температуры плавления, поскольку она обеспечивает лучшую упаковку в твердом состоянии, даже если она не меняет полярность молекулы. Другим примером этого является взаимосвязь между олеиновой кислотой и элаидиновой кислотой ; олеиновая кислота, цис -изомер, имеет температуру плавления 13,4 °C, что делает ее жидкой при комнатной температуре, тогда как транс -изомер, элаидиновая кислота, имеет гораздо более высокую температуру плавления — 43 °C, поскольку более прямой транс- изомер является способен упаковываться более плотно и является твердым при комнатной температуре.
Таким образом, транс -алкены, которые менее полярны и более симметричны, имеют более низкие температуры кипения и более высокие температуры плавления, а цис -алкены, которые обычно более полярны и менее симметричны, имеют более высокие температуры кипения и более низкие температуры плавления.
В случае геометрических изомеров, являющихся следствием двойных связей, и, в частности, когда оба заместителя одинаковы, обычно сохраняются некоторые общие закономерности. Эти тенденции можно объяснить тем фактом, что диполи заместителей в цис- изомере складываются, образуя общий молекулярный диполь. В транс -изомере диполи заместителей сокращаются [7] из-за того, что они находятся на противоположных сторонах молекулы. Транс -изомеры также имеют тенденцию иметь более низкую плотность, чем их цис- аналоги. [ нужна цитата ]
Как правило, транс -алкены имеют более высокую температуру плавления и более низкую растворимость в инертных растворителях, поскольку транс -алкены, как правило, более симметричны, чем цис -алкены. [8]
Константы вицинального взаимодействия ( 3 J HH ), измеренные методом ЯМР-спектроскопии , больше для транс- изомеров (диапазон: 12–18 Гц; типично: 15 Гц), чем для цис- изомеров (диапазон: 0–12 Гц; типично: 8 Гц). [9]
Обычно для ациклических систем транс -изомеры более стабильны, чем цис -изомеры. Такое различие объясняется неблагоприятным стерическим взаимодействием заместителей в цис -изомере. Следовательно, транс -изомеры имеют менее экзотермическую теплоту сгорания , что указывает на более высокую термохимическую стабильность. [8] В наборе данных по групповой аддитивности по теплоте образования Бенсона цис -изомеры страдают от потери стабильности на 1,10 ккал/моль. Существуют исключения из этого правила, такие как 1,2-дифторэтилен , 1,2-дифтордиазен (FN = NF) и некоторые другие галоген- и кислородзамещенные этилены. В этих случаях цис -изомер более стабилен, чем транс -изомер. [10] Это явление называется цис-эффектом . [11]

In principle, cis–trans notation should not be used for alkenes with two or more different substituents. Instead the E–Z notation is used based on the priority of the substituents using the Cahn–Ingold–Prelog (CIP) priority rules for absolute configuration. The IUPAC standard designations E and Z are unambiguous in all cases, and therefore are especially useful for tri- and tetrasubstituted alkenes to avoid any confusion about which groups are being identified as cis or trans to each other.
Z (from the German zusammen) means "together". E (from the German entgegen) means "opposed" in the sense of "opposite". That is, Z has the higher-priority groups cis to each other and E has the higher-priority groups trans to each other. Whether a molecular configuration is designated E or Z is determined by the CIP rules; higher atomic numbers are given higher priority. For each of the two atoms in the double bond, it is necessary to determine the priority of each substituent. If both the higher-priority substituents are on the same side, the arrangement is Z; if on opposite sides, the arrangement is E.
Because the cis–trans and E–Z systems compare different groups on the alkene, it is not strictly true that Z corresponds to cis and E corresponds to trans. For example, trans-2-chlorobut-2-ene (the two methyl groups, C1 and C4, on the but-2-ene backbone are trans to each other) is (Z)-2-chlorobut-2-ene (the chlorine and C4 are together because C1 and C4 are opposite).
Wavy single bonds are the standard way to represent unknown or unspecified stereochemistry or a mixture of isomers (as with tetrahedral stereocenters). A crossed double-bond has been used sometimes; it is no longer considered an acceptable style for general use by IUPAC but may still be required by computer software.[12]
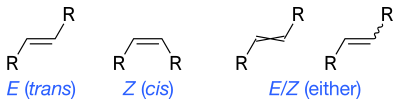
Cis–trans isomerism can also occur in inorganic compounds.
Diazenes (and the related diphosphenes) can also exhibit cis–trans isomerism. As with organic compounds, the cis isomer is generally the more reactive of the two, being the only isomer that can reduce alkenes and alkynes to alkanes, but for a different reason: the trans isomer cannot line its hydrogens up suitably to reduce the alkene, but the cis isomer, being shaped differently, can.
Coordination complexes with octahedral or square planar geometries can also exhibit cis-trans isomerism.
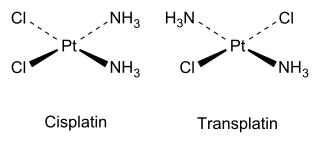
For example, there are two isomers of square planar Pt(NH3)2Cl2, as explained by Alfred Werner in 1893. The cis isomer, whose full name is cis-diamminedichloroplatinum(II), was shown in 1969 by Barnett Rosenberg to have antitumor activity, and is now a chemotherapy drug known by the short name cisplatin. In contrast, the trans isomer (transplatin) has no useful anticancer activity. Each isomer can be synthesized using the trans effect to control which isomer is produced.
For octahedral complexes of formula MX4Y2, two isomers also exist. (Here M is a metal atom, and X and Y are two different types of ligands.) In the cis isomer, the two Y ligands are adjacent to each other at 90°, as is true for the two chlorine atoms shown in green in cis-[Co(NH3)4Cl2]+, at left. In the trans isomer shown at right, the two Cl atoms are on opposite sides of the central Co atom.
A related type of isomerism in octahedral MX3Y3 complexes isfacial–meridional (or fac–mer) isomerism, in which different numbers of ligands are cis or trans to each other. Metal carbonyl compounds can be characterized as fac or mer using infrared spectroscopy.