Экзополифосфатаза (PPX) — это фермент фосфатаза , который катализирует гидролиз неорганического полифосфата , линейной молекулы, состоящей из до 1000 или более мономеров, связанных фосфоангидридными связями. [1] PPX — это процессивная экзофосфатаза, что означает, что она начинается на концах полифосфатной цепи и расщепляет фосфоангидридные связи, чтобы высвободить ортофосфат по мере его перемещения вдоль молекулы полифосфата. [1] PPX имеет несколько характеристик, которые отличают ее от других известных полифосфатаз, а именно то, что она не действует на АТФ , имеет сильное предпочтение к длинноцепочечным полифосфатам и имеет очень низкое сродство к молекулам полифосфата с менее чем 15 фосфатными мономерами. [2]
PPX играет важную роль в метаболизме фосфата и энергии во всех живых организмах. [3] Он особенно важен для поддержания соответствующих уровней внутриклеточного полифосфата , который участвует в различных клеточных функциях, включая реакцию на такие стрессоры, как дефицит аминокислот , ортофосфата или азота , изменения pH , снижение питательных веществ и высокое содержание соли, а также в качестве неорганического молекулярного шаперона . [2] [4]
PPX классифицируется как полифосфатаза, которая является частью большого семейства фосфоэстераз DHH. [5] Оба подсемейства в пределах этого суперсемейства имеют четыре общих мотива N-конца , но имеют разные фрагменты C-конца . [6]
Активность PPX количественно определяется путем измерения потери радиоактивно меченого 32 P полифосфата . [1] PPX смешивают с известным количеством меченого полифосфата, и реакцию гидролиза останавливают хлорной кислотой (HClO 4 ). [1] Затем количество оставшегося меченого полифосфата измеряют с помощью жидкостного сцинтилляционного счетчика . [1]
PPX был открыт лабораторией лауреата Нобелевской премии Артура Корнберга в 1993 году и является частью полифосфатного оперона вместе с полифосфаткиназой [1] , ферментом, который синтезирует полифосфат . Лаборатория Корнберга была очень заинтересована в полифосфате и опубликовала серию статей, освещающих метаболизм и роль полифосфата in vivo . Их интерес к полифосфату привел их к идентификации и характеристике полифосфатного оперона (который включает полифосфаткиназу [PPK] и PPX) и разработке широкого спектра анализов и методов для количественной оценки производства и деградации полифосфата in vitro и in vivo . Структура была дополнительно решена для экзополифосфатазы Лабораторией структурной вирусологии Пердью, включая Сандерса, Яницки и др. Конец имеет 7-10 атомов фосфата. Результаты исследований полифосфата в лаборатории Корнберга привели его к предположению, что из-за высокого содержания энергии и фосфата, а также степени его сохранения у разных видов, полифосфат мог быть предшественником РНК , ДНК и белков . [2]
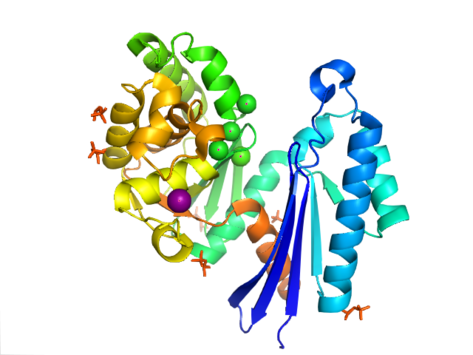
Структура PPX характеризуется актиноподобным доменом АТФазы , который является частью этого суперсемейства. В Aquifex aeolicus он содержит мотив, подобный рибонуклеазе H, который состоит из пятицепочечного β -слоя со второй цепью, антипараллельной остальным. Несколько цепей соединены спиральными сегментами, которые длиннее в C-концевом домене, чем в N-концевом домене. Пять альфа-спиралей расположены в C-концевом домене, и только две расположены в N-концевом домене. Закрытая конфигурация фермента называется структурой типа I. Эта конфигурация имеет схожие черты с другими членами этого суперсемейства, включая N-концевой и C-концевой домены, разделенные двумя альфа-спиралями, центрированными на структуре. Более открытое расположение доменов отображает вращательное движение двух доменов вокруг одной шарнирной области. Структурная гибкость описывается как щель, открывающаяся вокруг активного участка , напоминающая «бабочку» . [8]
В E. coli экзополифосфатаза существует в виде димера , каждый мономер которого состоит из четырех доменов. Первые два домена состоят из трех бета-слоев, за которыми следует альфа-бета-альфа-бета-альфа складка. Это отличается от ранее описанного гомолога Aquifex aeolicus , у которого отсутствуют третий и четвертый домены. [9] На сегодняшний день для этого класса ферментов решены 4 структуры с кодами доступа Protein Data Bank 1T6C, 1T6D, 1U6Z и 2FLO.

Активный центр экзополифосфатазы расположен в щели между доменами I и II. У E. coli эта область содержит петлю между цепями бета-1 и бета-2 с аминокислотами глутаматом и аспартатом (E121, D143 и E150). Эти остатки, наряду с K197, имеют решающее значение для связывания фосфата и связывания ионов, что часто наблюдается среди других ASKHA (ацетат и сахарные киназы, Hsp70 , актин ). У A. aeolicus активный центр фермента находится в щели между двумя доменами. Видно, что каталитические карбоксильные группы в этой щели важны для активности фермента, в частности Asp141 и Glu148. Предпочтение экзополифосфатазы связываться с полифосфатом, а не с АТФ, способствовало столкновению, которое могло произойти между рибозой и аденозином АТФ и боковыми цепями N21, C169 и R267. [9]
Экзополифосфатаза отщепляет терминальный фосфат от полифосфата через боковые цепи аминокислот глутамата и лизина. Глутамат активирует воду, позволяя ей действовать как нуклеофил и атаковать терминальный фосфат. Кислород, который ранее соединял два атома фосфата, затем отщепляет водород от близлежащего остатка лизина. [9]

Полифосфаты используются ферментами экзополифосфатазами, которые расщепляют части цепи фосфатов. Эти белки играют важную роль в метаболизме и поддержании полифосфатов. [11] Полифосфат находится по всему цитозолю каждой клетки, а также присутствует в органеллах клетки . Существует много классов экзополифосфатаз, каждый из которых имеет свою уникальную локализацию и свойства. Было высказано предположение, что после расщепления полифосфатов они вовлекаются в сигнальные молекулы, действующие как вторичные мессенджеры . [6] [12] В E. coli регуляция метаболизма полифосфатов плохо изучена. [13]
Полифосфат представляет собой линейную цепь фосфатов, связанных между собой фосфоангидридными связями. Полифосфат встречается во всех живых организмах и играет важную роль в выживании организмов. У бактерий полифосфат используется для хранения энергии, чтобы заменить аденозинтрифосфат . Также было показано, что он участвует в формировании и функционировании клеточной мембраны, регуляции ферментов и контроле транскрипции генов. У млекопитающих полифосфаты участвуют в свертывании крови и воспалении, иммунном ответе, развитии костной ткани и функционировании мозга. [11] [14]
На модели дрожжей было показано , что мутантные дрожжи с дефицитом экзополифосфатазной активности имели проблемы с функциями дыхания и метаболизмом неорганических полифосфатов. [15] Наоборот, показано, что штаммы дрожжей с более высоким уровнем фермента экзополифосфатазы не имеют очевидных дефектов роста в условиях дефицита или избытка фосфата, однако уровень полифосфата в дрожжах был намного ниже из-за увеличения количества ферментов, разрушающих полифосфатные цепи. [16]
Мутанты E. coli , неспособные синтезировать полифосфат, погибают всего через несколько дней в стационарной фазе . [2] Поэтому стратегии ингибирования накопления полифосфата в бактериях представляют интерес в качестве потенциальных антибактериальных методов лечения. [2] [17] Этого можно достичь путем ингибирования полифосфаткиназы, усиления активности экзополифосфатазы или и того, и другого.
Накопление полифосфата также представляет интерес для различных промышленных применений, включая удаление P i из водной среды посредством улучшенного биологического удаления фосфора и его роль в качестве молекулярного шаперона в экспрессии рекомбинантного белка . Из-за активности полифосфата как молекулярного шаперона, [4] штаммы E. coli , которые накапливают полифосфат, могут быть использованы для увеличения выхода растворимого рекомбинантного белка . [18]
Рекомбинантная экзополифосфатаза из Saccharomyces cerevisiae защищает от смертности и восстанавливает защитные иммунные реакции в доклинических моделях сепсиса. [14]
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )