
Мембранный потенциал (также трансмембранный потенциал или мембранное напряжение ) — это разница в электрическом потенциале между внутренней и внешней частью биологической клетки . Он равен внутреннему потенциалу за вычетом внешнего потенциала. Это энергия (т. е. работа ) на заряд, необходимая для перемещения (очень малого) положительного заряда с постоянной скоростью через клеточную мембрану снаружи внутрь. (Если заряду разрешено изменять скорость, необходимо учитывать изменение кинетической энергии и производство излучения [1] .)
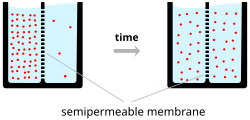
Типичные значения мембранного потенциала, обычно выраженные в единицах милливольт и обозначаемые как мВ, находятся в диапазоне от –80 мВ до –40 мВ. Для таких типичных отрицательных мембранных потенциалов требуется положительная работа для перемещения положительного заряда изнутри наружу. Однако тепловая кинетическая энергия позволяет ионам преодолевать разницу потенциалов. Для селективно проницаемой мембраны это обеспечивает чистый поток против градиента. Это своего рода осмос .
Все животные клетки окружены мембраной, состоящей из липидного бислоя с белками , встроенными в него. Мембрана служит как изолятором, так и диффузионным барьером для движения ионов . Трансмембранные белки , также известные как белки -переносчики ионов или белки -ионные насосы , активно проталкивают ионы через мембрану и устанавливают градиенты концентрации через мембрану, а ионные каналы позволяют ионам перемещаться через мембрану вниз по этим градиентам концентрации. Ионные насосы и ионные каналы электрически эквивалентны набору батарей и резисторов, вставленных в мембрану, и, следовательно, создают напряжение между двумя сторонами мембраны.
Все плазматические мембраны имеют электрический потенциал, причем внутренняя часть обычно отрицательна по отношению к внешней. [2] Мембранный потенциал имеет две основные функции. Во-первых, он позволяет клетке функционировать как батарея, обеспечивая питание для работы различных «молекулярных устройств», встроенных в мембрану. [3] Во-вторых, в электрически возбудимых клетках , таких как нейроны и мышечные клетки , он используется для передачи сигналов между различными частями клетки.
Сигналы генерируются в возбудимых клетках путем открытия или закрытия ионных каналов в одной точке мембраны, что приводит к локальному изменению мембранного потенциала. Это изменение электрического поля может быть быстро воспринято как соседними, так и более удаленными ионными каналами в мембране. Затем эти ионные каналы могут открываться или закрываться в результате изменения потенциала, воспроизводя сигнал.
В невозбудимых клетках и в возбудимых клетках в их базовых состояниях мембранный потенциал поддерживается на относительно стабильном значении, называемом потенциалом покоя . Для нейронов потенциал покоя определяется как диапазон от –80 до –70 милливольт; то есть внутренняя часть клетки имеет отрицательное базовое напряжение немного меньше одной десятой вольта. Открытие и закрытие ионных каналов может вызвать отклонение от потенциала покоя. Это называется деполяризацией, если внутреннее напряжение становится менее отрицательным (например, от –70 мВ до –60 мВ), или гиперполяризацией, если внутреннее напряжение становится более отрицательным (например, от –70 мВ до –80 мВ). В возбудимых клетках достаточно большая деполяризация может вызвать потенциал действия , при котором мембранный потенциал быстро и значительно изменяется в течение короткого времени (порядка от 1 до 100 миллисекунд), часто меняя его полярность. Потенциалы действия генерируются путем активации определенных потенциалзависимых ионных каналов .
В нейронах факторы, влияющие на мембранный потенциал, разнообразны. Они включают многочисленные типы ионных каналов, некоторые из которых химически управляются, а некоторые — потенциал-управляемые. Поскольку потенциал-управляемые ионные каналы контролируются мембранным потенциалом, в то время как сам мембранный потенциал находится под влиянием этих же ионных каналов, возникают петли обратной связи, которые допускают сложную временную динамику, включая колебания и регенеративные события, такие как потенциалы действия.
Различия в концентрациях ионов на противоположных сторонах клеточной мембраны приводят к возникновению напряжения, называемого мембранным потенциалом . [4]
Многие ионы имеют градиент концентрации через мембрану, включая калий (K + ), который находится в высокой концентрации внутри и низкой концентрации снаружи мембраны. Ионы натрия (Na + ) и хлорида (Cl − ) находятся в высоких концентрациях во внеклеточной области и низких концентрациях во внутриклеточных областях. Эти градиенты концентрации обеспечивают потенциальную энергию для формирования мембранного потенциала. Это напряжение устанавливается, когда мембрана имеет проницаемость для одного или нескольких ионов.
В простейшем случае, показанном на верхней диаграмме («Градиенты концентрации ионов»), если мембрана избирательно проницаема для калия, эти положительно заряженные ионы могут диффундировать вниз по градиенту концентрации наружу из клетки, оставляя нескомпенсированные отрицательные заряды. Это разделение зарядов и является причиной мембранного потенциала.
Система в целом электронейтральна. Нескомпенсированные положительные заряды вне клетки и нескомпенсированные отрицательные заряды внутри клетки физически выстраиваются на поверхности мембраны и притягиваются друг к другу через липидный бислой . Таким образом, мембранный потенциал физически расположен только в непосредственной близости от мембраны. Именно разделение этих зарядов через мембрану является основой мембранного напряжения.
Верхняя диаграмма представляет собой лишь приближение ионных вкладов в мембранный потенциал. Другие ионы, включая натрий, хлорид, кальций и другие, играют более незначительную роль, хотя у них и сильные градиенты концентрации, поскольку они имеют более ограниченную проницаемость, чем калий.
Мембранный потенциал в клетке в конечном итоге возникает из двух факторов: электрической силы и диффузии. Электрическая сила возникает из взаимного притяжения между частицами с противоположными электрическими зарядами (положительным и отрицательным) и взаимного отталкивания между частицами с одинаковым типом заряда (оба положительных или оба отрицательных). Диффузия возникает из статистической тенденции частиц перераспределяться из областей, где они высоко сконцентрированы, в области, где концентрация низкая.
Напряжение, которое является синонимом разности электрических потенциалов , — это способность проводить электрический ток через сопротивление. Действительно, простейшее определение напряжения дается законом Ома : V=IR, где V — напряжение, I — ток, а R — сопротивление. Если источник напряжения, такой как батарея, помещен в электрическую цепь, то чем выше напряжение источника, тем больше ток, который он будет проводить через имеющееся сопротивление. Функциональное значение напряжения заключается только в разнице потенциалов между двумя точками цепи. Идея напряжения в одной точке бессмысленна. В электронике принято присваивать напряжение, равное нулю, некоторому произвольно выбранному элементу цепи, а затем назначать напряжения для других элементов, измеренные относительно этой нулевой точки. Не имеет значения, какой элемент выбран в качестве нулевой точки — функция цепи зависит только от разности, а не от напряжений как таковых . Однако в большинстве случаев и по соглашению нулевой уровень чаще всего присваивается той части цепи, которая находится в контакте с землей.
Тот же принцип применим к напряжению в биологии клетки. В электрически активной ткани разность потенциалов между любыми двумя точками можно измерить, вставив электрод в каждую точку, например, один внутри и один снаружи клетки, и подключив оба электрода к выводам того, что по сути является специализированным вольтметром. По соглашению, нулевое значение потенциала присваивается внешней стороне клетки, а знак разности потенциалов между внешней и внутренней частью определяется потенциалом внутренней части относительно внешнего нуля.
В математических терминах определение напряжения начинается с концепции электрического поля E , векторного поля, задающего величину и направление каждой точке пространства. Во многих ситуациях электрическое поле является консервативным полем , что означает, что его можно выразить как градиент скалярной функции V , то есть E = –∇ V. Это скалярное поле V называется распределением напряжения. Определение допускает произвольную константу интегрирования — вот почему абсолютные значения напряжения не имеют смысла. В общем случае электрические поля можно считать консервативными, только если магнитные поля не оказывают на них существенного влияния, но это условие обычно хорошо применимо к биологической ткани.
Поскольку электрическое поле является градиентом распределения напряжения, быстрые изменения напряжения в пределах небольшой области подразумевают сильное электрическое поле; и наоборот, если напряжение остается примерно одинаковым в пределах большой области, электрические поля в этой области должны быть слабыми. Сильное электрическое поле, эквивалентное сильному градиенту напряжения, подразумевает, что на любые заряженные частицы, находящиеся в пределах области, действует сильная сила.
Электрические сигналы в биологических организмах, как правило, управляются ионами . [6] Наиболее важными катионами для потенциала действия являются натрий (Na + ) и калий (K + ). [7] Оба они являются одновалентными катионами, которые несут один положительный заряд. Потенциалы действия могут также включать кальций (Ca 2+ ), [8] который является двухвалентным катионом, который несет двойной положительный заряд. Хлоридный анион (Cl − ) играет главную роль в потенциалах действия некоторых водорослей , [9] но играет незначительную роль в потенциалах действия большинства животных. [10]
Ионы пересекают клеточную мембрану под действием двух факторов: диффузии и электрических полей . Простой пример, в котором два раствора — A и B — разделены пористым барьером, иллюстрирует, что диффузия гарантирует, что они в конечном итоге смешаются в равные растворы. Это смешивание происходит из-за разницы в их концентрациях. Область с высокой концентрацией будет диффундировать в область с низкой концентрацией. Чтобы расширить пример, пусть раствор A содержит 30 ионов натрия и 30 ионов хлорида. Также пусть раствор B содержит только 20 ионов натрия и 20 ионов хлорида. Предполагая, что барьер позволяет обоим типам ионов проходить через него, тогда будет достигнуто устойчивое состояние, при котором оба раствора содержат 25 ионов натрия и 25 ионов хлорида. Однако если пористый барьер избирателен к тому, какие ионы пропускаются, то одна лишь диффузия не определит полученный раствор. Возвращаясь к предыдущему примеру, давайте теперь построим барьер, который проницаем только для ионов натрия. Теперь только натрию разрешено диффундировать через барьер из раствора А с более высокой концентрацией в растворе В с более низкой концентрацией. Это приведет к большему накоплению ионов натрия, чем ионов хлора в растворе В, и меньшему количеству ионов натрия, чем ионов хлора в растворе А.
Это означает, что в растворе B есть чистый положительный заряд из-за более высокой концентрации положительно заряженных ионов натрия, чем отрицательно заряженных ионов хлорида. Аналогично, в растворе A есть чистый отрицательный заряд из-за большей концентрации отрицательных ионов хлорида, чем положительных ионов натрия. Поскольку противоположные заряды притягиваются, а одноименные заряды отталкиваются, на ионы теперь также влияют электрические поля, а также силы диффузии. Поэтому положительные ионы натрия с меньшей вероятностью будут перемещаться в теперь более положительный раствор B и оставаться в теперь более отрицательном растворе A. Точка, в которой силы электрических полей полностью противодействуют силе, обусловленной диффузией, называется равновесным потенциалом. В этой точке чистый поток определенного иона (в данном случае натрия) равен нулю.

Каждая клетка заключена в плазматическую мембрану , которая имеет структуру липидного бислоя со многими типами крупных молекул, встроенных в нее. Поскольку она состоит из липидных молекул, плазматическая мембрана по своей природе имеет высокое электрическое сопротивление, другими словами, низкую собственную проницаемость для ионов. Однако некоторые из молекул, встроенных в мембрану, способны либо активно переносить ионы с одной стороны мембраны на другую, либо обеспечивать каналы, по которым они могут перемещаться. [11]
В электрической терминологии плазматическая мембрана функционирует как комбинированный резистор и конденсатор . Сопротивление возникает из-за того, что мембрана препятствует движению зарядов через нее. Емкость возникает из-за того, что липидный бислой настолько тонок, что накопление заряженных частиц на одной стороне приводит к возникновению электрической силы, которая тянет противоположно заряженные частицы к другой стороне. Емкость мембраны относительно не зависит от молекул, которые в нее встроены, поэтому она имеет более или менее инвариантное значение, оцениваемое в 2 мкФ/см 2 (общая емкость участка мембраны пропорциональна ее площади). С другой стороны, проводимость чистого липидного бислоя настолько низка, что в биологических ситуациях она всегда определяется проводимостью альтернативных путей, обеспечиваемых встроенными молекулами. Таким образом, емкость мембраны более или менее фиксирована, но сопротивление сильно варьируется.
Толщина плазматической мембраны оценивается примерно в 7-8 нанометров. Поскольку мембрана настолько тонкая, не требуется очень большого трансмембранного напряжения, чтобы создать внутри нее сильное электрическое поле. Типичные мембранные потенциалы в клетках животных составляют порядка 100 милливольт (то есть одну десятую вольта), но расчеты показывают, что это создает электрическое поле, близкое к максимальному, которое может выдержать мембрана — было подсчитано, что разница напряжений, намного превышающая 200 милливольт, может вызвать пробой диэлектрика , то есть дуговой разряд через мембрану.
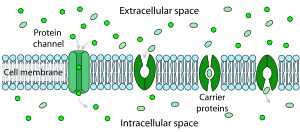
Сопротивление чистого липидного бислоя прохождению ионов через него очень велико, но структуры, встроенные в мембрану, могут значительно усилить движение ионов, как активно, так и пассивно , посредством механизмов, называемых облегченным транспортом и облегченной диффузией . Два типа структур, которые играют наибольшую роль, — это ионные каналы и ионные насосы , оба обычно образованы из скоплений белковых молекул. Ионные каналы обеспечивают проходы, по которым могут перемещаться ионы. В большинстве случаев ионный канал проницаем только для определенных типов ионов (например, натрия и калия, но не хлорида или кальция), и иногда проницаемость варьируется в зависимости от направления движения ионов. Ионные насосы, также известные как ионные транспортеры или белки-переносчики, активно транспортируют определенные типы ионов с одной стороны мембраны на другую, иногда используя для этого энергию, получаемую в результате метаболических процессов.
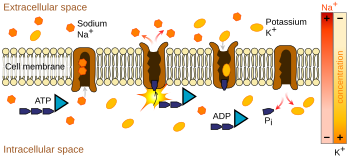
Ионные насосы — это интегральные мембранные белки , которые осуществляют активный транспорт , т. е. используют клеточную энергию (АТФ) для «перекачивания» ионов против градиента их концентрации. [12] Такие ионные насосы забирают ионы с одной стороны мембраны (уменьшая там их концентрацию) и высвобождают их с другой стороны (увеличивая там их концентрацию).
Ионный насос, наиболее важный для потенциала действия, — это натрий-калиевый насос , который переносит три иона натрия из клетки и два иона калия внутрь. [13] [14] Как следствие, концентрация ионов калия K + внутри нейрона примерно в 30 раз больше, чем внешняя концентрация, тогда как концентрация натрия снаружи примерно в пять раз больше, чем внутри. [14] [15] [16] Аналогичным образом, другие ионы имеют разные концентрации внутри и снаружи нейрона, такие как кальций , хлорид и магний . [16]
Если бы количество каждого типа ионов было равным, то натрий-калиевый насос был бы электрически нейтральным, но из-за обмена три к двум он дает чистое перемещение одного положительного заряда из внутриклеточного во внеклеточное для каждого цикла, тем самым способствуя положительной разнице потенциалов. Насос имеет три эффекта: (1) он делает концентрацию натрия высокой во внеклеточном пространстве и низкой во внутриклеточном пространстве; (2) он делает концентрацию калия высокой во внутриклеточном пространстве и низкой во внеклеточном пространстве; (3) он дает внутриклеточному пространству отрицательное напряжение по отношению к внеклеточному пространству.
Натрий-калиевый насос работает относительно медленно. Если бы ячейка была инициализирована с одинаковой концентрацией натрия и калия везде, насосу потребовались бы часы, чтобы установить равновесие. Насос работает постоянно, но становится все менее эффективным по мере снижения концентраций натрия и калия, доступных для перекачивания.
Ионные насосы влияют на потенциал действия только путем установления относительного соотношения внутриклеточных и внеклеточных концентраций ионов. Потенциал действия включает в себя в основном открытие и закрытие ионных каналов, а не ионных насосов. Если ионные насосы выключаются путем удаления их источника энергии или путем добавления ингибитора, такого как уабаин , аксон все еще может запустить сотни тысяч потенциалов действия, прежде чем их амплитуды начнут значительно уменьшаться. [12] В частности, ионные насосы не играют существенной роли в реполяризации мембраны после потенциала действия. [7]
Другим функционально важным ионным насосом является натрий-кальциевый обменник . Этот насос работает концептуально аналогично натрий-калиевому насосу, за исключением того, что в каждом цикле он обменивает три Na + из внеклеточного пространства на один Ca ++ из внутриклеточного пространства. Поскольку чистый поток заряда направлен внутрь, этот насос работает «под уклон», по сути, и, следовательно, не требует никакого источника энергии, кроме мембранного напряжения. Его наиболее важным эффектом является перекачивание кальция наружу — он также обеспечивает внутренний поток натрия, тем самым противодействуя натрий-калиевому насосу, но, поскольку общие концентрации натрия и калия намного выше, чем концентрации кальция, этот эффект относительно не важен. Конечный результат натрий-кальциевого обменника заключается в том, что в состоянии покоя внутриклеточные концентрации кальция становятся очень низкими.

Ионные каналы — это интегральные мембранные белки с порой, через которую ионы могут перемещаться между внеклеточным пространством и внутренней частью клетки. Большинство каналов специфичны (селективны) для одного иона; например, большинство калиевых каналов характеризуются соотношением селективности 1000:1 для калия по сравнению с натрием, хотя ионы калия и натрия имеют одинаковый заряд и лишь немного отличаются по радиусу. Пора канала обычно настолько мала, что ионы должны проходить через нее в порядке одинарной цепочки. [18] Поры канала могут быть как открытыми, так и закрытыми для прохождения ионов, хотя ряд каналов демонстрируют различные уровни субпроводимости. Когда канал открыт, ионы проникают через пору канала вниз по трансмембранному градиенту концентрации для этого конкретного иона. Скорость ионного потока через канал, т. е. амплитуда тока одного канала, определяется максимальной проводимостью канала и электрохимической движущей силой для этого иона, которая представляет собой разницу между мгновенным значением мембранного потенциала и значением потенциала реверсии . [19]
Канал может иметь несколько различных состояний (соответствующих различным конформациям белка), но каждое такое состояние либо открыто, либо закрыто. В общем случае закрытые состояния соответствуют либо сокращению поры, что делает ее непроходимой для иона, либо отдельной части белка, закупоривающей пору. Например, потенциал-зависимый натриевый канал подвергается инактивации , при которой часть белка перемещается в пору, запечатывая ее. [20] Эта инактивация отключает натриевый ток и играет решающую роль в потенциале действия.
Ионные каналы можно классифицировать по тому, как они реагируют на окружающую среду. [21] Например, ионные каналы, участвующие в потенциале действия, являются чувствительными к напряжению каналами ; они открываются и закрываются в ответ на напряжение на мембране. Лиганд-управляемые каналы образуют еще один важный класс; эти ионные каналы открываются и закрываются в ответ на связывание молекулы лиганда , например, нейротрансмиттера . Другие ионные каналы открываются и закрываются под действием механических сил. Еще другие ионные каналы, например, каналы сенсорных нейронов , открываются и закрываются в ответ на другие стимулы, такие как свет, температура или давление.
Каналы утечки являются простейшим типом ионных каналов, поскольку их проницаемость более или менее постоянна. Типы каналов утечки, которые имеют наибольшее значение в нейронах, — это калиевые и хлоридные каналы. Даже они не являются идеально постоянными по своим свойствам: во-первых, большинство из них зависят от напряжения в том смысле, что они проводят лучше в одном направлении, чем в другом (другими словами, они являются выпрямителями ); во-вторых, некоторые из них могут быть отключены химическими лигандами, хотя им не требуются лиганды для работы.
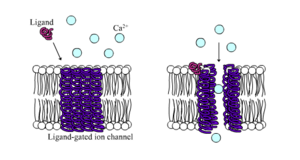
Лиганд-управляемые ионные каналы — это каналы, проницаемость которых значительно увеличивается, когда какой-либо тип химического лиганда связывается с белковой структурой. Животные клетки содержат сотни, если не тысячи, типов таких каналов. Большая их часть функционирует как рецепторы нейротрансмиттеров — они встречаются в постсинаптических участках, а химический лиганд, который их открывает, высвобождается пресинаптическим окончанием аксона . Одним из примеров этого типа является рецептор AMPA , рецептор для нейротрансмиттера глутамата , который при активации обеспечивает прохождение ионов натрия и калия. Другим примером является рецептор GABA A , рецептор для нейротрансмиттера GABA , который при активации обеспечивает прохождение ионов хлора.
Рецепторы нейротрансмиттеров активируются лигандами, которые появляются во внеклеточной области, но существуют и другие типы лиганд-управляемых каналов, которые контролируются взаимодействиями на внутриклеточной стороне.
Потенциал-зависимые ионные каналы , также известные как потенциал-зависимые ионные каналы , — это каналы, проницаемость которых зависит от мембранного потенциала. Они образуют еще одну очень большую группу, в которой каждый член имеет определенную ионную селективность и определенную зависимость от напряжения. Многие также зависят от времени — другими словами, они не реагируют немедленно на изменение напряжения, а только с задержкой.
Одним из важнейших членов этой группы является тип потенциалзависимого натриевого канала, который лежит в основе потенциалов действия — их иногда называют натриевыми каналами Ходжкина-Хаксли, поскольку они были первоначально охарактеризованы Аланом Ллойдом Ходжкиным и Эндрю Хаксли в их удостоенных Нобелевской премии исследованиях физиологии потенциала действия. Канал закрыт на уровне напряжения покоя, но резко открывается, когда напряжение превышает определенный порог, допуская большой приток ионов натрия, который вызывает очень быстрое изменение мембранного потенциала. Восстановление после потенциала действия частично зависит от типа потенциалзависимого калиевого канала, который закрыт на уровне напряжения покоя, но открывается вследствие большого изменения напряжения, производимого во время потенциала действия.
Потенциал реверсии (или потенциал равновесия ) иона — это значение трансмембранного напряжения, при котором диффузионные и электрические силы уравновешиваются, так что нет чистого потока ионов через мембрану. Это означает, что трансмембранное напряжение точно противодействует силе диффузии иона, так что чистый ток иона через мембрану равен нулю и не изменяется. Потенциал реверсии важен, поскольку он дает напряжение, которое действует на каналы, проницаемые для этого иона, — другими словами, он дает напряжение, которое генерирует градиент концентрации ионов, когда он действует как батарея .
Равновесный потенциал конкретного иона обычно обозначается обозначением E ion . Равновесный потенциал для любого иона можно рассчитать с помощью уравнения Нернста . [22] Например, потенциал реверсии для ионов калия будет следующим:
где
Даже если два разных иона имеют одинаковый заряд (т. е. K + и Na + ), они все равно могут иметь очень разные равновесные потенциалы, при условии, что их внешние и/или внутренние концентрации различаются. Возьмем, к примеру, равновесные потенциалы калия и натрия в нейронах. Равновесный потенциал калия E K составляет −84 мВ при 5 мМ калия снаружи и 140 мМ внутри. С другой стороны, равновесный потенциал натрия, E Na , составляет приблизительно +66 мВ при приблизительно 12 мМ натрия внутри и 140 мМ снаружи. [примечание 1]
Мембранный потенциал покоя нейрона фактически изменяется в ходе развития организма . Для того чтобы нейрон в конечном итоге принял свою полную взрослую функцию, его потенциал должен жестко регулироваться в ходе развития. По мере того, как организм прогрессирует в развитии, мембранный потенциал покоя становится более отрицательным. [23] Глиальные клетки также дифференцируются и пролиферируют по мере развития в мозге . [24] Добавление этих глиальных клеток увеличивает способность организма регулировать внеклеточный калий . Падение внеклеточного калия может привести к снижению мембранного потенциала на 35 мВ. [25]
Возбудимость клеток — это изменение мембранного потенциала, необходимое для клеточных реакций в различных тканях. Возбудимость клеток — это свойство, которое индуцируется во время раннего эмбриогенеза. [26] Возбудимость клеток также определяется как легкость, с которой может быть вызвана реакция. [27] Потенциалы покоя и пороговые потенциалы формируют основу возбудимости клеток, и эти процессы являются основополагающими для генерации градуированных потенциалов и потенциалов действия.
Наиболее важными регуляторами возбудимости клеток являются внеклеточные концентрации электролитов (т. е. Na + , K + , Ca 2+ , Cl − , Mg 2+ ) и связанные с ними белки. Важными белками, которые регулируют возбудимость клеток, являются потенциалзависимые ионные каналы , ионные транспортеры (например, Na+/K+-АТФаза , транспортеры магния , кислотно-щелочные транспортеры ), мембранные рецепторы и активируемые гиперполяризацией циклические нуклеотидзависимые каналы . [28] Например, калиевые каналы и кальций-чувствительные рецепторы являются важными регуляторами возбудимости в нейронах , сердечных миоцитах и многих других возбудимых клетках, таких как астроциты . [29] Ион кальция также является наиболее важным вторичным посредником в передаче сигналов возбудимых клеток . Активация синаптических рецепторов инициирует долгосрочные изменения возбудимости нейронов. [30] Гормоны щитовидной железы , надпочечников и другие также регулируют возбудимость клеток, например, прогестерон и эстроген модулируют возбудимость гладкомышечных клеток миометрия .
Считается, что многие типы клеток имеют возбудимую мембрану. Возбудимыми клетками являются нейроны, мышечные ( сердечные , скелетные , гладкие ), сосудистые эндотелиальные клетки , перициты , юкстагломерулярные клетки , интерстициальные клетки Кахаля , многие типы эпителиальных клеток (например , бета-клетки , альфа-клетки , дельта-клетки , энтероэндокринные клетки , легочные нейроэндокринные клетки , пинеалоциты ), глиальные клетки (например, астроциты), механорецепторные клетки (например, волосковые клетки и клетки Меркеля ), хеморецепторные клетки (например, гломусные клетки , вкусовые рецепторы ), некоторые растительные клетки и, возможно, иммунные клетки . [31] Астроциты демонстрируют форму неэлектрической возбудимости, основанную на внутриклеточных кальциевых вариациях, связанных с экспрессией нескольких рецепторов, через которые они могут обнаруживать синаптический сигнал. В нейронах существуют различные мембранные свойства в некоторых частях клетки, например, дендритная возбудимость наделяет нейроны способностью к одновременному обнаружению пространственно разделенных входов. [32]
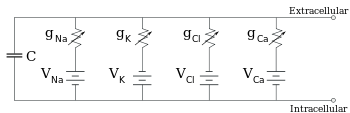
Электрофизиологи моделируют эффекты разницы ионной концентрации, ионных каналов и емкости мембраны в терминах эквивалентной схемы , которая предназначена для представления электрических свойств небольшого участка мембраны. Эквивалентная схема состоит из конденсатора, соединенного параллельно, с четырьмя путями, каждый из которых состоит из последовательно соединенной батареи с переменной проводимостью. Емкость определяется свойствами липидного бислоя и принимается фиксированной. Каждый из четырех параллельных путей исходит от одного из основных ионов: натрия, калия, хлорида и кальция. Напряжение каждого ионного пути определяется концентрацией иона на каждой стороне мембраны; см. раздел «Обратный потенциал» выше. Проводимость каждого ионного пути в любой момент времени определяется состояниями всех ионных каналов, которые потенциально проницаемы для этого иона, включая каналы утечки, лиганд-управляемые каналы и потенциал-управляемые ионные каналы.
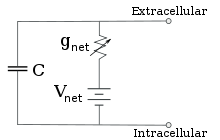
Для фиксированных концентраций ионов и фиксированных значений проводимости ионного канала эквивалентная схема может быть дополнительно сведена с использованием уравнения Голдмана , как описано ниже, к схеме, содержащей емкость параллельно с батареей и проводимостью. В электрических терминах это тип RC-цепи (цепь сопротивления-емкости), и ее электрические свойства очень просты. Начиная с любого начального состояния, ток, текущий либо через проводимость, либо через емкость, затухает с экспоненциальным ходом времени с постоянной времени τ = RC , где C — емкость мембранного участка, а R = 1/g net — чистое сопротивление. Для реалистичных ситуаций постоянная времени обычно лежит в диапазоне 1–100 миллисекунд. В большинстве случаев изменения проводимости ионных каналов происходят в более быстром масштабе времени, поэтому RC-цепь не является хорошим приближением; однако дифференциальное уравнение, используемое для моделирования мембранного участка, обычно является модифицированной версией уравнения RC-цепи.
Когда мембранный потенциал клетки в течение длительного периода времени не изменяется существенно, его называют потенциалом покоя или напряжением покоя. Этот термин используется для мембранного потенциала невозбудимых клеток, а также для мембранного потенциала возбудимых клеток при отсутствии возбуждения. В возбудимых клетках другими возможными состояниями являются градуированные мембранные потенциалы (переменной амплитуды) и потенциалы действия, которые представляют собой большие, все или ничего подъемы мембранного потенциала, которые обычно следуют фиксированному временному курсу. Возбудимые клетки включают нейроны , мышечные клетки и некоторые секреторные клетки в железах . Однако даже в других типах клеток мембранное напряжение может претерпевать изменения в ответ на экологические или внутриклеточные стимулы. Например, деполяризация плазматической мембраны, по-видимому, является важным шагом в запрограммированной смерти клетки . [33]
Взаимодействия, которые генерируют потенциал покоя, моделируются уравнением Голдмана . [34] Это похоже по форме на уравнение Нернста, показанное выше, в том, что оно основано на зарядах рассматриваемых ионов, а также на разнице между их внутренней и внешней концентрациями. Однако оно также учитывает относительную проницаемость плазматической мембраны для каждого рассматриваемого иона.
Три иона, которые появляются в этом уравнении, это калий (K + ), натрий (Na + ) и хлорид (Cl − ). Кальций опущен, но может быть добавлен, чтобы иметь дело с ситуациями, в которых он играет значительную роль. [35] Будучи анионом, хлоридные термины трактуются иначе, чем катионные термины; внутриклеточная концентрация находится в числителе, а внеклеточная концентрация в знаменателе, который обратен катионным терминам. Pi обозначает относительную проницаемость иона типа i.
По сути, формула Голдмана выражает мембранный потенциал как средневзвешенное значение потенциалов реверсии для отдельных типов ионов, взвешенных по проницаемости. (Хотя мембранный потенциал изменяется примерно на 100 мВ во время потенциала действия, концентрации ионов внутри и снаружи клетки существенно не меняются. Они остаются близкими к своим соответствующим концентрациям, когда мембрана находится в состоянии покоя.) В большинстве клеток животных проницаемость для калия намного выше в состоянии покоя, чем проницаемость для натрия. Как следствие, потенциал покоя обычно близок к потенциалу реверсии калия. [36] [37] Проницаемость для хлорида может быть достаточно высокой, чтобы быть значительной, но, в отличие от других ионов, хлорид активно не перекачивается и, следовательно, уравновешивается при потенциале реверсии, очень близком к потенциалу покоя, определяемому другими ионами.
Значения покоящегося мембранного потенциала в большинстве клеток животных обычно варьируются между потенциалом реверсии калия (обычно около -80 мВ) и около -40 мВ. Потенциал покоя в возбудимых клетках (способных производить потенциалы действия) обычно около -60 мВ — более деполяризованные напряжения привели бы к спонтанной генерации потенциалов действия. Незрелые или недифференцированные клетки показывают весьма изменчивые значения покоящегося напряжения, обычно значительно более положительные, чем в дифференцированных клетках. [38] В таких клетках значение покоящегося потенциала коррелирует со степенью дифференциации: недифференцированные клетки в некоторых случаях могут вообще не показывать никакой разницы трансмембранного напряжения.
Поддержание потенциала покоя может быть метаболически затратным для клетки из-за необходимости активной перекачки ионов для противодействия потерям из-за каналов утечки. Стоимость является самой высокой, когда функция клетки требует особенно деполяризованного значения мембранного напряжения. Например, потенциал покоя в фоторецепторах мясной мухи ( Calliphora vicina ), адаптированных к дневному свету, может достигать -30 мВ. [39] Этот повышенный мембранный потенциал позволяет клеткам очень быстро реагировать на визуальные входы; стоимость заключается в том, что поддержание потенциала покоя может потреблять более 20% от общего клеточного АТФ . [40]
С другой стороны, высокий потенциал покоя в недифференцированных клетках не обязательно влечет за собой высокие метаболические затраты. Этот очевидный парадокс разрешается путем изучения происхождения этого потенциала покоя. Малодифференцированные клетки характеризуются чрезвычайно высоким входным сопротивлением, [38] что подразумевает, что на этой стадии жизни клетки присутствует мало каналов утечки. Как очевидный результат, проницаемость калия становится похожей на проницаемость для ионов натрия, что помещает потенциал покоя между потенциалами реверсии для натрия и калия, как обсуждалось выше. Уменьшенные токи утечки также означают, что нет необходимости в активной перекачке для компенсации, поэтому низкие метаболические затраты.
Как объяснялось выше, потенциал в любой точке мембраны клетки определяется разницей в концентрации ионов между внутриклеточной и внеклеточной областями и проницаемостью мембраны для каждого типа ионов. Концентрации ионов обычно не изменяются очень быстро (за исключением Ca 2+ , где базовая внутриклеточная концентрация настолько низка, что даже небольшой приток может увеличить ее на порядки величины), но проницаемости ионов могут изменяться за доли миллисекунды в результате активации лиганд-управляемых ионных каналов. Изменение мембранного потенциала может быть как большим, так и малым, в зависимости от того, сколько ионных каналов активировано и какого они типа, и может быть как длинным, так и коротким, в зависимости от продолжительности времени, в течение которого каналы остаются открытыми. Изменения этого типа называются градуированными потенциалами , в отличие от потенциалов действия, которые имеют фиксированную амплитуду и временной ход.
Как можно вывести из уравнения Голдмана , показанного выше, эффект увеличения проницаемости мембраны для определенного типа ионов смещает мембранный потенциал в сторону потенциала реверсии для этого иона. Таким образом, открытие каналов Na + смещает мембранный потенциал в сторону потенциала реверсии Na + , который обычно составляет около +100 мВ. Аналогично, открытие каналов K + смещает мембранный потенциал в сторону примерно –90 мВ, а открытие каналов Cl − смещает его в сторону примерно –70 мВ (потенциал покоя большинства мембран). Таким образом, каналы Na + смещают мембранный потенциал в положительном направлении, каналы K + смещают его в отрицательном направлении (за исключением случаев, когда мембрана гиперполяризована до значения, более отрицательного, чем потенциал реверсии K + ), а каналы Cl − имеют тенденцию смещать его в сторону потенциала покоя.

Градуированные мембранные потенциалы особенно важны в нейронах , где они производятся синапсами — временное изменение мембранного потенциала, вызванное активацией синапса единичным градуированным потенциалом или потенциалом действия, называется постсинаптическим потенциалом . Нейротрансмиттеры , которые открывают Na + -каналы, обычно заставляют мембранный потенциал становиться более положительным, в то время как нейротрансмиттеры, которые активируют K + -каналы, обычно заставляют его становиться более отрицательным; те, которые ингибируют эти каналы, как правило, оказывают противоположный эффект.
То, считается ли постсинаптический потенциал возбуждающим или тормозным, зависит от потенциала реверсии для ионов этого тока и порога для клетки, чтобы запустить потенциал действия (около –50 мВ). Постсинаптический ток с потенциалом реверсии выше порога, такой как типичный ток Na + , считается возбуждающим. Ток с потенциалом реверсии ниже порога, такой как типичный ток K + , считается тормозящим. Ток с потенциалом реверсии выше потенциала покоя, но ниже порога, сам по себе не будет вызывать потенциалы действия, но будет производить подпороговые колебания мембранного потенциала . Таким образом, нейротрансмиттеры, которые действуют, открывая каналы Na +, производят возбуждающие постсинаптические потенциалы , или EPSP, тогда как нейротрансмиттеры, которые действуют, открывая каналы K + или Cl −, обычно производят тормозные постсинаптические потенциалы , или IPSP. Когда несколько типов каналов открыты в течение одного и того же периода времени, их постсинаптические потенциалы суммируются (складываются).
С точки зрения биофизики, покоящийся мембранный потенциал — это просто мембранный потенциал, который является результатом мембранной проницаемости, преобладающей, когда клетка отдыхает. Вышеуказанное уравнение средневзвешенных значений всегда применимо, но следующий подход может быть более легко визуализирован. В любой момент времени для иона есть два фактора, которые определяют, какое влияние этот ион будет иметь на мембранный потенциал клетки:
Если движущая сила высока, то ион «проталкивается» через мембрану. Если проницаемость высока, то иону будет легче диффундировать через мембрану.
Итак, в покоящейся мембране, в то время как движущая сила для калия низкая, его проницаемость очень высокая. Натрий имеет огромную движущую силу, но почти не имеет покоящейся проницаемости. В этом случае калий переносит примерно в 20 раз больше тока, чем натрий, и, таким образом, имеет в 20 раз большее влияние на E m, чем натрий.
Однако рассмотрим другой случай — пик потенциала действия. Здесь проницаемость для Na высокая, а проницаемость для K относительно низкая. Таким образом, мембрана перемещается в положение, близкое к E Na и далекое от E K .
Чем больше ионов проникает, тем сложнее становится предсказать мембранный потенциал. Однако это можно сделать с помощью уравнения Голдмана-Ходжкина-Каца или уравнения взвешенных средних. Подставляя градиенты концентрации и проницаемости ионов в любой момент времени, можно определить мембранный потенциал в этот момент. Уравнения GHK означают, что в любой момент времени значение мембранного потенциала будет взвешенным средним равновесных потенциалов всех проникающих ионов. «Взвешивание» — это относительная проницаемость ионов через мембрану.
В то время как клетки расходуют энергию на транспорт ионов и устанавливают трансмембранный потенциал, они используют этот потенциал в свою очередь для транспортировки других ионов и метаболитов, таких как сахар. Трансмембранный потенциал митохондрий стимулирует производство АТФ , который является общей валютой биологической энергии.
Клетки могут использовать энергию, которую они хранят в потенциале покоя, для управления потенциалами действия или другими формами возбуждения. Эти изменения в мембранном потенциале обеспечивают связь с другими клетками (как в случае с потенциалами действия) или инициируют изменения внутри клетки, что происходит в яйцеклетке , когда она оплодотворяется спермой .
Изменения диэлектрических свойств плазматической мембраны могут служить признаком таких основных заболеваний, как диабет и дислипидемия. [41]
В нейрональных клетках потенциал действия начинается с напора ионов натрия в клетку через натриевые каналы, что приводит к деполяризации, тогда как восстановление включает в себя напор калия наружу через калиевые каналы. Оба эти потока происходят путем пассивной диффузии .
Доза соли может активировать работающие нейроны свежего куска мяса, вызывая мышечные спазмы. [42] [43] [44] [45] [46]