
В химии энантиомер ( /ɪˈnænti.əmər , ɛ-, -oʊ-/ [1] ih-NAN-tee-ə-mər ; от древнегреческого ἐναντίος (enantíos) «противоположный» и μέρος (méros) «часть») — также называемый оптическим изомером [ 2] антиподом [3] или оптическим антиподом [4] — это одна из пары молекулярных сущностей, которые являются зеркальными отражениями друг друга и не могут быть совмещены. Энантиомеры друг друга очень похожи на правую и левую руки; без зеркального отображения одной из них руки не могут быть совмещены друг с другом. [5] Это исключительно отношение хиральности и постоянные трехмерные отношения между молекулами или другими химическими структурами: никакое количество переориентации молекулы в целом или конформационных изменений не преобразует одно химическое вещество в его энантиомер. Химические структуры с хиральностью вращают плоскополяризованный свет. [6] Смесь равных количеств каждого энантиомера, рацемическая смесь или рацемат , не вращает свет. [7] [8] [9]
Стереоизомеры включают как энантиомеры, так и диастереомеры . Диастереомеры, как и энантиомеры, имеют одну и ту же молекулярную формулу и также не накладываются друг на друга; однако они не являются зеркальными отражениями друг друга. [10]
Существует три общих соглашения об именовании для указания одного из двух энантиомеров ( абсолютной конфигурации ) данной хиральной молекулы: система R/S основана на геометрии молекулы; система (+)- и (−)- (также записываемая с использованием устаревших эквивалентов d- и l- ) основана на ее свойствах оптического вращения ; а система D / L основана на отношении молекулы к энантиомерам глицеральдегида .
Система R/S основана на геометрии молекулы относительно хирального центра. [11] Система R/S назначается молекуле на основе правил приоритета, назначаемых правилами приоритета Кана–Ингольда–Прелога , в которых группе или атому с наибольшим атомным номером назначается наивысший приоритет, а группе или атому с наименьшим атомным номером назначается низший приоритет.
Символ (+) или (−) используется для указания оптического вращения молекулы — направления, в котором вращается поляризация света при прохождении через раствор, содержащий молекулу. [12] Когда молекула обозначается как правовращающая, она вращает плоскость поляризованного света по часовой стрелке и также может быть обозначена как (+). [11] Когда она обозначается как левовращающая, она вращает плоскость поляризованного света против часовой стрелки и также может быть обозначена как (−). [11]
Латинские слова для левого — laevus и sinister , а слово для правого — dexter (или rectus в значении правильный или добродетельный). Английское слово right является родственным rectus . Отсюда и произошли обозначения D/L и R/S, а также использование префиксов levo- и dextro- в общих названиях .
Префикс ar- , от латинского recto (правый), применяется к правосторонней версии; es- , от латинского sinister (левый), к левосторонней молекуле. Пример: кетамин , аркетамин , эскетамин . [13]

Асимметричный атом называется центром хиральности , [14] [15] типом стереоцентра . Центр хиральности также называется хиральным центром [16] [17] [18] или асимметричным центром . [19] Некоторые источники используют термины стереоцентр , стереогенный центр , стереогенный атом или стереоген исключительно для обозначения центра хиральности, [16] [18] [20], в то время как другие используют эти термины более широко, чтобы также обозначать центры, которые приводят к диастереомерам (стереоизомерам, которые не являются энантиомерами). [15] [21] [22]
Соединения, которые содержат ровно один (или любое нечетное число) асимметричных атомов, всегда хиральны. Однако соединения, которые содержат четное число асимметричных атомов, иногда не обладают хиральностью, поскольку они расположены в зеркально-симметричных парах, и известны как мезосоединения . Например, мезовинная кислота (показана справа) имеет два асимметричных атома углерода, но она не проявляет энантиомерию, поскольку существует плоскость зеркальной симметрии. Наоборот, существуют формы хиральности, которые не требуют асимметричных атомов, такие как аксиальная , планарная и спиральная хиральность. [16] : стр. 3
Несмотря на то, что хиральная молекула не имеет симметрии отражения (C s ) и симметрии роторного отражения (S 2 n ), она может иметь другие молекулярные симметрии , и ее симметрия описывается одной из хиральных точечных групп : C n , D n , T, O или I. Например, перекись водорода является хиральной и имеет симметрию C 2 (двукратную вращательную). Обычным хиральным случаем является точечная группа C 1 , что означает отсутствие симметрии, что имеет место для молочной кислоты.
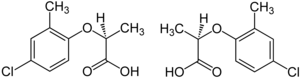

Примером такого энантиомера является седативный препарат талидомид , который продавался в ряде стран мира с 1957 по 1961 год. Он был изъят с рынка, когда было обнаружено, что он вызывает врожденные дефекты. Один энантиомер вызывал желаемые седативные эффекты, в то время как другой, неизбежно [23] присутствующий в равных количествах, вызывал врожденные дефекты. [24]
Гербицид мекопроп представляет собой рацемическую смесь, в которой гербицидной активностью обладает (R)-(+)-энантиомер («Мекопроп-П», «Дуплосан КВ»). [ 25 ]
Другим примером являются антидепрессанты эсциталопрам и циталопрам . Циталопрам — это рацемат [смесь ( S )-циталопрама и ( R )-циталопрама в соотношении 1:1]; эсциталопрам [( S )-циталопрам] — это чистый энантиомер. Дозировки эсциталопрама обычно составляют 1/2 от дозировок циталопрама. Здесь (S)-циталопрам называется хиральным переключателем циталопрама.
Энантиочистые соединения состоят только из одного из двух энантиомеров. Энантиочистота имеет практическое значение, поскольку такие композиции обладают повышенной терапевтической эффективностью. [26] Переход от рацемического препарата к энантиочистому препарату называется хиральным переключением . Во многих случаях энантиомеры имеют различные эффекты. Один случай — это пропоксифен. Энантиомерная пара пропоксифена отдельно продается Eli Lilly and company. Одним из партнеров является декстропропоксифен , анальгетик (Darvon), а другой называется левопропоксифен , эффективное противокашлевое средство (Novrad). [27] [28] Интересно отметить, что торговые наименования препаратов, DARVON и NOVRAD, также отражают химическую зеркальную связь. В других случаях клинической пользы для пациента может не быть. В некоторых юрисдикциях препараты с одним энантиомером патентуются отдельно от рацемической смеси. [29] Возможно, что активен только один из энантиомеров. Или, может быть, активны оба, и в этом случае разделение смеси не имеет объективных преимуществ, но продлевает патентоспособность препарата. [30]
При отсутствии эффективной энантиомерной среды ( предшественника , хирального катализатора или кинетического разделения ) разделение рацемической смеси на ее энантиомерные компоненты невозможно, хотя некоторые рацемические смеси спонтанно кристаллизуются в виде рацемического конгломерата , в котором кристаллы энантиомеров физически разделены и могут быть разделены механически. Однако большинство рацематов образуют кристаллы, содержащие оба энантиомера в соотношении 1:1.
В своей пионерской работе Луи Пастер смог выделить изомеры тартрата аммония натрия , поскольку отдельные энантиомеры кристаллизуются отдельно от раствора. Конечно, получаются равные количества энантиоморфных кристаллов, но два вида кристаллов можно разделить пинцетом. Такое поведение необычно. Менее распространенным методом является самодиспропорционирование энантиомера .
Вторая стратегия — асимметричный синтез: использование различных методов для получения желаемого соединения в высоком энантиомерном избытке . Охватываемые методы включают использование хиральных исходных материалов ( синтез хирального пула ), использование хиральных вспомогательных веществ и хиральных катализаторов, а также применение асимметричной индукции . Использование ферментов ( биокатализ ) также может привести к получению желаемого соединения.
Третья стратегия — это энантиоконвергентный синтез, синтез одного энантиомера из рацемического предшественника с использованием обоих энантиомеров. Используя хиральный катализатор, оба энантиомера реагента приводят к одному энантиомеру продукта. [31]
Энантиомеры могут быть не изолированы, если существует доступный путь для рацемизации (взаимного превращения энантиоморфов с образованием рацемической смеси) при заданной температуре и времени. Например, амины с тремя различными заместителями являются хиральными, но за немногими исключениями (например, замещенные N -хлоразиридины) они быстро подвергаются « инверсии зонтика » при комнатной температуре, что приводит к рацемизации. Если рацемизация происходит достаточно быстро, молекулу часто можно рассматривать как ахиральную, усредненную структуру.
Для всех намерений и целей каждый энантиомер в паре имеет одинаковую энергию. Однако теоретическая физика предсказывает, что из-за нарушения четности слабого ядерного взаимодействия (единственной силы в природе, которая может «отличать левое от правого»), на самом деле существует крошечная разница в энергии между энантиомерами (порядка 10−12 эВ или 10−10 кДж /моль или меньше) из-за механизма слабого нейтрального тока . Эта разница в энергии намного меньше, чем изменения энергии, вызванные даже небольшими изменениями в молекулярной конформации, и слишком мала для измерения с помощью современных технологий, и поэтому химически несущественна. [17] [32] [33] В том смысле, который используют физики элементарных частиц, «истинный» энантиомер молекулы, который имеет точно такое же содержание массы и энергии, как и исходная молекула, является зеркальным отражением, которое также построено из антиматерии (антипротонов, антинейтронов и позитронов). [17] В этой статье термин «энантиомер» используется только в химическом смысле, в отношении соединений обычного вещества, которые не накладываются на свое зеркальное отражение.
Квазиэнантиомеры — это молекулярные виды, которые не являются строгими энантиомерами, но ведут себя так, как будто они ими являются. В квазиэнантиомерах отражается большая часть молекулы; однако атом или группа внутри молекулы заменяются на аналогичный атом или группу. [34] Квазиэнантиомеры также могут быть определены как молекулы, которые потенциально могут стать энантиомерами, если атом или группа в молекуле заменяются. [35] Примером квазиэнантиомеров могут быть ( S )-бромбутан и ( R )-иодбутан. При нормальных условиях энантиомеры для ( S )-бромбутана и ( R )-иодбутана будут ( R) -бромбутан и ( S )-иодбутан соответственно. Квазиэнантиомеры также будут производить квазирацематы, которые похожи на нормальные рацематы (см. Рацемическая смесь ) тем, что они образуют равную смесь квазиэнантиомеров . [34]
Хотя квазиэнантиомеры не считаются фактическими энантиомерами, соглашение о наименовании для них также следует той же тенденции, что и для энантиомеров, если рассматривать конфигурации ( R ) и ( S ), которые рассматриваются с геометрической точки зрения (см. правила приоритета Кана–Ингольда–Прелога ).
Квазиэнантиомеры находят применение в параллельном кинетическом разделении . [36]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )