Простациклин (также называемый простагландином I 2 или PGI 2 ) является простагландином, членом семейства эйкозаноидных липидных молекул . Он подавляет активацию тромбоцитов, а также является эффективным вазодилататором.
При использовании в качестве лекарственного средства он также известен как эпопростенол . [1] Иногда эти термины используются взаимозаменяемо. [2]
Простациклин в основном предотвращает образование тромбоцитарной пробки , участвующей в первичном гемостазе (часть образования сгустка крови ). Он делает это, ингибируя активацию тромбоцитов. [3] Он также является эффективным вазодилататором . Взаимодействия простациклина контрастируют с взаимодействиями тромбоксана (TXA 2 ), другого эйкозаноида. Обе молекулы получены из арахидоновой кислоты и работают вместе с противоположными эффектами агрегации тромбоцитов. Это убедительно свидетельствует о механизме сердечно-сосудистого гомеостаза между этими двумя гормонами в отношении сосудистого повреждения.
Он используется для лечения легочной артериальной гипертензии (ЛАГ), [4] [5] [6] легочного фиброза , [7] а также атеросклероза . [7] Простациклины назначают людям с ЛАГ III или IV класса. [8]
Простациклин, период полураспада которого составляет 42 секунды, [9] распадается на 6-кето-PGF 1 , который является гораздо более слабым вазодилататором. Способ стабилизации простациклина в его активной форме, особенно во время доставки препарата, заключается в приготовлении простациклина в щелочном буфере. Даже при физиологическом pH простациклин может быстро образовывать неактивный продукт гидратации 6-кето-простагландин F1α. [10]
Как упоминалось выше, простациклин (PGI 2 ) высвобождается здоровыми эндотелиальными клетками и выполняет свою функцию через паракринный сигнальный каскад, который включает рецепторы, сопряженные с G-белком, на близлежащих тромбоцитах и эндотелиальных клетках. Тромбоцитарный рецептор, сопряженный с G-белком ( рецептор простациклина ), активируется, когда он связывается с PGI 2 . Эта активация, в свою очередь, сигнализирует аденилатциклазе о необходимости вырабатывать цАМФ . цАМФ продолжает ингибировать любую чрезмерную активацию тромбоцитов (чтобы способствовать циркуляции), а также противодействует любому повышению уровня цитозольного кальция, которое может возникнуть в результате связывания тромбоксана А2 (TXA 2 ) (что приводит к активации тромбоцитов и последующей коагуляции ). PGI 2 также связывается с эндотелиальными рецепторами простациклина и таким же образом повышает уровень цАМФ в цитозоле. Затем этот цАМФ продолжает активировать протеинкиназу А (PKA). Затем PKA продолжает каскад, способствуя фосфорилированию киназы легкой цепи миозина , что ингибирует ее и приводит к расслаблению гладких мышц и вазодилатации . Можно отметить, что PGI 2 и TXA 2 действуют как физиологические антагонисты.

Синтетические аналоги простациклина ( илопрост , цисапрост) применяются внутривенно, подкожно или ингаляционно:
Выработка простациклина подавляется действием НПВП на ферменты циклооксигеназы COX1 и COX2. Они преобразуют арахидоновую кислоту в простагландин H2 (PGH 2 ), непосредственный предшественник простациклина. Поскольку тромбоксан ( эйкозаноидный стимулятор агрегации тромбоцитов) также находится ниже ферментов COX, можно подумать, что действие НПВП будет действовать для балансировки. Однако концентрации простациклина восстанавливаются гораздо быстрее, чем уровни тромбоксана, поэтому прием аспирина изначально не оказывает практически никакого эффекта, но в конечном итоге предотвращает агрегацию тромбоцитов (эффект простагландинов преобладает по мере их регенерации). Это объясняется пониманием клеток, которые вырабатывают каждую молекулу, TXA 2 и PGI 2 . Поскольку PGI 2 в первую очередь вырабатывается в ядросодержащих эндотелиальных клетках, ингибирование COX НПВП может быть преодолено со временем за счет повышенной активации гена COX и последующей выработки большего количества ферментов COX для катализа образования PGI 2. Напротив, TXA 2 высвобождается в первую очередь безъядерными тромбоцитами, которые не способны реагировать на ингибирование COX НПВП дополнительной транскрипцией гена COX, поскольку у них отсутствует материал ДНК, необходимый для выполнения такой задачи. Это позволяет НПВП приводить к доминированию PGI 2 , что способствует циркуляции и замедляет тромбоз .
У пациентов с легочной гипертензией ингаляционный эпопростенол снижает легочное давление и улучшает ударный объем правого желудочка у пациентов, перенесших операцию на сердце. Доза 60 мкг гемодинамически безопасна, и ее эффект полностью обращается через 25 минут. Не было обнаружено никаких доказательств дисфункции тромбоцитов или увеличения хирургического кровотечения после введения ингаляционного эпопростенола. [12] Известно, что препарат вызывает приливы, головные боли и гипотонию. [13]
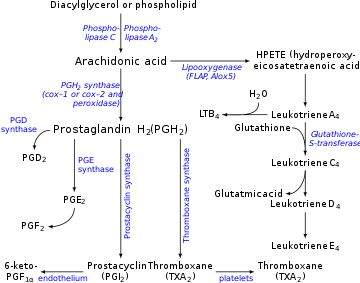
Простациклин вырабатывается в эндотелиальных клетках , которые выстилают стенки артерий и вен, [14] из простагландина H 2 (PGH 2 ) под действием фермента простациклинсинтазы . Хотя простациклин считается независимым медиатором, в номенклатуре эйкозаноидов он называется PGI 2 (простагландин I 2 ) и является членом простаноидов (вместе с простагландинами и тромбоксаном ). PGI 2 , полученный в основном из COX-2 у людей, является основным метаболитом арахидоната, высвобождаемым из сосудистого эндотелия. Это спорный момент, некоторые назначают COX 1 в качестве основного простациклин-продуцирующего циклооксигеназы в эндотелиальных клетках кровеносных сосудов. [15]
Простагландин серии 3 PGH 3 также следует пути простациклинсинтазы, давая другой простациклин, PGI 3 . [16] Неквалифицированный термин «простациклин» обычно относится к PGI 2 . PGI 2 происходит из ω-6 арахидоновой кислоты . PGI 3 происходит из ω-3 EPA .
Простациклин может быть синтезирован из метилового эфира простагландина F2α . [17] После синтеза препарат восстанавливается в физиологическом растворе и глицерине. [ 18]
Поскольку простациклин химически очень лабилен, для оценки скорости его синтеза используется количественное определение его неактивных метаболитов, а не активных соединений. [19]
В 1960-х годах британская исследовательская группа под руководством профессора Джона Вейна начала изучать роль простагландинов в анафилаксии и респираторных заболеваниях. Работая с командой из Королевского колледжа хирургов , Вейн обнаружил, что аспирин и другие пероральные противовоспалительные препараты работают, подавляя синтез простагландинов. Это критическое открытие открыло дверь к более широкому пониманию роли простагландинов в организме.
Группа ученых из The Wellcome Foundation под руководством Сальвадора Монкады идентифицировала липидный медиатор, который они назвали «PG-X», который подавляет агрегацию тромбоцитов. PG-X, позже известный как простациклин, в 30 раз сильнее любого другого известного тогда антиагрегационного агента. Они сделали это, одновременно ища фермент, который генерирует другой нестабильный простаноид, тромбоксан А2 [20]
В 1976 году Вейн и его коллеги-исследователи Сальвадор Монкада , Рышард Грыглевски и Стюарт Бантинг опубликовали первую статью о простациклине в журнале Nature . [21] В результате сотрудничества была синтезирована молекула, которая была названа эпопростенолом. Но, как и в случае с нативным простациклином, молекула эпопростенола нестабильна в растворе и склонна к быстрой деградации. [ необходима цитата ] Это представляло собой проблему как для экспериментов in vitro, так и для клинических применений.
Чтобы преодолеть эту проблему, исследовательская группа, открывшая простациклин, продолжила исследования. Исследовательская группа синтезировала около 1000 аналогов. [ необходима цитата ]