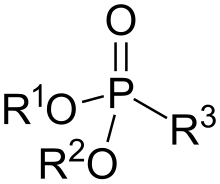
В органической химии фосфонаты или фосфоновые кислоты являются фосфорорганическими соединениями, содержащими группы C−PO(OR) 2 , где R представляет собой органическую группу ( алкил , арил ). Если R представляет собой водород, то соединение представляет собой диалкилфосфит , который является другой функциональной группой. Фосфоновые кислоты, обычно используемые в виде солей, обычно представляют собой нелетучие твердые вещества, которые плохо растворимы в органических растворителях , но растворимы в воде и обычных спиртах .
Многие коммерчески важные соединения являются фосфонатами, включая глифосат (активная молекула гербицида Roundup ) и этефон , широко используемый регулятор роста растений. Бисфосфонаты являются популярными препаратами для лечения остеопороза . [1]
В биохимии и медицинской химии фосфонатные группы используются как стабильные биоизостеры для фосфата, например, в противовирусном нуклеотидном аналоге, Тенофовире , одном из краеугольных камней терапии против ВИЧ . И есть указание, что производные фосфоната являются «многообещающими лигандами для ядерной медицины ». [2]
Фосфонаты имеют тетраэдрические фосфорные центры. Они структурно тесно связаны с фосфористой кислотой (и часто изготавливаются из нее) . [3]

Фосфонатные соли являются результатом депротонирования фосфоновых кислот, которые являются дипротонными кислотами:
Фосфонатные эфиры являются результатом конденсации фосфоновых кислот со спиртами.
Существует несколько методов получения фосфоновых кислот и их солей.
Большинство процессов начинаются с фосфористой кислоты (также известной как фосфоновая кислота, H 3 PO 3 ), используя ее реактивную связь P−H. [1] [3]
Фосфоновая кислота может быть алкилирована через реакцию Кабачника-Филдса или реакцию Пудовика , чтобы дать аминофосфонат , который полезен в качестве хелатирующих агентов. Одним из примеров является промышленное получение нитрилотрис(метиленфосфоновой кислоты) :
Фосфоновая кислота также может быть алкилирована производными акриловой кислоты, чтобы получить карбоксил-функционализированные фосфоновые кислоты. Эта реакция является вариантом присоединения Михаэля :
В реакции сочетания Хирао диалкилфосфиты (которые также можно рассматривать как диэфиры фосфоновой кислоты: (O=PH(OR) 2 ) вступают в катализируемую палладием реакцию сочетания с арилгалогенидом с образованием фосфоната.
Фосфоновые эфиры получают с помощью реакции Михаэлиса-Арбузова . Например, метилиодид катализирует превращение триметилфосфита в фосфонатный эфир диметилметилфосфонат :
Эти эфиры могут быть гидролизованы до кислоты (Me = метил):
В реакции Михаэлиса-Беккера диэфир фосфоновой кислоты водорода сначала депротонируется, а полученный анион алкилируется.
Винилфосфоновую кислоту можно получить реакцией PCl3 и ацетальдегида :
Этот аддукт реагирует с уксусной кислотой:
Этот хлорид подвергается дегидрохлорированию с получением целевого продукта:
В реакции Киннера-Перрена алкилфосфонилдихлориды и эфиры образуются путем алкилирования трихлорида фосфора в присутствии трихлорида алюминия . Алкилтрихлорфосфониевые соли являются промежуточными продуктами: [1]
РПЦл+
3Затем продукт можно разложить водой с образованием алкилфосфонового дихлорида RP(=O)Cl 2 .
Эфиры фосфонатов обычно подвержены гидролизу как в кислых, так и в основных условиях. Расщепление связи PC сложнее, но может быть достигнуто в агрессивных условиях.
В реакции Хорнера-Уодсворта-Эммонса диалкилфосфонаты депротонируются с образованием стабилизированных карбанионов , которые реагируют с альдегидами с образованием E-алкенов с отщеплением диалкилфосфата . [ 4]

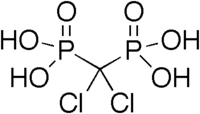
Соединения, содержащие 2 геминальные фосфонатные группы, известны как бисфосфонаты . Они были впервые синтезированы в 1897 году фон Байером и Хофманном и теперь составляют основу важного класса лекарств, используемых для лечения остеопороза и подобных заболеваний. Примерами являются HEDP (этидроновая кислота или Дидронель), которая готовится из фосфористой кислоты и уксусного ангидрида : [1]
Группа тиофосфоната — это функциональная группа, связанная с фосфонатом путем замены атома кислорода на серу. Они являются реактивным компонентом многих пестицидов и нервно-паралитических агентов . Замещенные тиофосфонаты могут иметь два основных структурных изомера, связывающихся через группы O или S, образуя тионовую и тиоловую формы соответственно. Это свойство они разделяют с родственными функциональными группами, такими как тиокарбоновые кислоты и органотиофосфаты .
Фосфонамидаты связаны с фосфонатами путем замены атома кислорода на азот. Они являются редко встречающейся функциональной группой. Примером может служить нервно-паралитический агент Табун .

Фосфонаты являются одним из трех источников поступления фосфата в биологические клетки. [ необходима ссылка ] Два других — это неорганический фосфат и органофосфат.
Природный фосфонат 2-аминоэтилфосфоновой кислоты был впервые обнаружен в 1959 году в растениях и многих животных, где он локализуется в мембранах. Фосфонаты довольно распространены среди различных организмов, от прокариот до эубактерий и грибов , моллюсков , насекомых и других. Впервые они были обнаружены в природных почвах Ньюманом и Тейтом (1980). Биологическая роль природных фосфонатов до сих пор плохо изучена. Бис- или полифосфонаты не были обнаружены в природе.
Было выявлено несколько природных фосфонатных веществ с антибиотическими свойствами. [5] К природным фосфонатным антибиотикам относятся фосфомицин , одобренный FDA для лечения неосложненной инфекции мочевыводящих путей , а также несколько доклинически исследованных веществ, таких как фосмидомицин (ингибитор изопренилсинтазы), SF-2312 (ингибитор гликолитического фермента енолазы , [6] и вещества с неизвестным механизмом действия, такие как алахопцин. Хотя фосфонаты являются глубоко непроницаемыми для клеток, природные фосфонатные антибиотики эффективны против ряда организмов, поскольку многие виды бактерий экспрессируют импортеры глицерол-3-фосфата и глюкозо-6-фосфата, которые могут быть захвачены фосфонатными антибиотиками. У штаммов бактерий, устойчивых к фосфомицину, часто наблюдаются мутации, которые инактивируют эти транспортеры; однако такие мутации не поддерживаются в отсутствие антибиотика из-за затрат на приспособленность, которые они налагают.
В 1998 году потребление фосфонатов в мире составило 56 000 тонн – 40 000 тонн в США, 15 000 тонн в Европе и менее 800 тонн в Японии. Спрос на фосфонаты стабильно растет на 3% в год.
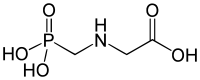
Начиная с работы Герольда Шварценбаха в 1949 году, фосфоновые кислоты известны как эффективные хелатирующие агенты . Введение аминогруппы в молекулу для получения −NH 2 −C−PO(OH) 2 увеличивает способность фосфоната связывать металлы. Примерами таких соединений являются NTMP, EDTMP и DTPMP. Эти фосфонаты являются структурными аналогами хорошо известного аминополикарбоксилата, такого как EDTA . Стабильность комплексов металлов увеличивается с увеличением числа групп фосфоновой кислоты. Фосфонаты хорошо растворимы в воде, тогда как фосфоновые кислоты — лишь в небольшой степени.
Фосфонаты являются эффективными хелатирующими агентами. То есть они прочно связываются с двух- и трехвалентными ионами металлов, что полезно при смягчении воды . Таким образом, они предотвращают образование нерастворимых осадков (накипи). Связывание этих лигандов также подавляет каталитические свойства ионов металлов. Они стабильны в суровых условиях. По этим причинам важное промышленное применение фосфонатов заключается в охлаждении воды, системах опреснения и на нефтяных месторождениях для ингибирования образования накипи. Фосфонаты также регулярно используются в системах обратного осмоса в качестве антискалантов. Фосфонаты в системах охлаждающей воды также служат для контроля коррозии железа и стали. В целлюлозно-бумажной и текстильной промышленности они служат в качестве «стабилизаторов пероксидного отбеливателя», хелатируя металлы, которые могут инактивировать пероксид. В моющих средствах они используются как комбинация хелатирующего агента, ингибитора накипи и стабилизатора отбеливателя. Фосфонаты также все чаще используются в медицине для лечения расстройств, связанных с формированием костей и метаболизмом кальция. Кроме того, они служат носителями радионуклидов при лечении рака костей (см. самарий-153-этилендиаминтетраметиленфосфонат ).
Фосфонаты также используются в качестве замедлителя схватывания бетона. [7] [8] Они задерживают время схватывания цемента, что позволяет дольше укладывать бетон или распределять тепло гидратации цемента на более длительный период времени, чтобы избежать слишком высокой температуры и возникающих трещин. Они также обладают благоприятными диспергирующими свойствами и поэтому исследуются как возможный новый класс суперпластификаторов. Однако в настоящее время фосфонаты не являются коммерчески доступными в качестве суперпластификаторов. Суперпластификаторы — это добавки к бетону, предназначенные для повышения текучести бетона и удобоукладываемости бетона или для снижения его водоцементного (В/Ц) отношения. Уменьшая содержание воды в бетоне, он уменьшает его пористость, улучшая тем самым механические свойства (прочность на сжатие и растяжение) и долговечность бетона (более низкие свойства транспортировки воды, газа и растворенных веществ). [9]
В медицине фосфонаты и бисфосфонаты обычно используются в качестве ингибиторов ферментов, которые используют фосфаты и дифосфаты в качестве субстратов. В частности, эти ферменты включают те, которые производят промежуточные продукты биосинтеза холестерина. [10]
Аналоги фосфонатных нуклеотидов, такие как тенофовир , цидофовир и адефовир, являются важнейшими противовирусными препаратами, которые в различных пролекарственных формах используются для лечения ВИЧ , гепатита В и других заболеваний.
В сочетании с органосиликатами фосфонаты также используются для лечения «внезапной гибели дуба», которую вызывает грибоподобный эукариот Phytophthora ramorum .
Токсичность фосфонатов для организмов, живущих в воде, низкая. Сообщаемые значения 48-часовой LC 50 для рыб находятся в диапазоне от 0,1 до 1,1 мМ. Также фактор биоконцентрации для рыб очень низок.
В природе бактерии играют важную роль в деградации фосфонатов. [11] Из-за присутствия природных фосфонатов в окружающей среде бактерии развили способность метаболизировать фосфонаты как источники питательных веществ. Некоторые бактерии используют фосфонаты в качестве источника фосфора для роста. Аминофосфонаты также могут использоваться некоторыми бактериями в качестве единственного источника азота. Полифосфонаты, используемые в промышленности, сильно отличаются от природных фосфонатов, таких как 2-аминоэтилфосфоновая кислота, поскольку они намного больше, несут высокий отрицательный заряд и образуют комплексы с металлами. Тесты на биодеградацию с илом из муниципальных очистных сооружений с HEDP и NTMP не показали никаких признаков деградации. Исследование HEDP, NTMP, EDTMP и DTPMP в стандартных тестах на биодеградацию также не выявило никакой биодеградации. Однако было отмечено, что в некоторых тестах из-за высокого соотношения ила к фосфонату наблюдалось удаление тестируемого вещества из раствора, наблюдаемое как потеря DOC. Этот фактор был отнесен к адсорбции, а не к биодеградации. Однако штаммы бактерий, способные разлагать аминополифосфонаты и HEDP в условиях ограниченного содержания фосфора, были выделены из почв, озер, сточных вод, активного ила и компоста.
«Биодеградация фосфонатов во время очистки воды не наблюдается, но фотодеградация комплексов Fe(III) происходит быстро. Аминополифосфонаты также быстро окисляются в присутствии Mn(II) и кислорода, и образуются стабильные продукты распада, которые были обнаружены в сточных водах. Отсутствие информации о фосфонатах в окружающей среде связано с аналитическими проблемами их определения в следовых концентрациях в природных водах. Фосфонаты присутствуют в основном в виде комплексов Ca и Mg в природных водах и, следовательно, не влияют на видообразование или транспорт металлов». [12] Фосфонаты сильно взаимодействуют с некоторыми поверхностями, что приводит к значительному удалению в технических и природных системах.