

В органической химии алкильная группа — это алкан, в котором отсутствует один атом водорода . [1] Термин алкил намеренно неспецифичен, чтобы включить множество возможных замен. Ациклический алкил имеет общую формулу −C n H 2 n +1 . Циклоалкильная группа получается из циклоалкана путем удаления атома водорода из кольца и имеет общую формулу −C n H 2 n −1 . [2] Обычно алкил является частью более крупной молекулы. В структурных формулах символ R используется для обозначения общей (неопределенной) алкильной группы. Наименьшая алкильная группа — метил с формулой −CH 3 . [3]
Алкилирование — это присоединение алкильных групп к молекулам, часто с помощью алкилирующих агентов, таких как алкилгалогениды .
Алкилирующие противоопухолевые средства — это класс соединений, которые используются для лечения рака. В этом случае термин алкил используется в широком смысле. Например, азотистые иприты — это хорошо известные алкилирующие средства, но они не являются простыми углеводородами.
В химии алкил — это группа, заместитель, который присоединяется к другим молекулярным фрагментам. Например, алкиллитиевые реагенты имеют эмпирическую формулу Li(алкил), где алкил = метил, этил и т. д. Диалкиловый эфир — это эфир с двумя алкильными группами, например, диэтиловый эфир O(CH 2 CH 3 ) 2 .
В медицинской химии включение алкильных цепей в некоторые химические соединения увеличивает их липофильность . Эта стратегия использовалась для увеличения антимикробной активности флаванонов и халконов . [4]
Обычно алкильные группы присоединяются к другим атомам или группам атомов. Свободные алкилы встречаются в виде нейтральных радикалов, анионов или катионов. Катионы называются карбокатионами . Анионы называются карбанионами . Нейтральные алкильные свободные радикалы не имеют специального названия. Такие виды обычно встречаются только как временные промежуточные продукты. Однако были получены стойкие алкильные радикалы с периодами полураспада «от секунд до лет». [5] Обычно алкильные катионы образуются с использованием суперкислот , а алкильные анионы наблюдаются в присутствии сильных оснований. Алкильные радикалы могут образовываться в результате фотохимической реакции или гомолитического расщепления . [6] Алкилы обычно наблюдаются в масс-спектрометрии органических соединений . Простые алкилы (особенно метил ) также наблюдаются в межзвездном пространстве .
Алкильные группы образуют гомологические ряды . Простейшие ряды имеют общую формулу −C n H 2 n +1 . Алкилы включают метил ( −CH 3 ), этил ( −C 2 H 5 ), пропил ( −C 3 H 7 ), бутил ( −C 4 H 9 ), пентил ( −C 5 H 11 ) и так далее. Алкильные группы, которые содержат одно кольцо, имеют формулу −C n H 2 n −1 , например, циклопропил и циклогексил. Формула алкильных радикалов такая же, как и у алкильных групп, за исключением того, что свободная валентность « − » заменяется точкой «•» и к названию алкильной группы добавляется «радикал» (например, метильный радикал •CH 3 ).
Соглашение о наименовании взято из номенклатуры ИЮПАК :
Префиксы, взятые из номенклатуры ИЮПАК, используются для обозначения разветвленных цепных структур по их замещающим группам, например, 3-метилпентан :

Структура 3-метилпентана рассматривается как состоящая из двух частей. Во-первых, пять атомов составляют самую длинную прямую цепь углеродных центров. Исходное пятиуглеродное соединение называется пентаном (выделено синим). Метильный «заместитель» или «группа» выделена красным. Согласно обычным правилам номенклатуры, алкильные группы включаются в название молекулы перед корнем, как в метилпентане . Это название, однако, неоднозначно, так как метильная ветвь может находиться на разных атомах углерода. Таким образом, чтобы избежать неоднозначности, название 3-метилпентан: 3- связано с тем, что метил присоединен к третьему из пяти атомов углерода.
Если к цепи присоединено более одной одинаковой алкильной группы, то для обозначения кратных алкильных групп используются префиксы (например, ди, три, тетра и т. д.).
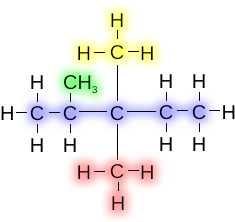
Это соединение известно как 2,3,3-триметилпентан . Здесь три идентичные алкильные группы присоединены к атомам углерода 2, 3 и 3. Цифры включены в название, чтобы избежать двусмысленности относительно положения групп, а «три» указывает на то, что есть три идентичные метильные группы. Если бы одна из метильных групп, присоединенных к третьему атому углерода, была бы этильной группой, то название было бы 3-этил-2,3-диметилпентан. Когда есть разные алкильные группы, они перечислены в алфавитном порядке.
Кроме того, каждое положение в алкильной цепи может быть описано в соответствии с тем, сколько других атомов углерода присоединено к нему. Термины первичный , вторичный , третичный и четвертичный относятся к углероду, присоединенному к одному, двум, трем или четырем другим углеродам соответственно.
Первым названным алкильным радикалом был этил, названный так Либихом в 1833 году от немецкого слова «Äther» (которое, в свою очередь, произошло от греческого слова « aither », означающего «воздух», для вещества, теперь известного как диэтиловый эфир ) и греческого слова ύλη ( hyle ), означающего «материя». [7] За ним последовали метил ( Дюма и Пелиго в 1834 году, означающий «дух древесины» [8] ) и амил ( Огюст Каур в 1840 году [9] ). Слово алкил было введено Иоганнесом Вислиценусом в 1882 году или ранее на основе немецкого слова «Alkoholradikale» и распространенного в то время суффикса -yl. [10] [11]
Этильные радикалы (названы Либихом в 1833 году от греческого и немецкого слова «эфир» плюс греческое «гиле»
... назван по греческим корням Дюма и Пелиго в 1834 году: метил = methy + hyle («дух» + «дерево»).
Амильные радикалы («амилен» был придуман Огюстом Кауром в 1840 году для обозначения вещества из картофельного крахмала после ферментации и перегонки.
«Алкил» был придуман без лишнего шума Иоганнесом Вислиценусом, профессором Вюрцбурга; раннее использование (возможно, не первое) содержится в его статье 1882 года [22, 244]. Слово произошло от первых трех букв «Alkoholradicale» в сочетании с суффиксом -ил; оно было (и остается) общим термином для любого из тех радикалов, которые носят «первые имена» метил, этил, пропил, бутил, амил и т. д.