Реакция гидроборирования-окисления представляет собой двухступенчатую реакцию гидратации , которая превращает алкен в спирт . [1] Процесс приводит к син-присоединению водорода и гидроксильной группы там, где была двойная связь . Гидроборирование-окисление представляет собой антимарковниковскую реакцию, в которой гидроксильная группа присоединяется к менее замещенному углероду. Таким образом, реакция обеспечивает более стереоспецифическую и дополнительную региохимическую альтернативу другим реакциям гидратации, таким как кислотно-катализируемое присоединение и процесс оксимеркурирования-восстановления . Реакция была впервые описана Гербертом С. Брауном в конце 1950-х годов [2] , и она была отмечена получением им Нобелевской премии по химии в 1979 году.
Общая форма реакции выглядит следующим образом:

Тетрагидрофуран (ТГФ) является типичным растворителем, используемым для гидроборирования.
На первом этапе боран (BH 3 ) присоединяется к двойной связи , перенося один из атомов водорода на углерод, соседний с тем, который становится связанным с бором . Это гидроборирование повторяется еще два раза, последовательно реагируя с каждой связью B–H, так что три алкена присоединяются к каждому BH 3 . Полученный триалкилборан обрабатывают перекисью водорода на втором этапе. Этот процесс заменяет связи BC на связи HO-C. Борный реагент превращается в борную кислоту . Реакция была первоначально описана HC Brown в 1957 году для превращения 1-гексена в 1-гексанол . [3]

Зная, что группа, содержащая бор, будет заменена гидроксильной группой, можно увидеть, что начальный этап гидроборирования определяет региоселективность. Гидроборирование протекает антимарковниковским образом . Последовательность реакции также стереоспецифична , давая син-присоединение (на одной и той же стороне алкена): гидроборирование является син-селективным, а окисление заменяет бор на гидроксил, имеющий то же геометрическое положение. Таким образом, 1-метилциклопентен реагирует с дибораном преимущественно с образованием транс -1-гидрокси-2-метилциклопентана [4] — вновь добавленные H и OH находятся в цис- положении друг к другу.
Пока все водороды, присоединенные к бору, не будут перемещены, группа бора BH 2 будет продолжать присоединяться к большему количеству алкенов. Это означает, что один моль гидроборана будет подвергаться реакции с тремя молями алкена. Более того, для гидроборана не обязательно иметь более одного водорода. Например, обычно используются реагенты типа R 2 BH, где R может представлять собой остаток молекулы. Такие модифицированные реагенты гидроборирования включают 9-BBN , катехолборан и дисиамилборан .
На втором этапе последовательности реакций нуклеофильный гидропероксидный анион атакует атом бора. Миграция алкила к кислороду дает алкилборан с сохранением стереохимии (в действительности реакция происходит через триалкилборат B (OR) 3 , а не моноалкилбориновый эфир BH2OR ) .

Атом «H» в реакции поступает из B2H6 , атом «O» поступает из перекиси водорода (H2O2 ) , тогда как присоединенный к O атом «H» поступает из растворителя (см. механизм).
Реакция гидроборирования также происходит на алкинах . Опять же, способ действия — син , а вторичные продукты реакции — альдегиды из терминальных алкинов и кетоны из внутренних алкинов. Чтобы предотвратить гидроборирование по обеим пи-связям, используется объемный боран, такой как дисиамил (ди-сек-изо-амил) боран . [5]
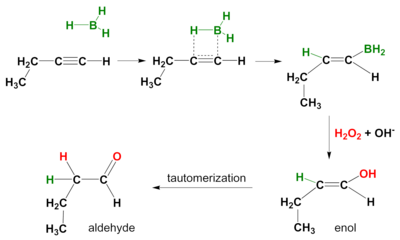
Использование других окислителей вместо перекиси водорода может привести к карбонильным продуктам, а не спиртам из алкенов. N -метилморфолин N -оксид с каталитическим тетрапропиламмонийперрутенатом превращает алкилборан в карбонил, таким образом, в кетон или альдегидный продукт в зависимости от того, какие другие группы были присоединены к этому углероду в исходном алкене. [6] Различные дихроматы или родственные реагенты хрома (VI) также дают кетоны, но вместо альдегидов для терминальных алкенов дают карбоновые кислоты . [7]
Помимо боранов, окисление силанов и дисиланов также может давать гидроксильные группы . Главное отличие состоит в том, что в то время как силильные группы, такие как фенилдиметилсилильная группа, преобразуются в гидроксильную группу после кислотной или другой электрофильной обработки с последующим окислением перекисью водорода, дисиланильные группы преобразуются после обработки TBAF с последующим окислением перекисью. Это позволяет проводить селективное окисление любой группы. [8]