1,2,4,5-тетрабромбензол — арилбромид и четырехзамещенный бромбензол с формулой C 6 H 2 Br 4 . Это один из трех изомеров тетрабромбензола. Соединение представляет собой белое твердое вещество. 1,2,4,5-тетрабромбензол — важный метаболит антипирена гексабромбензола . [ 1 ]
Синтез 1,2,4,5-тетрабромбензола уже был описан в 1865 году из бензола и избытка брома в запаянной трубке при 150 °C. [2] Однако, явно пониженная температура плавления около 160 °C указывает на примеси в конечном продукте. В своей диссертации 1885 года Адольф Шойфелен опубликовал синтез более чистого образца с использованием хлорида железа (III) FeCl 3 в качестве катализатора , выделенного в виде «красивых игл» («schönen Nadeln»). [3]
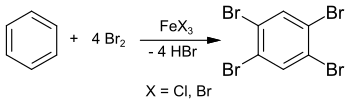
Синтез также может быть осуществлен в растворе хлороформа или тетрахлорметана и дает 1,2,4,5-тетрабромбензол с выходом 89%. [4] Эту реакцию также можно осуществить в лабораторном эксперименте с избытком брома и железными гвоздями (в качестве исходного материала для бромида железа (III) FeBr 3 ). [5] Промежуточной стадией является 1,4-дибромбензол , который далее реагирует с избытком брома, давая 1,2,4,5-тетрабромбензол.
Благодаря своей симметричной структуре и реакционной способности 1,2,4,5-тетрабромбензол является предшественником нематических жидких кристаллов [6] со скрещенными мезогенами и столбчатых (дискотических) жидких кристаллов [7] [8] с обширным плоским, «доскообразным» тетрабензоантраценовым ядром.

В однореакторной реакции 1,2,4,5-тетрабромбензол реагирует с 4-гидроксибензальдегидом , алкилирующим агентом 1-бромпентаном, реагентом Виттига метилтрифенилфосфонийиодидом, основным карбонатом калия , катализатором межфазного переноса тетрабутиламмонийбромидом , реагентом Хека палладий(II)ацетатом и сокатализатором Хека 1,3-бис(дифенилфосфино)пропаном (dppp) в диметилацетамиде , в результате чего получается непосредственно симметричный тетраалкоксилстильбен в виде E-изомера с выходом 17%. [9]
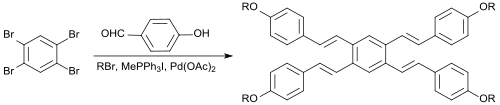
Благодаря выраженному π-сопряжению такие соединения потенциально могут применяться в качестве оптических отбеливателей , OLED-материалов или жидких кристаллов.
N -алкилтетрааминобензолы получаются из 1,2,4,5-тетрабромбензола с высокими выходами, которые могут быть циклизованы с триэтилортоформиатом и кислотами в соли бензобис(имидазолия) (соли BBI) и окислены кислородом с образованием 1,4-бензохинондииминов. [10]
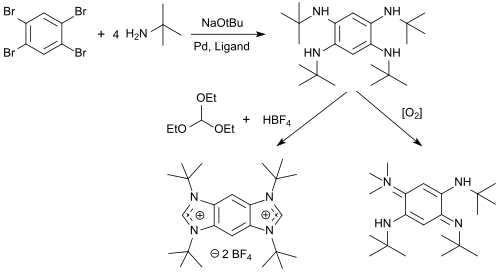
Соли BBI являются универсальными флуоресцентными красителями с длиной волны излучения λ em от 329 до 561 нм, выраженной сольватохромией и сильным зависящим от растворителя сдвигом Стокса , которые могут использоваться в качестве белковой метки для флуоресцентной маркировки белков. [11]
Из 1,2,4,5-тетрабромбензола можно получить 1,4-моноарин in situ с одним эквивалентом н- бутиллития путем отщепления брома, который немедленно реагирует с фураном с образованием 6,7-дибром-1,4-эпокси-1,4-дигидронафталина (6,7-дибромнафталин-1,4-эндоксида) с выходом 70%. [12]

При использовании 2,5-диалкилфуранов (например, 2,5-(ди-н-октил)фурана) дибромированный моноэндоксид образуется с выходом 64%, из которого дибром-5,8-ди-н-октилнафталин образуется с цинковым порошком/ тетрахлоридом титана с выходом 88%. [13]

При обработке тетрахлоридом титана и цинковой пылью эндооксид дезоксигенируется, давая 2,3-дибромнафталин. [14]
Эндоксид реагирует с 3-сульфоленом в реакции Дильса-Альдера при удалении диоксида серы . Полученный трициклический аддукт превращается в 2,3-дибромантрацен с хорошим выходом. [15]
Если диброменоксиду позволяют далее реагировать с фураном, в присутствии н -бутиллития [12] или амида калия [16] или через промежуточный 1,4-арин, трициклический 1,4-аддукт 1,4:5,8-диэпокси-1,4,5,8-тетрагидроантрацен [17] образуется с выходом 71% в виде син-анти-смеси . Однако с амидом натрия в диметиловом эфире этиленгликоля (ДМЭ) диброменоксид ведет себя как эквивалент 1,3-арина и образует с фураном фенантреноподобный трициклический 1,3-аддукт, который может реагировать с фураном и амидом натрия до производного трифенилена (1,3,5-трисарена). [16]
[2+4] циклоприсоединения с 1,2,4,5-тетрабромбензолом иногда протекают с очень высокими выходами, например, реакция дигалогензамещенного 1,3-дифенилизобензофурана с образованием тетрагалогенированного производного антрацена (98%), которое далее последовательно преобразуется с 1,3-дифенилизобензофураном с выходом 65% в производное пентацена и фураном в производное гексацена (67%). [18]

Сшивание полимеров , модифицированных бензимидазолом, обеспечивает получение материалов с высокой поглощающей способностью по отношению к диоксиду углерода , что может быть пригодно для отделения CO2 от газовых смесей. [19]

Это исходный материал для моно- и бис-ариинов. [12]
1,2,4,5-тетрабромбензол является токсичным для печени продуктом распада антипирена гексабромбензола и был обнаружен в Японии в образцах материнского молока еще в 1987 году. [20]