
В органической химии термин 2-норборнил катион (или 2-бицикло[2.2.1]гептил катион ) описывает карбоний-ионное производное норборнана . Соль 2-норборнил катиона была кристаллизована и охарактеризована рентгеновской кристаллографией, подтвердившей неклассическую структуру. [1]

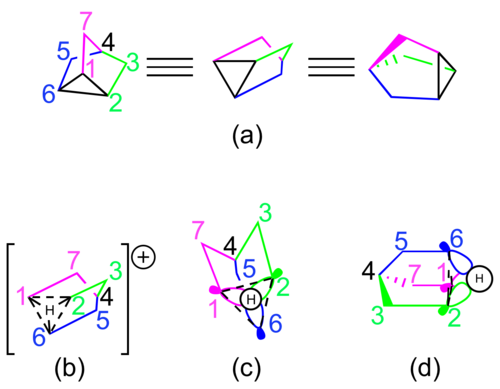
Сторонники неклассической природы стабильного 2-норборнильного катиона обычно изображают виды с использованием либо резонансных структур , либо одиночной структуры с частичными связями ( см. Рисунок 2 ). Это гиповалентное взаимодействие можно представить как чистый эффект i) частичной сигма-связи между атомами углерода 1 и 6, ii) частичной сигма-связи между атомами углерода 2 и 6 и iii) частичной пи-связи между атомами углерода 1 и 2. [2] Каждая частичная связь представлена как полная связь в одной из трех резонансных структур или как пунктирная частичная связь, если катион изображен с помощью одной структуры.

Были некоторые дебаты о том, насколько резонансная структура с пи-связями фактически вносит вклад в делокализованную электронную структуру. [4] С помощью спектроскопии ЯМР 1 H и 13 C было подтверждено, что значительный положительный заряд лежит на метиленовом углероде 6. [5] Это удивительно, поскольку первичные карбокатионы гораздо менее стабильны, чем вторичные карбокатионы. Однако катион 2-норборнила может быть образован из производных β-(Δ 3 -циклопентенил)-этана, что указывает на то, что резонансная структура с пи-связями имеет значение. [6]
Катион 2-норборнила был одним из первых примеров неклассического иона . Неклассические ионы можно определить как органические катионы, в которых электронная плотность заполненной связывающей орбитали распределена между тремя или более центрами и содержит некоторый характер сигма-связи. [7] Катион 2-норборнила рассматривается как прототип неклассических ионов. Другие простые катионы, такие как протонированный ацетилен (этиний, C
2ЧАС+
3), протонированный этилен (этений, C
2ЧАС+
5) и протонированный этан (этан, C
2ЧАС+
7) лучше всего описываются как неклассические с помощью инфракрасной спектроскопии. [8]
Наиболее часто предлагаемое изображение молекулярной орбитали 2-норборнил-катиона показано на рисунке 3. Две орбитали p- типа, по одной на каждом из атомов углерода 1 и 2, взаимодействуют с sp 3 -гибридизованной орбиталью на углероде 6, образуя гиповалентную связь. [3] [9] Расширенные расчеты теории Хюккеля для 2-норборнил-катиона предполагают, что орбиталь на углероде 6 вместо этого может быть sp 2 -гибридизованной, хотя это влияет только на геометрию геминальных водородов. [10]

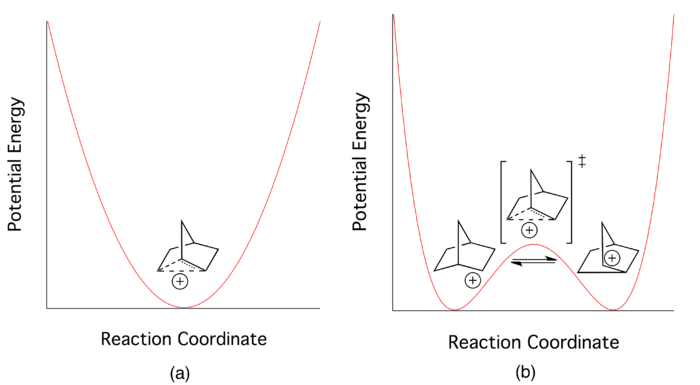
Согласно сторонникам классического потенциала двойной ямы, катион 2-норборнила существует в динамическом равновесии между двумя энантиомерными асимметричными структурами. Делокализованный вид, центральный для неклассической картины, является просто переходным состоянием между двумя структурами. Перегруппировки Вагнера-Меервейна используются как механизм, который преобразует между двумя энантиомерами ( см. Рисунок 4 ).
Попытки выделить асимметричные виды спектроскопически обычно безуспешны. Сообщается, что основной причиной этой неудачи являются чрезвычайно быстрые скорости прямой и обратной реакции , что указывает на очень низкий потенциальный барьер для взаимопревращения между двумя энантиомерами. [2]
Некоторые химики также считали, что 2-норборнил-катион лучше всего представлен ионом нортрициклония, C 3 -симметричным протонированным нортрицикленом. Это изображение было впервые использовано для частичного объяснения результатов эксперимента по скремблированию изотопов 14 C. [11] Молекулярное орбитальное представление этой структуры включает в себя синфазное взаимодействие между sp 2 -гибридизованными орбиталями от углеродов 1, 2 и 6 и 1s атомной орбиталью на общем атоме водорода ( см. Рисунок 5 ). [12]
Неклассические ионы отличаются от традиционных катионов своей электронной структурой : хотя химические связи обычно изображаются как совместное использование электронов двумя атомами, стабильные неклассические ионы могут содержать три или более атомов, которые совместно используют одну пару электронов. [7] В 1939 году Томас Невелл и другие попытались выяснить механизм преобразования гидрохлорида камфена в изоборнилхлорид . В одном из предложенных механизмов реакции, описанных в статье, положительный заряд промежуточного катиона был приписан не одному атому, а скорее структуре в целом. [13] Позднее это цитировалось противниками неклассического описания как первый случай, когда был использован неклассический ион. [14] Однако термин «неклассический ион» явно не появлялся в химической литературе до тех пор, пока более десяти лет спустя он не был использован для обозначения делокализованной связи в пирамидальном бутильном катионе. [15]
Термин синартетический ион также использовался для описания делокализованной связи в стабильных карбокатионах до того, как термин неклассический ион стал широко использоваться. Первые пользователи этого термина отметили поразительное сходство между связью в этих типах катионов и связью в борогидридах . [16]
В 1949 году Сол Винстейн наблюдал, что 2- экзо -норборнилброзилат ( п- бромбензолсульфонат) и 2- эндо - норборнилтозилат ( п- толуолсульфонат) давали рацемическую смесь одного и того же продукта, 2- экзо -норборнилацетата , при ацетолизе ( см. Рисунок 6 ). Поскольку тозилаты и брозилаты работают одинаково хорошо как уходящие группы , он пришел к выводу, что как 2- эндо , так и 2- экзо- замещенный норборнан должны проходить через общее катионное промежуточное соединение с доминирующей экзореакционной способностью. Он сообщил, что это промежуточное соединение, скорее всего, было симметричным, делокализованным 2-норборнилкатионом. [17] Позднее с помощью парофазной хроматографии было показано, что количество эндоэпимера полученного продукта было менее 0,02%, что доказывает высокую стереоселективность реакции. [18]


Когда один энантиомер 2 -экзо -норборнилброзилата подвергается ацетолизу, в полученном 2 -экзо -норборнилацетате не наблюдается оптической активности ( см. Рисунок 7 ). [17] Согласно неклассическому описанию 2-норборнилкатиона, присутствующая плоскость симметрии (проходящая через атомы углерода 4, 5 и 6) обеспечивает равный доступ к обоим энантиомерам продукта, что приводит к наблюдаемой рацемической смеси .
Также было отмечено, что 2- экзо -замещенные норборнаны реагировали в 350 раз быстрее, чем соответствующие эндо- изомеры. Анхимерная помощь сигма-связи между углеродами 1 и 6 была рационализирована как объяснение этого кинетического эффекта. [17] Важно, что вызванная анхимерная помощь привела многих химиков к постулированию того, что энергетическая стабильность 2-норборнильного катиона была напрямую обусловлена симметричной мостиковой структурой, вызванной в неклассическом объяснении. Однако некоторые другие авторы предложили альтернативные объяснения высокой стабильности без привлечения неклассической структуры. [19]
В 1951 году впервые было высказано предположение, что 2-норборнил-катион на самом деле можно было бы лучше описать, если рассматривать его как ион нортрициклония. [11] Было показано, что основным продуктом, образующимся в результате реакции элиминирования 2-норборнил-катиона, является нортрициклен (а не норборнен), но это, как утверждается, подтверждает оба постулата неклассических ионов. [18]
Герберт К. Браун предположил, что не нужно привлекать новый тип связи в стабильных промежуточных соединениях для объяснения реакционной способности 2-норборнил-катиона. Критикуя многих химиков за игнорирование прошлых объяснений реакционной способности, Браун утверждал, что вся вышеупомянутая информация о 2-норборнил-катионе может быть объяснена с использованием простых стерических эффектов , присутствующих в норборнил-системе. [2] Учитывая, что альтернативное объяснение с использованием быстро уравновешивающейся пары ионов для описания 2-норборнил-катиона было действительным, он не видел необходимости привлекать стабильное, неклассическое изображение связи. [20] Обращение к стабильным неклассическим ионам становилось обычным явлением; Браун считал, что это не только необоснованно, но и контрпродуктивно для области химии в целом. Действительно, многие статьи, сообщающие о стабильных неклассических ионах, были позже отозваны как нереалистичные или неверные. [21] После публикации этой противоречивой точки зрения в 1962 году Браун начал поиск экспериментальных доказательств, несовместимых с делокализованной картиной связывания в 2-норборниловом катионе. [22]
Браун также работал над доказательством нестабильности делокализованной электронной структуры для 2-норборнил-катиона. Если бы можно было доказать, что неклассический ион имеет более высокую энергию, чем соответствующая классическая пара ионов, неклассический ион рассматривался бы только как переходное состояние между двумя асимметричными катионами. [21] [23] Хотя он не исключал возможности делокализованного переходного состояния, Браун продолжал отвергать предложенную отражательную симметрию 2-норборнил-катиона, даже в конце своей карьеры. [24]
Введение трехцентровой двухэлектронной делокализованной связи, вызванной в неклассической картине 2-норборнил-катиона, позволило химикам исследовать совершенно новую область химических связей. Химики стремились применить характеристики гиповалентных электронных состояний к новым и старым системам в равной степени (хотя некоторые слишком увлеклись). [4] Одной из наиболее фундаментально важных концепций, возникших в результате интенсивных исследований, сосредоточенных вокруг неклассических ионов, была идея о том, что электроны, уже вовлеченные в сигма-связи, могут быть вовлечены в реакционную способность. Хотя было известно, что заполненные π-орбитали являются донорами электронов , химики сомневались, что σ-орбитали могут функционировать в том же качестве. Неклассическое описание 2-норборнил-катиона можно рассматривать как донорство электронной пары из углерод-углеродной сигма-связи в пустую p-орбиталь углерода 2. Таким образом, этот карбокатион показал, что донорство электронов сигма-связи столь же правдоподобно, как и донорство электронов пи-связи. [25] [26]
Интенсивные дебаты, последовавшие за вызовом Брауна сторонникам неклассических ионов, также оказали большое влияние на область химии. Чтобы доказать или опровергнуть неклассическую природу 2-норборнил-катиона, химики по обе стороны дебатов усердно искали новые методы химической характеристики и более инновационные интерпретации существующих данных. [27] Одним из спектроскопических методов, который был дополнительно разработан для исследования 2-норборнил-катиона, была спектроскопия ядерного магнитного резонанса соединений в сильнокислых средах. [19] Сравнения 2-норборнил-катиона с нестабильными переходными состояниями с делокализованными электронными состояниями часто проводились при попытках выяснить, является ли норборнильная система стабильной или нет. Эти усилия мотивировали более тщательные исследования переходных состояний и значительно расширили понимание научным сообществом их электронной структуры. [27] Короче говоря, энергичная конкуренция между научными группами привела к обширным исследованиям и лучшему пониманию основных химических концепций.
Катион 2-норборнил может быть получен множеством синтетических путей. Эти пути можно сгруппировать в три класса: σ-образование , π-образование и образование путем перегруппировки . Каждый из них обсуждается отдельно ниже.

Исходным материалом для этого пути является производное норборнана с хорошей уходящей группой в положении 2. Если уходящая группа находится на экзо -грани, электронная плотность от σ-связи между атомами углерода 1 и 6 передается в σ* -антисвязь между углеродом 2 и уходящей группой ( см. рисунок 8b ). [28]
Если уходящая группа находится на эндо -грани, уходящая группа сначала уходит сама по себе. Затем электронная плотность от σ-связи между углеродами 1 и 6 передается в образовавшуюся пустую атомную орбиталь на углероде 2. Однако этот путь образования намного медленнее, чем у экзо -изомера, поскольку σ-связь не может обеспечить анхимерную помощь для первого шага, что делает энергию активации для первого переходного состояния намного выше. Кроме того, если в реакционной смеси высокая концентрация реактивных электрофилов, образование нового замещенного производного норборнана может исключить неклассическое образование ионов. [17] [29]
Примером этого пути образования является реакция, которая привела Винстейна и Трифана к предложению делокализованной структуры 2-норборнил-катиона. 2-норборнил-тозилаты и брозилаты образуют 2-норборнил-катион по этому пути в качестве промежуточного продукта сольволиза . [17]
Исходным материалом для этого маршрута является производное β-(Δ 3 -циклопентенил)-этана с хорошей уходящей группой на терминальном углероде этановой группы. Электронная плотность от π-связи алкеновой части передается в σ*-антисвязь между терминальным углеродом и уходящей группой ( см. Рисунок 8c ). [28] [29]
Например, основным продуктом ацетолиза β-(Δ 3 -циклопентенил)-этил нозилата ( п -нитробензолсульфоната) является 2- экзо -норборнилацетат. Недостаток β-(Δ 3 -циклопентенил)-этилацетата, присутствующего после реакции, объясняется большей стабильностью норборнильной системы по сравнению с декорированной циклопентенильной системой. [6]
Этот путь эффективен только в том случае, если циклопентенилолефин изолирован от любой более крупной π-связанной системы. Скорость реакции значительно снижается, если вовлеченная двойная связь образует шестичленное ароматическое кольцо, как это происходит в 2-инданилэтилнозилате. Было замечено, что алкильные замены в олефинах увеличивают скорость реакции за счет стабилизации полученного карбокатиона. [30]
Катион 2-норборнила также может быть образован путем перегруппировки подобных ионов, таких как катионы 1-норборнила и 7-норборнила, хотя они, как правило, не так хорошо изучены. Эксперименты по маркировке радиоактивным изотопом углерода-14 показали, что сложная перестановка в системах катионов норборнила позволяет 14 C присутствовать во всех семи положениях системы норборнила. [11] При циклическом изменении между низкими и высокими температурами во время гидролиза 1- и 7-хлорнорборнанов было обнаружено большое количество 2-норборнанола в дополнение к ожидаемым 1- и 7-норборнанолам соответственно. Таким образом, катионы 1- и 7-норборнила имеют некоторый механизм, с помощью которого они могут перегруппироваться в более стабильный катион 2-норборнила на временной шкале реакций сольволиза. [31]
Один из способов проверки того, является ли катион 2-норборнила неклассическим, заключается в исследовании присущей катиону симметрии. Многие спектроскопические инструменты, такие как спектроскопия ядерного магнитного резонанса (спектроскопия ЯМР) и спектроскопия Рамана , дают подсказки об отражательной и вращательной симметрии, присутствующей в молекуле или ионе. Каждая из трех предложенных структур катиона 2-норборнила иллюстрирует отчетливую молекулярную симметрию. Неклассическая форма содержит плоскость отражения через атомы углерода 4, 5, 6 и среднюю точку атомов углерода 1 и 2. Классическая форма не содержит ни отражательной, ни вращательной симметрии. Протонированная структура нортрициклена содержит C 3 -симметричную ось вращения через атом углерода 4.
Каждый пик в спектре ЯМР соответствует набору атомов определенного элемента, которые находятся в схожих химических средах. Спектр ЯМР хлорпентафторидной соли сурьмы 2-норборнилового катиона бесполезен при комнатной температуре, поскольку гидридные сдвиги происходят быстрее, чем временная шкала эксперимента ЯМР; таким образом, большинство водородов рассматриваются как эквивалентные и учитываются в одном и том же пике поглощения. При снижении температуры эксперимента ЯМР до −60 °C гидридные сдвиги «замораживаются», и из спектра можно почерпнуть больше структурной информации. Исследователи обнаружили, что при этих низких температурах спектр 1 H ЯМР соответствовал тому, что можно было бы ожидать для неклассической структуры иона. [31] [32]
Исследования ЯМР 1 H и 13 C смогли подтвердить, что любые предложенные перегруппировки Вагнера-Меервейна происходили быстрее, чем временные рамки эксперимента ЯМР, даже при низких температурах. [33] Для молекул в статическом равновесии относительно перестроек ЯМР показывает, сколько наборов симметрично связанных ядер находится в молекуле и сколько ядер каждый из этих наборов учитывает посредством интеграции спектра. Для молекул в динамическом равновесии, таких как 2-норборнил-катион, ядра внутри каждого набора также могут трансформироваться друг в друга посредством перестроек с быстрыми скоростями реакции. [34] Поскольку предложенное динамическое равновесие сторонников классических ионов имело очень высокие скорости перестройки, первые исследования ЯМР не поддерживали и не опровергали ни одну из трех предложенных структур. [5] Но, используя анализ ЯМР твердого тела , можно понизить температуру эксперимента ЯМР до 5 кельвинов (−268 °C) и, таким образом, значительно замедлить любые явления перестройки. Спектры ЯМР 13 C твердого тела катиона 2-норборнила показывают, что атомы углерода 1 и 2 находятся в одинаковом химическом окружении, что согласуется только с неклассической картиной катиона 2-норборнила. [35]
Рамановские спектры катиона 2-норборнила показывают более симметричные виды, чем можно было бы ожидать для пары быстро уравновешивающихся классических ионов. Поскольку предполагаемые скорости реакции для классических перегруппировок ионов медленнее, чем временная шкала Рамана, можно было бы ожидать, что Рамановские спектры покажут менее симметричные виды, если классическая картина верна. [4]
Некоторые исследования ЯМР 13 C, в частности, благоприятствовали интерпретации через структуру протонированного нортрициклена. [36] Кроме того, спектры Рамана катиона 2-норборнила в некоторых кислых растворителях показывают полосу поглощения при 3110 см -1 , указывающую на обедненное электронами циклопропановое кольцо. Поскольку эта полоса поглощения ожидалась бы в симметричном протонированном нортрициклене C 3 , некоторые ученые утверждали, что это является убедительным доказательством этой интерпретации. [37] Другие химики постулировали, что свойства катиона 2-норборнила очень зависят от среды растворителя. Хотя высокая кислотность и низкая нуклеофильность растворителей, используемых в вышеупомянутых экспериментах, могут привести к тому, что геометрия протонированного нортрицилкония будет наиболее стабильной, эта геометрия не обязательно должна быть наиболее энергетически выгодной в других растворителях. [4]
Было проведено множество расчетов классических и неклассических структур. [38] [10] [39]
Сравнивая перегруппировку между катионом 3-метил-2-норборнила и катионом 2-метил-2-норборнила с перегруппировкой между третичным и вторичным изопентановыми карбокатионами, можно обнаружить, что изменение энтальпии примерно на 6 ккал/моль меньше для норборнильной системы. Поскольку основное различие между этими двумя обратимыми перегруппировками заключается в количестве делокализации, возможной в основном электронном состоянии, можно приписать стабилизацию катиона 3-метил-2-норборнила его неклассической природе. [40] Однако некоторые экспериментальные исследования не смогли наблюдать эту стабилизацию в реакциях сольволиза. [21]
Другие исследования стабильности 2-норборнильного катиона показали, что алкильные замены у углерода 1 или 2 заставляют систему быть определенно классической. Третичные карбокатионы намного более стабильны, чем их вторичные аналоги, и поэтому им не нужно принимать делокализованные связи, чтобы достичь минимально возможной потенциальной энергии. [41] [42]
Чтобы подтвердить свое предположение о неклассической природе 2-норборнильного катиона, Винстейн и Трифан сначала использовали кинетические доказательства повышенной скорости реакции для образования 2- экзо -норборнильного катиона по сравнению с 2 -эндо -норборнильным катионом. [17] Другие исследователи исследовали скорость реакции соединений, которые могли бы обладать анхимерной помощью, но не могли подвергаться перегруппировкам, поскольку норборнильная система могла бы демонстрировать схожие тенденции в повышении скорости. Некоторые утверждали, что это является окончательным доказательством неклассической картины. [43] Но не все согласны. Другие исследователи обнаружили, что производные циклопентана, которые были структурно похожи на норборнильную систему, все еще демонстрировали повышенные скорости реакции, что привело их к утверждению, что классический норборнильный катион описывает систему гораздо лучше. [44] [45]

Эксперименты по маркировке радиоактивными изотопами предоставляют мощный инструмент для определения структуры органических молекул. Систематически разлагая катион 2-норборнила и анализируя количество радиоактивного изотопа в каждом продукте разложения, исследователи смогли продемонстрировать дополнительные доказательства неклассической картины делокализованной связи ( см. Рисунок 9 ). Сторонники неклассической картины ожидали бы, что 50% образующегося CO 2 при разложении на рисунке 9 будет содержать 14 C, в то время как сторонники классической картины ожидали бы, что большая часть образующегося CO 2 будет радиоактивной из-за короткоживущей природы катиона. Было обнаружено, что 40% диоксида углерода, полученного при разложении, являются радиоактивными, что предполагает, что неклассическая картина более верна. [12]
Дальнейшее различие между неклассическими и классическими структурами 2-норборнил-катиона возможно путем объединения экспериментов ЯМР с экспериментами по мечению изотопов. Изотопное замещение одного из двух атомов дейтерия на атом водорода приводит к резкому изменению окружения близлежащих атомов, активных в ЯМР. Асимметричное мечение изотопом дейтерия (замещение) приведет к расщеплению набора атомов углерода, которые были эквивалентны в чисто водородных видах, на два или более наборов эквивалентных атомов углерода в дейтеромеченых видах; это будет проявляться в спектре ЯМР как один пик в спектре чисто водородных видов, становящийся по крайней мере двумя «разделенными» пиками в дейтеромеченых видах. Если система претерпевает быстрое равновесие со скоростью, превышающей временную шкалу эксперимента ЯМР 13 C, соответствующий пик будет расщеплен резко (порядка 10-100 ppm). Если система вместо этого статична, пик будет расщеплен очень мало. [46] [47] Спектр ЯМР 13 C катиона 2-норборнила при -150 °C показывает, что пики, соответствующие углеродам 1 и 2, разделяются менее чем на 10 ppm (частей на миллион) при проведении этого эксперимента, что указывает на то, что система не претерпевает быстрого равновесия, как в классической картине. [48]