Биомаркеры старения — это биомаркеры , которые могут предсказать функциональные возможности в более позднем возрасте лучше, чем хронологический возраст. [1] Другими словами, биомаркеры старения дадут истинный «биологический возраст», который может отличаться от хронологического возраста.
Подтвержденные биомаркеры старения позволят проводить тестирование вмешательств для продления продолжительности жизни , поскольку изменения в биомаркерах будут наблюдаться на протяжении всей жизни организма. [1] Хотя максимальная продолжительность жизни может быть средством проверки биомаркеров старения, это не будет практичным средством для долгоживущих видов, таких как люди, поскольку лонгитюдные исследования займут слишком много времени. [2] В идеале биомаркеры старения должны анализировать биологический процесс старения , а не предрасположенность к болезням, должны вызывать минимальное количество травм для анализа в организме и должны быть воспроизводимо измеримыми в течение короткого интервала по сравнению с продолжительностью жизни организма. [1] Совокупность данных биомаркеров для организма можно назвать его «возрастным типом». [3]
Хотя седина усиливается с возрастом, [4] седину нельзя назвать биомаркером старения. Аналогично, морщины на коже и другие общие изменения, наблюдаемые при старении, не являются лучшими индикаторами будущей функциональности, чем хронологический возраст. Биогеронтологи продолжают попытки найти и подтвердить биомаркеры старения, но успехи пока ограничены. Уровни Т-клеток памяти CD4 и CD8 и наивных Т-клеток использовались для получения хороших прогнозов ожидаемой продолжительности жизни мышей среднего возраста. [5]
Достижения в области анализа больших данных позволили разработать новые типы «часов старения». Эпигенетические часы являются перспективным биомаркером старения и могут точно предсказать хронологический возраст человека. [6] Базовая биохимия крови и количество клеток также могут быть использованы для точного предсказания хронологического возраста. [7] Дальнейшие исследования гематологических часов на больших наборах данных популяций Южной Кореи, Канады и Восточной Европы показали, что биомаркеры старения могут быть специфичными для популяции и предсказывать смертность. [8] Также возможно предсказать хронологический возраст человека с помощью транскриптомных часов. [9]
Новая эпигенетическая метка, обнаруженная в исследованиях стареющих клеток, — это потеря гистонов . Большинство доказательств показывают, что потеря гистонов связана с делением клеток. У стареющих и делящихся дрожжей MNase-seq (секвенирование микрококковой нуклеазы) показало потерю нуклеосом ~50%. Правильная дозировка гистонов важна для дрожжей, как показано на примере увеличенной продолжительности жизни штаммов, которые сверхэкспрессируют гистоны. [10] Следствием потери гистонов у дрожжей является усиление транскрипции . В более молодых клетках гены, которые больше всего индуцируются с возрастом, имеют специфические структуры хроматина, такие как нечеткое позиционирование ядра, отсутствие области истощения нуклеосом (NDR) на промоторе , слабое фазирование хроматина, более высокая частота элементов TATA и более высокая занятость репрессивных хроматиновых факторов. Однако в более старых клетках потеря нуклеосомы тех же генов на промоторе встречается чаще, что приводит к более высокой транскрипции этих генов. [10]
Это явление наблюдается не только у дрожжей, но также у стареющих червей, во время старения первичных диплоидных фибробластов человека и в стареющих клетках человека. В первичных фибробластах человека снижение синтеза новых гистонов, как было замечено, является следствием укороченных теломер , которые активируют ответ на повреждение ДНК. Потеря основных гистонов может быть общим эпигенетическим признаком старения во многих организмах. [11]
В дополнение к основным гистонам, H2A, H2B, H3 и H4, существуют и другие версии гистоновых белков, которые могут значительно отличаться по своей последовательности и важны для регуляции динамики хроматина. Гистон H3.3 является вариантом гистона H3, который включается в геном независимо от репликации. Это основная форма гистона H3, обнаруженная в хроматине стареющих клеток человека, и, по-видимому, избыток H3.3 может управлять старением . [11]
Существует несколько вариантов гистона 2, наиболее заметно участвующий в старении — это macroH2A. Обычно предполагалось, что функция macroH2A заключается в подавлении транскрипции; совсем недавно было высказано предположение, что macroH2A важен для подавления транскрипции в очагах гетерохроматина, связанных со старением (SAHF). [11] Хроматин, содержащий macroH2A, непроницаем для АТФ-зависимых ремоделирующих белков и для связывания факторов транскрипции . [12]
Повышенное ацетилирование гистонов способствует тому, что хроматин принимает более эухроматическое состояние по мере старения организма, аналогично повышенной транскрипции, наблюдаемой из-за потери гистонов. [13] Также наблюдается снижение уровня H3K56ac во время старения и повышение уровня H4K16ac . [10] Повышение уровня H4K16ac в старых клетках дрожжей связано со снижением уровня HDAC Sir2, который может увеличить продолжительность жизни при сверхэкспрессии. [10]
Метилирование гистонов было связано с регуляцией продолжительности жизни у многих организмов, в частности, H3K4me3, активирующей метки, и H4K27me3, репрессирующей метки. У C. elegans потеря любого из трех белков Trithorax, катализирующих триметилирование H3K4, таких как WDR-5 и метилтрансферазы SET-2 и ASH-2, снижает уровень H3K4me3 и увеличивает продолжительность жизни. Потеря фермента, который деметилирует H3K4me3, RB-2, увеличивает уровень H3K4me3 у C. elegans и уменьшает продолжительность их жизни. [13] В префронтальной коре мозга макаки - резус H3K4me2 увеличивается на промоторах и энхансерах во время постнатального развития и старения . [14] Эти увеличения отражают прогрессивно более активные и транскрипционно доступные (или открытые) структуры хроматина , которые часто связаны с реакциями на стресс, такими как реакция на повреждение ДНК . Эти изменения могут формировать эпигенетическую память о стрессах и повреждениях, испытываемых организмом по мере его развития и старения. [14]
UTX-1, деметилаза H3K27me3 , играет важную роль в старении C.elegans : повышенная экспрессия utx-1 коррелирует с уменьшением H3K27me3 и сокращением продолжительности жизни. Снижение уровня Utx-1 показало увеличение продолжительности жизни [13]. Изменения уровней H3K27me3 также влияют на стареющие клетки у дрозофилы и людей.
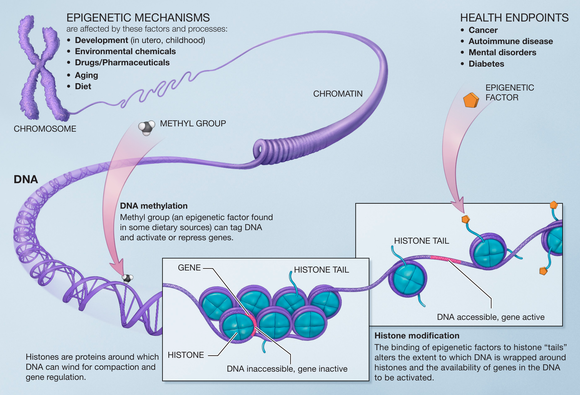
Метилирование ДНК является распространенной модификацией в клетках млекопитающих . Цитозиновое основание метилируется и становится 5-метилцитозином , чаще всего в контексте CpG . Гиперметилирование CpG-островков связано с репрессией транскрипции, а гипометилирование этих участков связано с активацией транскрипции. Многие исследования показали, что происходит потеря метилирования ДНК во время старения у многих видов, таких как крысы, мыши, коровы, хомяки и люди. Также было показано, что DNMT1 и DNMT3a уменьшаются со старением, а DNMT3b увеличивается. [15]
Гипометилирование ДНК может снизить геномную стабильность, вызвать реактивацию мобильных элементов и привести к потере импринтинга , все это может способствовать прогрессированию и патогенезу рака . [15]
Последние данные свидетельствуют о том, что повышенная частота стареющих CD8+ T-клеток в периферической крови связана с развитием гипергликемии из преддиабетического состояния, что предполагает роль старения в метаболическом старении. Стареющие Cd8+ T-клетки могут быть использованы в качестве биомаркера для сигнализации перехода от преддиабета к явной гипергликемии. [16]
Недавно Хашимото и его коллеги профилировали тысячи циркулирующих иммунных клеток у долгожителей с разрешением по одной клетке. Они выявили уникальное увеличение цитотоксических Т-клеток CD4 у этих долгожителей. Как правило, Т-клетки CD4 выполняют вспомогательные, но не цитотоксические функции в физиологических условиях, однако эти долгожители, подвергнутые профилированию по одной клетке их Т-клеточных рецепторов, выявили накопления цитотоксических Т-клеток CD4 посредством клональной экспансии. Превращение вспомогательных Т-клеток CD4 в цитотоксическую разновидность может быть адаптацией к поздней стадии старения, помогающей в борьбе с инфекциями и потенциально усиливающей наблюдение за опухолями. [17]
Основными механизмами, идентифицированными как потенциальные биомаркеры старения, являются метилирование ДНК, потеря гистонов и модификация гистонов. Биомаркеры старения используются повсеместно, и идентификация физического параметра биологического старения позволит людям определить наш истинный возраст, смертность и заболеваемость. [10] Изменение физического биомаркера должно быть пропорционально изменению возраста вида. Таким образом, после установления биомаркера старения люди смогут погрузиться в исследования по продлению продолжительности жизни и определению сроков возникновения потенциальных генетических заболеваний.
Одно из применений этого открытия позволит определить биологический возраст человека. Метилирование ДНК использует структуру ДНК на разных этапах жизни для определения возраста. Метилирование ДНК - это метилирование цистеина в области CG или Cpg. Гиперметилирование этой области связано с пониженной транскрипционной активностью, а гипометилирование - наоборот. Другими словами, чем более "плотно" удерживается область ДНК, тем стабильнее и "моложе" вид. Рассматривая свойства метилирования ДНК в тканях, было обнаружено, что оно почти равно нулю для эмбриональных тканей, его можно использовать для определения ускорения старения, и результаты можно воспроизвести в тканях шимпанзе. [18]
Совсем недавно биомаркеры старения использовались в многочисленных клинических испытаниях для измерения замедления или обращения вспять возрастного ухудшения или биологического старения. [19] Консорциум по биомаркерам старения (https://www.agingconsortium.org) в настоящее время изучает применение этих биомаркеров для определения вмешательств, направленных на увеличение продолжительности жизни, и способов их проверки. [20] Более того, ресурсы с открытым исходным кодом, такие как пакет R methylCIPHER [21] и пакет Python pyaging [22], доступны общественности в качестве хабов для нескольких биомаркеров старения.
{{cite journal}}: Цитировать журнал требует |journal=( помощь )