Клик-химия — это подход к химическому синтезу, который подчеркивает эффективность, простоту, селективность и модульность в химических процессах, используемых для соединения молекулярных строительных блоков. Он включает как разработку, так и использование «клик-реакций», набора простых, биосовместимых химических реакций, которые соответствуют определенным критериям, таким как высокий выход, высокая скорость реакции и минимальное количество побочных продуктов. Впервые он был полностью описан К. Барри Шарплессом , Хартмутом К. Колбом и М. Г. Финном из Научно-исследовательского института Скриппса в 2001 году. [1] [2] В этой основополагающей статье Шарплесс утверждал, что синтетическая химия может имитировать способ, которым природа строит сложные молекулы, используя эффективные реакции для соединения простых, нетоксичных строительных блоков.
Термин «клик-химия» был придуман в 1998 году женой Шарплесса, Джен Дьюзер, [3] , которая нашла простоту этого подхода к химическому синтезу похожей на соединение кубиков Lego. Фактически, простота клик-химии представляла собой смену парадигмы в синтетической химии и оказала значительное влияние на многие отрасли, особенно на фармацевтическую разработку. В 2022 году Нобелевская премия по химии была совместно присуждена Кэролин Р. Бертоцци , Мортену П. Мелдалу и Шарплессу «за разработку клик-химии и биоортогональной химии ». [4]
Чтобы реакция считалась реакцией щелчка, она должна соответствовать определенным характеристикам: [5]
Предпочтительно, чтобы процесс:
Многие из критериев клик-химии субъективны, и даже если бы можно было договориться об измеримых и объективных критериях, маловероятно, что какая-либо реакция будет идеальной для каждой ситуации и применения. Однако было выявлено несколько реакций, которые лучше других соответствуют концепции: [ необходимо разъяснение ]
Классическая [13] [14] реакция клика — это катализируемая медью реакция азида с алкином с образованием 5-членного гетероатомного кольца: катализируемое Cu(I) азид-алкиновое циклоприсоединение (CuAAC). Первый синтез триазола из диэтилацетилендикарбоксилата и фенилазида был описан Артуром Майклом в 1893 году. [15] Позднее, в середине 20-го века, это семейство 1,3-диполярных циклоприсоединений получило название Рольфа Хейсгена после его исследований кинетики и условий их реакции .

Катализ меди(I) в 1,3-диполярном циклоприсоединении Хьюзгена был открыт одновременно и независимо группами Валерия В. Фокина и К. Барри Шарплесса в Исследовательском институте Скриппса в Калифорнии [16] и Мортена Мелдала в Лаборатории Карлсберга , Дания. [17] Катализируемая медью версия этой реакции дает только 1,4-изомер, тогда как некатализируемое 1,3-диполярное циклоприсоединение Хьюзгена дает как 1,4-, так и 1,5-изомеры, является медленным и требует температуры 100 градусов Цельсия. [15]

Более того, этот катализируемый медью «щелчок» не требует лигандов на металле, хотя сообщалось о таких ускоряющих лигандах, как трис(триазолил)метиламинные лиганды с различными заместителями, которые с успехом применялись в водном растворе. [15] Другие лиганды, такие как PPh3 и TBIA, также могут быть использованы, хотя PPh 3 подвержен лигированию по Штаудингеру с азидным заместителем. Было обнаружено, что Cu 2 O в воде при комнатной температуре также катализирует ту же реакцию за 15 минут с выходом 91%. [18]
Первый предложенный механизм реакции включал один каталитический атом меди; но изотопные, кинетические и другие исследования показали, что механизм димеди может быть более релевантным. [19] [20] [21] [22] [23] Несмотря на то, что эта реакция эффективно протекает в биологических условиях, медь в этом диапазоне дозировок является цитотоксичной. Были представлены решения этой проблемы, такие как использование водорастворимых лигандов на меди для улучшения проникновения катализатора в клетки и, таким образом, снижения необходимой дозировки, [24] [25] [26] или использование хелатирующих лигандов для дальнейшего увеличения эффективной концентрации Cu(I) и, таким образом, снижения фактической дозировки. [27] [28] [29]
Хотя вариант, катализируемый Cu(I), был впервые описан Мелдалом и его коллегами для синтеза пептидотриазолов на твердой подложке, их условия были далеки от истинного духа клик-химии и были перехвачены публично более признанным Шарплессом. Мелдал и его коллеги также решили не называть этот тип реакции «клик-химией», что якобы привело к тому, что их открытие было в значительной степени проигнорировано основным химическим сообществом. Фокин и Шарплесс независимо друг от друга описали его как надежный каталитический процесс, предлагающий «беспрецедентный уровень селективности, надежности и возможностей для тех попыток органического синтеза, которые зависят от создания ковалентных связей между различными строительными блоками».
Аналогичная реакция RuAAC, катализируемая рутением вместо меди, была описана группами Цзя и Фокина в 2005 году и позволяет селективно получать 1,5-изомеры. [30]
Группа Бертоцци далее разработала одну из реакций щелчка без меди Хьюсгена, чтобы преодолеть цитотоксичность реакции CuAAC. [31] Вместо использования Cu(I) для активации алкина, алкин вводится в напряженный дифтороктин (DIFO), в котором электроноакцепторные, пропаргиловые, гем-фториды действуют вместе с кольцевым напряжением, значительно дестабилизируя алкин. [32] Эта дестабилизация увеличивает движущую силу реакции и стремление циклоалкина ослабить свое кольцевое напряжение.

Эта реакция протекает как согласованное [3+2] циклоприсоединение к тройной связи в циклооктине по тому же механизму, что и 1,3-диполярное циклоприсоединение Хьюзгена. Заместители, отличные от фтора, такие как бензольные кольца, также разрешены в циклооктине.
Эта реакция была успешно использована для зондирования азидов в живых системах, хотя скорость реакции несколько медленнее, чем у CuAAC. Более того, поскольку синтез циклооктинов часто дает низкий выход, разработка зонда для этой реакции не была такой быстрой, как для других реакций. Но производные циклооктина, такие как DIFO, дибензилциклооктин (DIBO или DBCO) и биарилазациклооктинон (BARAC), были успешно использованы в реакции SPAAC для зондирования азидов в живых системах. [33] [34] [35]
Диарил-напряженные циклооктины, включая дибензилциклооктин (DIBO), также использовались для реакции с 1,3-нитронами в реакциях циклоприсоединения алкин-нитронов, стимулируемых напряжением (SPANC), с получением N-алкилированных изоксазолинов. [36]
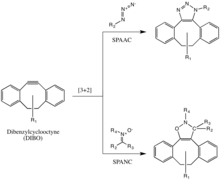
Поскольку эта реакция не содержит металлов и протекает с быстрой кинетикой (k2 всего лишь 60 1/Ms, быстрее, чем CuAAC или SPAAC), SPANC можно использовать для маркировки живых клеток. Более того, допускается замещение как атомов углерода, так и азота диполя нитрона, а также ациклических и эндоциклических нитронов. Этот большой допуск обеспечивает большую гибкость для включения нитронной ручки или зонда. [37]
Однако продукт изоксазолина не так стабилен, как продукт триазола CuAAC и SpAAC, и может подвергаться перегруппировкам в биологических условиях. Несмотря на это, эта реакция все еще очень полезна, поскольку она имеет заметно быструю кинетику реакции. [36]
Применение этой реакции включает маркировку белков, содержащих серин в качестве первого остатка: серин окисляется до альдегида с NaIO 4 и затем преобразуется в нитрон с п-метоксибензолтиолом, N-метилгидроксиламином и п-ансидином, и, наконец, инкубируется с циклооктином для получения продукта щелчка. SPANC также позволяет проводить мультиплексную маркировку. [38] [39]
Напряженные алкены также используют снятие напряжения в качестве движущей силы, которая позволяет им участвовать в клик-реакциях. Транс-циклоалкены (обычно циклооктены) и другие напряженные алкены, такие как оксанорборнадиен, реагируют в клик-реакциях с рядом партнеров, включая азиды, тетразины и тетразолы. Эти партнеры реакции могут специфически взаимодействовать с напряженным алкеном, оставаясь биоортогональными эндогенным алкенам, обнаруженным в липидах, жирных кислотах, кофакторах и других природных продуктах. [38]
Оксанорборнадиен (или другой активированный алкен) реагирует с азидами, давая триазолы в качестве продукта. Однако эти триазолы не ароматичны, как в реакциях CuAAC или SPAAC, и, как следствие, не столь стабильны. Активированная двойная связь в оксаноборнадиене создает триазолиновый промежуточный продукт, который впоследствии спонтанно подвергается ретрореакции Дильса-Альдера, чтобы высвободить фуран и дать 1,2,3- или 1,4,5-триазолы. Несмотря на то, что эта реакция медленная, она полезна, поскольку оксаборнодиен относительно прост в синтезе. Однако реакция не является полностью хемоселективной. [40]

Напряженные циклооктены и другие активированные алкены реагируют с тетразинами в обратной реакции Дильса-Альдера с электронным спросом, за которой следует ретро-циклоприсоединение [4+2] (см. рисунок). [41] Как и в других реакциях транс-циклооктена, движущей силой этой реакции является снятие напряжения кольца. Таким образом, трехчленные и четырехчленные циклоалкены из-за их высокого напряжения кольца являются идеальными субстратами алкенов. [41]
Подобно другим [4+2] циклоприсоединениям, электронодонорные заместители на диенофиле и электроноакцепторные заместители на диене ускоряют реакцию Дильса-Альдера с обратным требованием. Диен, тетразин, в силу наличия дополнительных азотов, является хорошим диеном для этой реакции. Диенофил, активированный алкен, часто может быть присоединен к электронодонорным алкильным группам на целевых молекулах, что делает диенофил более подходящим для реакции. [42]
Реакция «фотощелчка» тетразол-алкен является еще одним диполярным присоединением, которое впервые было введено Хьюзгеном в конце 1960-х годов (ChemBioChem 2007, 8, 1504). (68) Clovis, JS; Eckell, A.; Huisgen, R.; Sustmann, R. Chem. Ber. 1967, 100, 60.) Тетразолы с амино- или стириловыми группами, которые могут быть активированы УФ-светом при 365 нм (365 нм не повреждает клетки), реагируют быстро (так что УФ-свет не должен быть включен в течение длительного времени, обычно около 1–4 минут) для получения флуорогенных пиразолиновых продуктов. Эта схема реакции хорошо подходит для целей маркировки в живых клетках, поскольку УФ-свет при 365 нм повреждает клетки минимально. Более того, реакция протекает быстро, так что УФ-свет можно вводить в течение коротких промежутков времени. Квантовые выходы для коротковолнового УФ-света могут быть выше 0,5. Это позволяет использовать тетразолы избирательно по длине волны в сочетании с другой реакцией фотолигирования, где на короткой длине волны реакция лигирования тетразола протекает почти исключительно, а на более длинной длине волны другая реакция (лигирование через о-хинодиметаны) протекает исключительно. [43] Наконец, нефлуорогенные реагенты приводят к образованию флуорогенного продукта, оснащая реакцию встроенной спектрометрической ручкой.
И тетразолы, и алкеновые группы были включены в качестве белковых маркеров как неприродные аминокислоты, но это преимущество не уникально. Вместо этого, фотоиндуцируемость реакции делает ее главным кандидатом на пространственно-временную специфичность в живых системах. Проблемы включают присутствие эндогенных алкенов, хотя обычно цис (как в жирных кислотах) они все еще могут реагировать с активированным тетразолом. [44]
Критерии для клик-реакций разработаны для того, чтобы сделать химию биосовместимой для таких приложений, как изоляция и нацеливание молекул в сложных биологических средах. В таких средах продукты, соответственно, должны быть физиологически стабильными, а любые побочные продукты должны быть нетоксичными (для систем in vivo ).
Во многих приложениях клик-реакции соединяют биомолекулу и репортерную молекулу или другой молекулярный зонд, процесс, называемый биоконъюгацией . [45] Возможность присоединения флуорофоров и других репортерных молекул сделала клик-химию очень мощным инструментом для идентификации, обнаружения и характеристики как старых, так и новых биомолекул.
Одним из самых ранних и важных методов биоконъюгации было экспрессирование репортерного гена, например, гена зеленого флуоресцентного белка (GFP), в той же генетической последовательности, что и интересующий белок. Таким образом, белок может быть идентифицирован в клетках и тканях по зеленой флуоресценции. Однако этот подход сопряжен с рядом трудностей, поскольку GFP может влиять на способность белка достигать своей нормальной формы или препятствовать его нормальной экспрессии и функциям. Кроме того, при использовании этого метода GFP может быть присоединен только к белкам, оставляя другие важные биомолекулярные классы ( нуклеиновые кислоты , липиды , углеводы и т. д.) вне досягаемости.
Чтобы преодолеть эти проблемы, химики решили продолжить идентификацию пар биоортогональных партнеров реакции, что позволяет использовать небольшие экзогенные молекулы в качестве биомолекулярных зондов. Флуорофор может быть присоединен к одному из этих зондов, чтобы дать сигнал флуоресценции при связывании репортерной молекулы с мишенью — так же, как флуоресцирует GFP, когда он экспрессируется с мишенью.
Теперь ограничения возникают из химии зонда к его цели. Для того чтобы этот метод был полезен в биологических системах, клик-химия должна работать в биологических условиях или близко к ним, производить мало и (в идеале) нетоксичных побочных продуктов, иметь (предпочтительно) отдельные и стабильные продукты в тех же условиях и быстро протекать с высоким выходом в одном сосуде . Существующие реакции, такие как лигирование Штаудингера и 1,3-диполярное циклоприсоединение Хьюзгена , были модифицированы и оптимизированы для таких условий реакции. Сегодня исследования в этой области касаются не только понимания и разработки новых реакций и перепрофилирования и повторного понимания известных реакций, но и расширения методов, используемых для включения партнеров реакции в живые системы, проектирования новых партнеров реакции и разработки приложений для биоконъюгации.
Разрабатывая специфические и контролируемые биоортогональные реакции, ученые открыли возможность поражать определенные цели в сложных клеточных лизатах . Недавно ученые адаптировали клик-химию для использования в живых клетках, например, используя зонды малых молекул, которые находят и прикрепляются к своим целям с помощью клик-реакций. Несмотря на проблемы проницаемости клеток, биоортогональности, фоновой маркировки и эффективности реакции, клик-реакции уже доказали свою полезность в новом поколении экспериментов по извлечению (в которых определенные цели могут быть выделены с использованием, например, репортерных молекул, которые связываются с определенной колонкой) и флуоресцентной спектрометрии (в которой флуорофор прикрепляется к интересующей цели, а цель количественно определяется или локализуется). Совсем недавно были использованы новые методы для включения партнеров клик-реакции на и в биомолекулы , включая включение неприродных аминокислот, содержащих реактивные группы, в белки и модификацию нуклеотидов . Эти методы представляют собой часть области химической биологии , в которой клик-химия играет фундаментальную роль, намеренно и целенаправленно соединяя модульные единицы с различными концами.
Биотехнологическая компания Shasqi использует химию кликов в организме человека. [46] [47]
Клик-химия не ограничивается биологическими условиями: концепция «клик-реакции» использовалась в хемопротеомных , фармакологических, биомиметических и молекулярных машинных приложениях. [48]
Click Chemistry — это мощный инструмент для исследования клеточной локализации малых молекул. Знание того, куда в клетке попадают малые молекулы, дает мощное понимание механизмов их действия. [49] Этот подход использовался в многочисленных исследованиях, и открытия включают в себя то, что салиномицин локализуется в лизосомах, чтобы инициировать ферроптоз в раковых стволовых клетках [50] , и что производные метформина накапливаются в митохондриях, чтобы хелатировать медь(II), влияя на метаболизм и эпигенетические изменения ниже по течению в воспалительных макрофагах. [51]
Коммерческий потенциал клик-химии велик. Флуорофор родамин был связан с норборненом и реагировал с тетразином в живых системах. [52] В других случаях SPAAC между циклооктин-модифицированным флуорофором и азид-мечеными белками позволял отбирать эти белки в клеточных лизатах. [53]
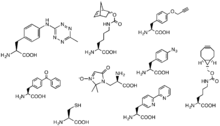
Методы включения партнеров клик-реакции в системы in и ex vivo способствуют расширению спектра возможных реакций. Развитие включения неестественных аминокислот рибосомами позволило включить партнеров клик-реакции в качестве неестественных боковых групп на этих неестественных аминокислотах. Например, UAA с азидной боковой группой обеспечивает удобный доступ циклоалкинов к белкам, помеченным этой неестественной аминокислотой «AHA». [54] В другом примере «CpK» имеет боковую группу, включающую циклопропановую альфа-связь с амидной связью, которая служит партнером реакции с тетразином в обратной реакции Дильса-Альдера. [55]

Синтез люциферина является примером другой стратегии изоляции партнеров реакции, которая заключается в использовании редко встречающихся природных групп, таких как 1,2-аминотиол, который появляется только тогда, когда цистеин является конечной N'-аминокислотой в белке. Их природная селективность и относительная биоортогональность, таким образом, ценны для разработки зондов, специфичных для этих меток. Вышеуказанная реакция происходит между 1,2-аминотиолом и 2-цианобензотиазолом, чтобы сделать люциферин, который является флуоресцентным. Эту флуоресценцию люциферина затем можно количественно определить с помощью спектрометрии после промывки и использовать для определения относительного присутствия молекулы, несущей 1,2-аминотиол. Если требуется количественное определение белка, не содержащего 1,2-аминотиол, интересующий белок можно расщепить, чтобы получить фрагмент с N' Cys, который уязвим для 2-CBT. [56]
Дополнительные приложения включают в себя:
В сочетании с комбинаторной химией , высокопроизводительным скринингом и созданием химических библиотек клик-химия ускорила открытие новых лекарственных препаратов, сделав каждую реакцию в многоэтапном синтезе быстрой, эффективной и предсказуемой.
Исследовательский институт Скриппса имеет портфель патентов на клик-химию. [63] Лицензиатами являются Invitrogen , [64] Allozyne , [65] Aileron, [66] Integrated Diagnostics, [67] и биотехнологическая компания baseclick, [68] ответвление BASF, созданное для продажи продуктов, изготовленных с использованием клик-химии. [69] Более того, baseclick имеет всемирную эксклюзивную лицензию на рынок исследований и диагностики в области нуклеиновых кислот. Флуоресцентные азиды и алкины также производятся такими компаниями, как Cyandye. [70]
{{cite journal}}: Цитировать журнал требует |journal=( помощь )Agard, NJ; Baskin, JM; Prescher, JA; Lo, A.; Bertozzi, CR (2006). «Сравнительное исследование биоортогональных реакций с азидами». ACS Chem. Biol . 1 (10): 644–648. doi :10.1021/cb6003228. PMID 17175580.