Диаграмма Эллингема — это график, показывающий температурную зависимость стабильности соединений. Этот анализ обычно используется для оценки легкости восстановления оксидов и сульфидов металлов . Эти диаграммы были впервые построены Гарольдом Эллингемом в 1944 году . [1] В металлургии диаграмма Эллингема используется для прогнозирования температуры равновесия между металлом , его оксидом и кислородом — и, как следствие, реакций металла с серой , азотом и другими неметаллами . Диаграммы полезны для прогнозирования условий, при которых руда будет восстанавливаться до своего металла. Анализ носит термодинамический характер и игнорирует кинетику реакции . Таким образом, процессы, которые, как предсказывается диаграммой Эллингема, будут благоприятными, все еще могут быть медленными.
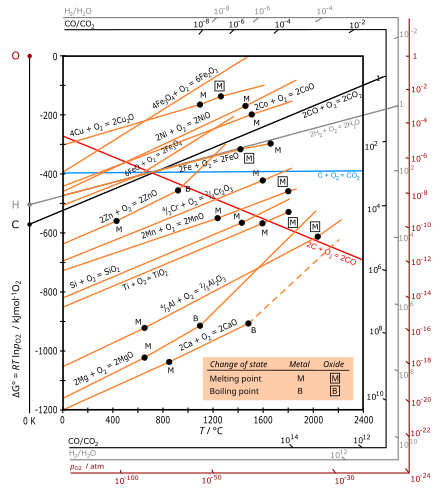
Диаграммы Эллингема представляют собой частную графическую форму принципа, согласно которому термодинамическая осуществимость реакции зависит от знака Δ G , изменения свободной энергии Гиббса , которое равно Δ H − T Δ S , где Δ H — изменение энтальпии , а Δ S — изменение энтропии .
Диаграмма Эллингхэма отображает изменение свободной энергии Гиббса (Δ G ) для каждой реакции окисления как функцию температуры. Для сравнения различных реакций все значения Δ G относятся к реакции одного и того же количества кислорода, выбранного в качестве одного моля O ( 1 ⁄ 2 моль O
2) некоторыми авторами [2] и один моль O
2другими. [3] Показанная диаграмма относится к 1 моль O
2, так что, например, линия окисления хрома показывает Δ G для реакции 4 ⁄ 3 Cr(s) + O
2(г) → 2 ⁄ 3 Кр
2О
3(s), что составляет 2 ⁄ 3 молярной энергии Гиббса образования Δ G f °( Cr
2О
3, с).
В обычно используемых температурных диапазонах металл и оксид находятся в конденсированном состоянии (твердом или жидком), а кислород является газом с гораздо большей молярной энтропией. Для окисления каждого металла доминирующий вклад в изменение энтропии (Δ S ) вносит удаление 1 ⁄ 2 моль O
2, так что ΔS отрицателен и примерно одинаков для всех металлов. Наклон графиков [2] поэтому положителен для всех металлов, причем Δ G всегда становится более отрицательным с более низкой температурой, а линии для всех оксидов металлов приблизительно параллельны. Поскольку эти реакции являются экзотермическими, они всегда становятся возможными при более низких температурах. При достаточно высокой температуре знак Δ G может инвертироваться (становиться положительным), и оксид может спонтанно восстанавливаться до металла, как показано [ где? ] для Ag и Cu.
Для окисления углерода красная линия соответствует образованию CO: C(s) + 1 ⁄ 2 O
2(г) → CO(г) с увеличением числа молей газа, что приводит к положительному Δ S и отрицательному наклону. Синяя линия для образования CO 2 приблизительно горизонтальна, так как реакция C(s) + O
2(г) → CO 2 (г) оставляет число молей газа неизменным, так что Δ S мало.
Как и в случае любого прогноза химической реакции, основанного исключительно на термодинамических соображениях, спонтанная реакция может быть очень медленной, если одна или несколько стадий в пути реакции имеют очень высокую энергию активации E A .
Если присутствуют два металла, необходимо рассмотреть два равновесия. Оксид с более отрицательным Δ G будет образован, а другой оксид будет восстановлен.
В промышленных процессах восстановление оксидов металлов часто осуществляется с помощью карботермической реакции , используя углерод в качестве восстановителя. Углерод доступен дешево в виде угля , который может быть преобразован в кокс . Когда углерод реагирует с кислородом, он образует газообразные оксиды оксид углерода и диоксид углерода , поэтому термодинамика его окисления отличается от таковой для металлов: его окисление имеет более отрицательную Δ G при более высоких температурах (выше 700 °C). Таким образом, углерод может служить восстановителем . Используя это свойство, восстановление металлов может быть выполнено как двойная окислительно-восстановительная реакция при относительно низкой температуре.
Основное применение диаграмм Эллингхема — в добывающей металлургической промышленности, где они помогают выбирать наилучший восстановитель для различных руд в процессе извлечения, очистки и установления марки для производства стали. Они также помогают руководить очисткой металлов, особенно удалением следовых элементов. Процесс прямого восстановления для получения железа прочно опирается на руководство диаграмм Эллингхема, которые показывают, что водород сам по себе может восстанавливать оксиды железа до металла.
При плавке железной руды гематит восстанавливается в верхней части печи, где температура находится в диапазоне 600–700 °C. Диаграмма Эллингема показывает, что в этом диапазоне оксид углерода действует как более сильный восстановитель, чем углерод, поскольку процесс
имеет более отрицательное изменение свободной энергии, чем процесс:
В верхней части доменной печи гематит восстанавливается CO (образующимся при окислении кокса ниже на дне доменной печи, при более высокой температуре) даже в присутствии углерода, хотя это происходит главным образом потому, что кинетика реакции газообразного CO с рудой здесь лучше.
Кривая Эллингема для реакции 2C(s) + O
2(г) → 2CO(г) наклоняется вниз и опускается ниже кривых для всех металлов. Следовательно, углерод может нормально действовать как восстановитель для всех оксидов металлов при очень высоких температурах. Но хром, образующийся при этих температурах, реагирует с углеродом, образуя его карбид, что придает нежелательные свойства полученному металлическому хрому. Следовательно, для высокотемпературного восстановления оксида хрома углерод использовать нельзя.

Кривая Эллингхэма для алюминия лежит ниже кривых большинства металлов, таких как хром , железо и т. д. Этот факт указывает на то, что алюминий может быть использован в качестве восстановителя для оксидов всех этих металлов. Этот результат иллюстрируется следующим образом:
Свободные энергии образования оксида хрома(III) и оксида алюминия на моль потребленного кислорода составляют -541 кДж и -827 кДж соответственно. Процессы следующие:
Второе уравнение минус первое уравнение дает:
Итак, оксид алюминия более стабилен, чем оксид хрома (по крайней мере, при нормальных температурах, а фактически вплоть до температур разложения оксидов). Поскольку изменение свободной энергии Гиббса отрицательно, алюминий может восстанавливать оксид хрома.
В пирометаллургии алюминий используется в качестве восстановителя в алюминотермическом или термитном процессе для извлечения хрома и марганца путем восстановления их оксидов.
Концепция построения графиков свободных энергий реакции различных элементов с заданным газофазным реагентом может быть расширена за пределы реакций окисления. Оригинальная статья Эллингема явно касалась восстановления как кислорода, так и серы металлургическими процессами [1] и предполагала использование таких диаграмм для других соединений, включая хлориды, карбиды и сульфаты. Эта концепция, как правило, полезна для изучения сравнительной стабильности соединений в диапазоне парциальных давлений и температур. Построение диаграммы Эллингема особенно полезно при изучении стабильности соединений в присутствии восстановителя. Диаграммы Эллингема теперь доступны для бромидов, хлоридов, фторидов, гидридов, иодидов, нитридов, оксидов, сульфидов, селенидов и теллуридов.