Адаптивная иммунная система , также известная как приобретенная иммунная система , или специфическая иммунная система, является подсистемой иммунной системы , которая состоит из специализированных клеток, органов и процессов, которые специфически устраняют патогены . Приобретенная иммунная система является одной из двух основных стратегий иммунитета , обнаруженных у позвоночных (другой является врожденная иммунная система ).
Как и врожденная система, адаптивная иммунная система включает в себя как гуморальные компоненты иммунитета , так и компоненты клеточного иммунитета и уничтожает вторгающиеся патогены. В отличие от врожденной иммунной системы , которая заранее запрограммирована реагировать на общие широкие категории патогенов, адаптивная иммунная система высокоспецифична для каждого конкретного патогена, с которым столкнулся организм. [1]
Адаптивный иммунитет создает иммунологическую память после первоначального ответа на определенный патоген и приводит к усиленному ответу на будущие встречи с этим патогеном. Антитела являются важнейшей частью адаптивной иммунной системы. Адаптивный иммунитет может обеспечить длительную защиту, иногда на всю жизнь человека. Например, человек, выздоровевший от кори, теперь защищен от кори на всю жизнь; в других случаях он не обеспечивает пожизненную защиту, как в случае с ветряной оспой . Этот процесс адаптивного иммунитета является основой вакцинации .
Клетки, которые осуществляют адаптивный иммунный ответ, — это белые кровяные клетки, известные как лимфоциты . В-клетки и Т-клетки , два разных типа лимфоцитов, выполняют основные виды деятельности: реакции антител и клеточно-опосредованный иммунный ответ. При реакциях антител В-клетки активируются для секреции антител , которые представляют собой белки, также известные как иммуноглобулины. Антитела перемещаются по кровотоку и связываются с чужеродным антигеном, заставляя его инактивироваться, что не позволяет антигену связываться с хозяином. [2] Антигены — это любые вещества, которые вызывают адаптивный иммунный ответ. Иногда адаптивная система неспособна отличить вредные чужеродные молекулы от безвредных; последствиями этого могут быть сенная лихорадка , астма или любая другая аллергия .
При адаптивном иммунитете патоген-специфические рецепторы «приобретаются» в течение жизни организма (тогда как при врожденном иммунитете патоген-специфические рецепторы уже закодированы в геноме ). Этот приобретенный ответ называется «адаптивным», поскольку он готовит иммунную систему организма к будущим вызовам (хотя на самом деле он может быть и неадаптивным, когда приводит к аллергии или аутоиммунитету ).
Система обладает высокой адаптивностью благодаря двум факторам. Во-первых, соматическая гипермутация — это процесс ускоренных случайных генетических мутаций в генах, кодирующих антитела, что позволяет создавать антитела с новой специфичностью. Во-вторых, рекомбинация V(D)J случайным образом выбирает одну переменную (V), одно разнообразие (D) и одну соединительную (J) область для генетической рекомбинации и отбрасывает остальные, что создает в высшей степени уникальную комбинацию сегментов гена антиген-рецептор в каждом лимфоците. Этот механизм позволяет небольшому количеству генетических сегментов генерировать огромное количество различных рецепторов антигена, которые затем уникально экспрессируются на каждом отдельном лимфоците . Поскольку перестройка генов приводит к необратимому изменению ДНК каждой клетки, все потомство (отпрыски) этой клетки наследуют гены, которые кодируют ту же специфичность рецептора, включая клетки памяти B и клетки памяти T , которые являются ключами к долгоживущему специфическому иммунитету.
Термин «адаптивный» был впервые использован Робертом Гудом в отношении реакций антител у лягушек как синоним «приобретенного иммунного ответа» в 1964 году. Гуд признал, что использовал эти термины как синонимы, но объяснил только, что он предпочел использовать термин «адаптивный». Он мог думать о тогда еще не невероятной теории образования антител, в которой антитела были пластичны и могли адаптироваться к молекулярной форме антигенов, и/или о концепции «адаптивных ферментов», описанной Моно у бактерий, то есть ферментов, экспрессия которых могла быть вызвана их субстратами. Эта фраза использовалась почти исключительно Гудом и его студентами, а также несколькими другими иммунологами, работавшими с маргинальными организмами, до 1990-х годов, когда она стала широко использоваться в тандеме с термином «врожденный иммунитет», который стал популярной темой после открытия системы рецепторов Toll у дрозофилы , ранее маргинального организма для изучения иммунологии. Термин «адаптивный», используемый в иммунологии, является проблематичным, поскольку приобретенные иммунные реакции могут быть как адаптивными, так и неадаптивными в физиологическом смысле. Действительно, как приобретенные, так и врожденные иммунные реакции могут быть как адаптивными, так и неадаптивными в эволюционном смысле. Большинство учебников сегодня, следуя раннему использованию Джейнвэя , используют «адаптивный» почти исключительно и отмечают в глоссариях, что этот термин является синонимом «приобретенного». [ необходима цитата ]
Классический смысл «приобретенного иммунитета» стал означать, с момента открытия Тонегавы , «антигенспецифический иммунитет, опосредованный соматическими генными перестройками, которые создают клон-определяющие антигенные рецепторы». В последнее десятилетие термин «адаптивный» все чаще применяется к другому классу иммунного ответа, который до сих пор не ассоциировался с соматическими генными перестройками. К ним относятся расширение естественных клеток-киллеров (NK) с пока необъяснимой специфичностью к антигенам, расширение NK-клеток, экспрессирующих зародышевые кодируемые рецепторы, и активация других врожденных иммунных клеток до активированного состояния, которое дает кратковременную «иммунную память». В этом смысле «адаптивный иммунитет» больше напоминает концепцию «активированного состояния» или «гетеростаза», таким образом возвращаясь по смыслу к физиологическому смыслу «адаптации» к изменениям окружающей среды. [ необходима цитата ]
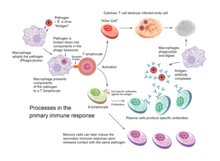
Приобретенный иммунитет активируется у позвоночных, когда патоген обходит врожденную иммунную систему и (1) создает пороговый уровень антигена и (2) генерирует сигналы «чужой» или «опасность», активирующие дендритные клетки . [3]
Основные функции приобретенной иммунной системы включают в себя: [ необходима цитата ]
У людей адаптивной иммунной системе требуется 4–7 дней, чтобы сформировать значимый ответ. [4]
Т- и В- лимфоциты являются клетками адаптивной иммунной системы. В организме человека насчитывается около 2 триллионов лимфоцитов, что составляет 20–40% белых кровяных клеток; их общая масса примерно такая же, как в мозге или печени . Периферический кровоток содержит только 2% всех циркулирующих лимфоцитов; остальные 98% перемещаются в тканях и лимфатической системе , которая включает лимфатические узлы и селезенку . [2] У людей примерно 1–2% пула лимфоцитов рециркулирует каждый час, чтобы увеличить возможность для клеток столкнуться с определенным патогеном и антигеном, на который они реагируют. [5]
В-клетки и Т-клетки происходят из одних и тех же мультипотентных гемопоэтических стволовых клеток и выглядят идентично друг другу до тех пор, пока не будут активированы. В-клетки играют большую роль в гуморальном иммунном ответе , тогда как Т-клетки тесно вовлечены в клеточно-опосредованные иммунные ответы . У всех позвоночных, за исключением бесчелюстных , В-клетки и Т-клетки вырабатываются стволовыми клетками в костном мозге. [6] Затем предшественники Т-клеток мигрируют из костного мозга в тимус , где они развиваются дальше.
У взрослого животного периферические лимфоидные органы содержат смесь В- и Т-клеток, находящихся по крайней мере на трех стадиях дифференциации: [ необходима цитата ]
Приобретенный иммунитет основан на способности иммунных клеток различать собственные клетки организма и нежелательные захватчики. Клетки хозяина экспрессируют «собственные» антигены . Эти антигены отличаются от антигенов на поверхности бактерий или на поверхности инфицированных вирусом клеток хозяина («не свои» или «чужие» антигены). Приобретенный иммунный ответ запускается путем распознавания чужеродного антигена в клеточном контексте активированной дендритной клетки. [ необходима цитата ]
За исключением безъядерных клеток (включая эритроциты ), все клетки способны представлять антиген посредством функции молекул главного комплекса гистосовместимости (MHC). [6] Некоторые клетки специально оснащены для представления антигена и для примирования наивных Т-клеток. Дендритные клетки , В-клетки и макрофаги оснащены специальными «костимулирующими» лигандами, распознаваемыми костимулирующими рецепторами на Т-клетках, и называются профессиональными антигенпрезентирующими клетками (АПК). [ необходима цитата ]
Несколько подгрупп Т-клеток могут быть активированы профессиональными АПК, и каждый тип Т-клеток специально оснащен для борьбы с каждым уникальным токсином или микробным патогеном. Тип активированной Т-клетки и тип генерируемого ответа зависят, в частности, от контекста, в котором АПК впервые столкнулась с антигеном. [3]

Дендритные клетки поглощают экзогенные патогены, такие как бактерии, паразиты или токсины в тканях, а затем мигрируют посредством хемотаксических сигналов в лимфатические узлы, обогащенные Т-клетками. Во время миграции дендритные клетки проходят процесс созревания, в ходе которого они теряют большую часть своей способности поглощать другие патогены и развивают способность общаться с Т-клетками. Дендритная клетка использует ферменты, чтобы разрезать патоген на более мелкие части, называемые антигенами . В лимфатическом узле дендритная клетка отображает эти чужеродные антигены на своей поверхности, связывая их с рецептором, называемым главным комплексом гистосовместимости , или MHC (также известным у людей как человеческий лейкоцитарный антиген (HLA)). Этот комплекс MHC-антиген распознается Т-клетками, проходящими через лимфатический узел. Экзогенные антигены обычно отображаются на молекулах MHC класса II , которые активируют CD4 + Т-хелперные клетки . [3]
Эндогенные антигены вырабатываются внутриклеточными бактериями и вирусами, реплицирующимися внутри клетки-хозяина. Клетка-хозяин использует ферменты для переваривания вирусно-ассоциированных белков и выставляет эти части на своей поверхности Т-клеткам, связывая их с MHC. Эндогенные антигены обычно выставляются на молекулах MHC класса I и активируют цитотоксические Т-клетки CD8 +. За исключением безъядерных клеток (включая эритроциты ), MHC класса I экспрессируется всеми клетками-хозяевами. [3]
Цитотоксические Т-клетки (также известные как TC, Т-киллеры или цитотоксические Т-лимфоциты (CTL)) представляют собой подгруппу Т-клеток, которые вызывают гибель клеток, инфицированных вирусами (и другими патогенами) или иным образом поврежденных или дисфункциональных. [3]
Наивные цитотоксические Т-клетки активируются, когда их Т-клеточный рецептор (TCR) сильно взаимодействует с пептидно-связанной молекулой MHC класса I. Это сродство зависит от типа и ориентации комплекса антиген/MHC и является тем, что удерживает CTL и инфицированную клетку связанными вместе. [3] После активации CTL подвергается процессу, называемому клональной селекцией , в ходе которого он приобретает функции и быстро делится, производя армию «вооруженных» эффекторных клеток. Затем активированные CTL путешествуют по всему телу в поисках клеток, которые несут этот уникальный пептид MHC класса I +. [ необходима цитата ]
При воздействии на эти инфицированные или дисфункциональные соматические клетки эффекторные CTL высвобождают перфорин и гранулизин : цитотоксины, которые образуют поры в плазматической мембране клетки-мишени , позволяя ионам и воде поступать в инфицированную клетку и заставляя ее лопнуть или лизироваться . CTL высвобождают гранзим , сериновую протеазу, инкапсулированную в гранулу, которая проникает в клетки через поры, чтобы вызвать апоптоз (смерть клетки). Чтобы ограничить обширное повреждение тканей во время инфекции, активация CTL строго контролируется и, как правило, требует очень сильного сигнала активации MHC/антигена или дополнительных сигналов активации, предоставляемых «хелперными» Т-клетками (см. ниже). [3]
После разрешения инфекции большинство эффекторных клеток погибают, и фагоциты их уничтожают, но некоторые из этих клеток остаются в качестве клеток памяти. [6] При более позднем столкновении с тем же антигеном эти клетки памяти быстро дифференцируются в эффекторные клетки, что значительно сокращает время, необходимое для формирования эффективного ответа. [ необходима цитата ]

Лимфоциты CD4+, также называемые «хелперными» Т-клетками, являются медиаторами иммунного ответа и играют важную роль в установлении и максимизации возможностей приобретенного иммунного ответа. [3] Эти клетки не обладают цитотоксической или фагоцитарной активностью; и не могут убивать инфицированные клетки или уничтожать патогены, но, по сути, «управляют» иммунным ответом, направляя другие клетки на выполнение этих задач. [ необходима цитата ]
Т-хелперные клетки экспрессируют Т-клеточные рецепторы (TCR), которые распознают антиген, связанный с молекулами MHC класса II. Активация наивной Т-хелперной клетки заставляет ее высвобождать цитокины, что влияет на активность многих типов клеток, включая АПК (антиген-презентирующую клетку), которая ее активировала. Т-хелперные клетки требуют гораздо более мягкого стимула активации, чем цитотоксические Т-клетки. Т-хелперные клетки могут обеспечивать дополнительные сигналы, которые «помогают» активировать цитотоксические клетки. [6]
Классически, два типа ответов эффекторных CD4 + T-хелперных клеток могут быть вызваны профессиональным АПК, обозначенными как Th1 и Th2, каждый из которых предназначен для устранения различных типов патогенов. Факторы, определяющие, вызывает ли инфекция ответ типа Th1 или Th2, до конца не изучены, но полученный ответ играет важную роль в устранении различных патогенов. [3]
Реакция Th1 характеризуется выработкой интерферона-гамма , который активирует бактерицидную активность макрофагов и побуждает В-клетки вырабатывать опсонизирующие (маркирующие для фагоцитоза) и комплементсвязывающие антитела, что приводит к клеточно-опосредованному иммунитету . [3] В целом, реакции Th1 более эффективны против внутриклеточных патогенов (вирусов и бактерий, находящихся внутри клеток хозяина).
Реакция Th2 характеризуется высвобождением интерлейкина 5 , который индуцирует эозинофилы при очищении от паразитов. [8] Th2 также вырабатывают интерлейкин 4 , который облегчает переключение изотипа В-клеток . [3] В целом, реакции Th2 более эффективны против внеклеточных бактерий, паразитов, включая гельминтов, и токсинов . [3] Подобно цитотоксическим Т-клеткам, большинство клеток-помощников CD4 + погибают при разрешении инфекции, а несколько остаются в качестве клеток памяти CD4 + .
Все больше появляется убедительных доказательств из научных исследований на мышах и людях о более широком разнообразии субпопуляций эффекторных Т-хелперных клеток CD4 + . [9] [10] Регуляторные Т-клетки (Treg) были идентифицированы как важные отрицательные регуляторы адаптивного иммунитета, поскольку они ограничивают и подавляют иммунную систему для контроля аберрантных иммунных реакций на собственные антигены; важный механизм в контроле развития аутоиммунных заболеваний. [6] Фолликулярные хелперные Т-клетки (Tfh) являются еще одной особой популяцией эффекторных CD4 + Т-клеток, которые развиваются из наивных Т-клеток после активации антигена. Клетки Tfh специализируются на помощи гуморальному иммунитету В-клеток , поскольку они уникально способны мигрировать в фолликулярные В-клетки во вторичных лимфоидных органах и обеспечивать их положительными паракринными сигналами, позволяющими генерировать и отзывать продукцию высококачественных антител с зрелой аффинностью . Подобно Tregs, клетки Tfh также играют роль в иммунологической толерантности , поскольку аномальное увеличение числа клеток Tfh может привести к неограниченной аутореактивной продукции антител, вызывая серьезные системные аутоиммунные расстройства. [11]
Значимость CD4 + T-хелперных клеток подчеркивается во время ВИЧ- инфекции. ВИЧ способен подрывать иммунную систему, целенаправленно атакуя CD4 + T-клетки, именно те клетки, которые могут управлять очищением от вируса, но также и клетки, которые управляют иммунитетом против всех других патогенов, встречающихся в течение жизни организма. [6]
Гамма-дельта Т-клетки (γδ Т-клетки) обладают альтернативным Т-клеточным рецептором (TCR) в отличие от CD4+ и CD8+ αβ Т-клеток и разделяют характеристики Т-хелперных клеток, цитотоксических Т-клеток и естественных клеток-киллеров. Как и другие «нетрадиционные» подмножества Т-клеток, несущие инвариантные TCR, такие как ограниченные CD1d естественные клетки-киллеры Т , γδ Т-клетки проявляют характеристики, которые помещают их на границу между врожденным и приобретенным иммунитетом. С одной стороны, γδ Т-клетки можно считать компонентом адаптивного иммунитета, поскольку они перестраивают гены TCR посредством рекомбинации V(D)J , которая также производит межклеточное разнообразие , и развивают фенотип памяти. С другой стороны, однако, различные подмножества также можно считать частью врожденной иммунной системы, где ограниченные рецепторы TCR или NK могут использоваться в качестве рецептора распознавания образов . Например, согласно этой парадигме, большое количество Т-клеток Vγ9/Vδ2 реагируют в течение нескольких часов на обычные молекулы, вырабатываемые микробами, а крайне ограниченные интраэпителиальные Т-клетки Vδ1 реагируют на стрессированные эпителиальные клетки. [ необходима цитата ]

B-клетки являются основными клетками, участвующими в создании антител , циркулирующих в плазме крови и лимфе, известных как гуморальный иммунитет . Антитела (также известные как иммуноглобулины, Ig) представляют собой большие белки в форме буквы Y, используемые иммунной системой для идентификации и нейтрализации чужеродных объектов. У млекопитающих существует пять типов антител: IgA , IgD , IgE , IgG и IgM , различающиеся по биологическим свойствам; каждый из них эволюционировал для обработки различных видов антигенов. После активации B-клетки вырабатывают антитела, каждое из которых распознает уникальный антиген и нейтрализует определенные патогены. [3]
Связывание антигена и антитела может вызвать пять различных защитных механизмов:
Как и Т-клетки, В-клетки экспрессируют уникальный В-клеточный рецептор (BCR), в данном случае связанную с мембраной молекулу антитела. Все BCR любого клона В-клеток распознают и связываются только с одним конкретным антигеном. Критическое различие между В-клетками и Т-клетками заключается в том, как каждая клетка «видит» антиген. Т-клетки распознают свой родственный антиген в обработанной форме – как пептид в контексте молекулы MHC, [3] тогда как В-клетки распознают антигены в их нативной форме. [3] Как только В-клетка сталкивается со своим родственным (или специфическим) антигеном (и получает дополнительные сигналы от хелперной Т-клетки (преимущественно типа Th2)), она далее дифференцируется в эффекторную клетку, известную как плазматическая клетка. [3]
Плазматические клетки — это короткоживущие клетки (2–3 дня), которые секретируют антитела. Эти антитела связываются с антигенами, что делает их более легкими мишенями для фагоцитов, и запускают каскад комплемента . [3] Около 10% плазматических клеток выживают, чтобы стать долгоживущими антигенспецифическими В-клетками памяти . [3] Уже подготовленные к выработке специфических антител, эти клетки могут быть призваны быстро отреагировать, если тот же патоген повторно заражает хозяина, в то время как хозяин испытывает мало симптомов, если вообще испытывает.
Примитивные бесчелюстные позвоночные , такие как минога и миксина , имеют адаптивную иммунную систему, которая показывает 3 различные клеточные линии, каждая из которых имеет общее происхождение с В-клетками, αβ Т-клетками и врожденными γΔ Т-клетками. [12] [13] Вместо классических антител и рецепторов Т-клеток эти животные обладают большим набором молекул, называемых вариабельными лимфоцитарными рецепторами (сокращенно VLR), которые, как и антигенные рецепторы челюстных позвоночных, производятся только из небольшого числа (одного или двух) генов . Считается, что эти молекулы связывают патогенные антигены аналогично антителам и с той же степенью специфичности. [14]
Долгое время считалось, что насекомые и другие беспозвоночные обладают только врожденной иммунной системой . Однако в последние годы некоторые из основных признаков адаптивного иммунитета были обнаружены у насекомых. Эти черты — иммунная память и специфичность. Хотя признаки присутствуют, механизмы отличаются от таковых у позвоночных .
Иммунная память у насекомых была обнаружена с помощью феномена прайминга. Когда насекомые подвергаются воздействию нелетальной дозы или убитых нагреванием бактерий, они способны вырабатывать память об этой инфекции, что позволяет им выдерживать в противном случае смертельную дозу тех же бактерий, которым они подвергались ранее. [15] [16] В отличие от позвоночных, насекомые не обладают клетками, специфичными для адаптивного иммунитета. Вместо этого эти механизмы опосредованы гемоцитами . Гемоциты функционируют аналогично фагоцитам, и после прайминга они способны более эффективно распознавать и поглощать патоген. [17] Было также показано, что возможна передача памяти потомству. Например, у медоносных пчел , если королева заражена бактериями, то новорожденные рабочие обладают улучшенными способностями в борьбе с теми же бактериями. [18] Другая экспериментальная модель, основанная на красном мучном хрущаке , также показала передачу патоген-специфической праймированной памяти потомству как от матерей, так и от отцов. [19]
Наиболее общепринятая теория специфичности основана на гене Dscam . Ген Dscam , также известный как молекула клеточного адгезива синдрома Дауна, представляет собой ген, содержащий 3 вариабельных домена Ig . Эти домены могут быть альтернативно сплайсированы, достигая большого количества вариаций. [20] Было показано, что после воздействия различных патогенов образуются различные формы сплайсинга dscam. После того, как животные с различными формами сплайсинга подвергаются воздействию одного и того же патогена, выживают только особи со специфичной для этого патогена формой сплайсинга. [20]
Другим механизмом, поддерживающим специфичность иммунитета насекомых, является РНК-интерференция (РНКi). РНКi — это форма противовирусного иммунитета с высокой специфичностью. [21] У нее есть несколько различных путей, все из которых заканчиваются тем, что вирус не может реплицироваться. Один из путей — это siRNA , в котором длинная двухцепочечная РНК разрезается на части, которые служат матрицами для белкового комплекса Ago2-RISC, который находит и разрушает комплементарную РНК вируса. Путь miRNA в цитоплазме связывается с комплексом Ago1-RISC и функционирует как матрица для деградации вирусной РНК. Последний — это piRNA , где малая РНК связывается с семейством белков Piwi и контролирует транспозоны и другие мобильные элементы. [22] Несмотря на исследования, точные механизмы, ответственные за иммунное праймирование и специфичность у насекомых, описаны недостаточно хорошо.

CRISPR — это термин в исследовании ДНК . Он обозначает кластеризованные регулярно-интерспейсированные короткие палиндромные повторы . Они являются частью генетического кода прокариот : большинство бактерий и архей имеют его. Это их защита от атак вирусов . [23] Его структура и функция были открыты в 21 веке. [24] [25] [26]
CRISPR имеет много коротких повторяющихся последовательностей. Эти последовательности являются частью адаптивной иммунной системы прокариот. Это позволяет им запоминать и противостоять бактериофагам, которые охотятся на них. Они работают как своего рода приобретенная иммунная система для бактерий. [27] [28]
Когда активируются В-клетки и Т-клетки, некоторые из них становятся В-клетками памяти , а некоторые Т-клетками памяти . На протяжении всей жизни животного эти клетки памяти формируют базу данных эффективных В- и Т-лимфоцитов. При взаимодействии с ранее встреченным антигеном соответствующие клетки памяти отбираются и активируются. Таким образом, второе и последующие воздействия антигена вызывают более сильный и быстрый иммунный ответ. Это «адаптивно» в том смысле, что иммунная система организма готовится к будущим вызовам, но, конечно, «неадаптивно», если рецепторы являются аутоиммунными. Иммунологическая память может быть в форме либо пассивной кратковременной памяти, либо активной долговременной памяти. [ необходима цитата ]
Пассивная память обычно кратковременна и длится от нескольких дней до нескольких месяцев. Новорожденные младенцы не подвергались предварительному воздействию микробов и особенно уязвимы для инфекции. Несколько уровней пассивной защиты обеспечивается матерью. Внутриутробно материнский IgG транспортируется непосредственно через плаценту , так что при рождении у человеческих младенцев наблюдается высокий уровень антител с тем же диапазоном антигенных специфичностей, что и у их матери. [3] Грудное молоко содержит антитела (в основном IgA), которые переносятся в кишечник младенца, защищая от бактериальных инфекций, пока новорожденный не сможет синтезировать собственные антитела. [3]
Это пассивный иммунитет , потому что плод на самом деле не производит никаких клеток памяти или антител: он только заимствует их. Краткосрочный пассивный иммунитет также может быть передан искусственно от одного человека к другому через сыворотку, богатую антителами . [ необходима цитата ]
Как правило, активный иммунитет является долгосрочным и может быть приобретен путем инфицирования с последующей активацией В- и Т-клеток или искусственно приобретен с помощью вакцин в процессе, называемом иммунизацией.
Исторически инфекционные заболевания были основной причиной смерти среди населения. За последнее столетие были разработаны два важных фактора для борьбы с их распространением: санитария и иммунизация . [6] Иммунизация (обычно называемая вакцинацией ) — это преднамеренная индукция иммунного ответа, и представляет собой наиболее эффективную манипуляцию иммунной системой, которую разработали ученые. [6] Иммунизации успешны, потому что они используют естественную специфичность иммунной системы, а также ее индуцируемость. [ необходима цитата ]
Принцип иммунизации заключается во введении антигена, полученного из болезнетворного организма, который стимулирует иммунную систему к выработке защитного иммунитета против этого организма, но который сам по себе не вызывает патогенных эффектов этого организма. Антиген ( сокращение от anti body generator ) определяется как любое вещество, которое связывается со специфическим антителом и вызывает адаптивный иммунный ответ. [2]
Большинство вирусных вакцин основаны на живых ослабленных вирусах, тогда как многие бактериальные вакцины основаны на бесклеточных компонентах микроорганизмов, включая безвредные токсиновые компоненты. [2] Многие антигены, полученные из бесклеточных вакцин, не вызывают сильного адаптивного ответа, и большинство бактериальных вакцин требуют добавления адъювантов , которые активируют антигенпрезентирующие клетки врожденной иммунной системы для усиления иммуногенности . [6]

Большинство крупных молекул, включая практически все белки и многие полисахариды , могут служить антигенами. [3] Части антигена, которые взаимодействуют с молекулой антитела или рецептором лимфоцита, называются эпитопами , или антигенными детерминантами. Большинство антигенов содержат различные эпитопы и могут стимулировать выработку антител, специфические реакции Т-клеток или и то, и другое. [3] Очень небольшая часть (менее 0,01%) от общего числа лимфоцитов способна связываться с определенным антигеном, что предполагает, что только несколько клеток реагируют на каждый антиген. [6]
Для приобретенного ответа, чтобы «запомнить» и устранить большое количество патогенов, иммунная система должна быть способна различать множество различных антигенов, [2] и рецепторы, которые распознают антигены, должны быть произведены в огромном разнообразии конфигураций, по сути, один рецептор (как минимум) для каждого отдельного патогена, который может когда-либо встретиться. Даже при отсутствии стимуляции антигеном человек может производить более 1 триллиона различных молекул антител. [6] Для хранения генетической информации, которая производит эти рецепторы, потребовались бы миллионы генов, но весь геном человека содержит менее 25 000 генов . [29]
Мириады рецепторов производятся посредством процесса, известного как клональный отбор . [2] [3] Согласно теории клонального отбора, при рождении животное случайным образом генерирует огромное разнообразие лимфоцитов (каждый из которых несет уникальный антигенный рецептор) из информации, закодированной в небольшом семействе генов. Для генерации каждого уникального антигенного рецептора эти гены прошли процесс, называемый рекомбинацией V(D)J , или комбинаторной диверсификацией , в котором один сегмент гена рекомбинируется с другими сегментами гена, образуя один уникальный ген. Этот процесс сборки генерирует огромное разнообразие рецепторов и антител, прежде чем организм когда-либо столкнется с антигенами, и позволяет иммунной системе реагировать на почти неограниченное разнообразие антигенов. [3] На протяжении всей жизни животного лимфоциты, которые могут реагировать против антигенов, с которыми животное фактически сталкивается, отбираются для действия — направленного против всего, что выражает этот антиген. [ необходима цитата ]
Врожденные и приобретенные части иммунной системы работают вместе, а не вопреки друг другу. Приобретенная рука, В- и Т-клетки не могли бы функционировать без врожденного системного ввода. Т-клетки бесполезны без антигенпрезентирующих клеток, которые их активируют, а В-клетки неактивны без помощи Т-клеток. С другой стороны, врожденная система, вероятно, была бы переполнена патогенами без специализированного действия адаптивного иммунного ответа.
Краеугольным камнем иммунной системы является распознавание «своего» против «чужого». Поэтому механизмы, которые защищают человеческий плод (который считается «чужим») от атаки иммунной системы, особенно интересны. Хотя не появилось всеобъемлющего объяснения этого загадочного и часто повторяющегося отсутствия отторжения, две классические причины могут объяснить, как плод переносится. Первая заключается в том, что плод занимает часть тела, защищенную неиммунологическим барьером, маткой , которую иммунная система обычно не патрулирует. [3] Вторая заключается в том, что сам плод может способствовать локальной иммуносупрессии у матери, возможно, путем процесса активного истощения питательных веществ. [3] Более современное объяснение этой индукции толерантности заключается в том, что определенные гликопротеины, экспрессируемые в матке во время беременности, подавляют иммунный ответ матки (см. eu-FEDS ). [ необходима цитата ]
Во время беременности у живородящих млекопитающих (все млекопитающие, кроме однопроходных ) эндогенные ретровирусы (ERV) активируются и вырабатываются в больших количествах во время имплантации эмбриона. В настоящее время известно, что они обладают иммунодепрессивными свойствами, что предполагает их роль в защите эмбриона от иммунной системы матери. Кроме того, вирусные белки слияния вызывают образование плацентарного синцития [30] , чтобы ограничить обмен мигрирующими клетками между развивающимся эмбрионом и телом матери (то, что эпителий не может сделать в достаточной степени, поскольку некоторые клетки крови специализируются на встраивании себя между соседними эпителиальными клетками). Иммунодепрессивное действие было первоначальным нормальным поведением вируса, похожим на ВИЧ. Белки слияния были способом распространения инфекции на другие клетки путем простого слияния их с инфицированной (ВИЧ тоже делает это). Считается, что предки современных живородящих млекопитающих эволюционировали после заражения этим вирусом, что позволило плоду пережить иммунную систему матери. [31]
Проект генома человека обнаружил несколько тысяч ERV, классифицированных по 24 семействам. [32]
Теоретическая основа, объясняющая работу приобретенной иммунной системы, представлена теорией иммунной сети , основанной на взаимодействиях между идиотипами (уникальными молекулярными особенностями одного клонотипа, т. е. уникальным набором антигенных детерминант вариабельной части антитела) и «антиидиотипами» (рецепторами антигена, которые реагируют с идиотипом, как если бы это был чужеродный антиген). Эта теория, которая основывается на существующей гипотезе клонального отбора и с 1974 года разрабатывалась в основном Нильсом Йерне и Джеффри В. Хоффманном , рассматривается как имеющая отношение к пониманию патогенеза ВИЧ и поиску вакцины против ВИЧ .
Одним из самых интересных достижений в биомедицинской науке за последние несколько десятилетий стало выяснение механизмов, опосредующих врожденный иммунитет. Один набор врожденных иммунных механизмов является гуморальным, например, активация комплемента . Другой набор включает рецепторы распознавания образов, такие как толл-подобные рецепторы , которые вызывают выработку интерферонов и других цитокинов, повышая устойчивость клеток, таких как моноциты, к инфекциям. [33] Цитокины, вырабатываемые во время врожденных иммунных реакций, входят в число активаторов адаптивных иммунных реакций. [33] Антитела оказывают аддитивные или синергические эффекты с механизмами врожденного иммунитета. Нестабильные кластеры HbS Band-3, основной интегральный белок эритроцитов; [34] антитела распознают эти кластеры и ускоряют их удаление фагоцитарными клетками. Кластеризованные белки Band 3 с прикрепленными антителами активируют комплемент, а фрагменты комплемента C3 являются опсонинами, распознаваемыми рецептором комплемента CR1 на фагоцитарных клетках. [35]
Популяционное исследование показало, что защитный эффект серповидноклеточной анемии против тропической малярии включает усиление как приобретенных, так и врожденных иммунных реакций на малярийного паразита, что иллюстрирует ожидаемый переход от врожденного иммунитета к приобретенному. [36]
Повторные заражения малярией усиливают приобретенный иммунитет и расширяют его действие против паразитов, экспрессирующих различные поверхностные антигены . К школьному возрасту у большинства детей вырабатывается эффективный адаптивный иммунитет против малярии. Эти наблюдения поднимают вопросы о механизмах, которые способствуют выживанию большинства детей в Африке, в то же время позволяя некоторым из них развивать потенциально смертельные инфекции.
При малярии, как и при других инфекциях, [33] врожденные иммунные реакции приводят к адаптивным иммунным реакциям и стимулируют их. Генетический контроль врожденного и приобретенного иммунитета в настоящее время является большой и процветающей дисциплиной.
Гуморальные и клеточно-опосредованные иммунные реакции ограничивают размножение малярийных паразитов, и многие цитокины способствуют патогенезу малярии, а также разрешению инфекций. [37]
Приобретенная иммунная система, которая лучше всего изучена у млекопитающих, возникла у челюстных рыб примерно 500 миллионов лет назад. Большинство молекул, клеток, тканей и связанных с ними механизмов этой системы защиты обнаружены у хрящевых рыб . [38] Рецепторы лимфоцитов , Ig и TCR, обнаружены у всех челюстных позвоночных. Самый древний класс Ig, IgM, связан с мембраной и затем секретируется при стимуляции В-клеток хрящевых рыб. Другой изотип, IgW акулы, связан с IgD млекопитающих. TCR, как α/β, так и γ/δ, обнаружены у всех животных от челюстноротых до млекопитающих. Организация генных сегментов, которые подвергаются перестройке генов , отличается у хрящевых рыб, которые имеют кластерную форму по сравнению с формой транслокона у костных рыб и млекопитающих. Подобно TCR и Ig, MHC обнаружен только у челюстных позвоночных. Гены, участвующие в обработке и презентации антигенов , а также гены класса I и класса II , тесно связаны в пределах MHC почти всех изученных видов. [ необходима ссылка ]
Лимфоидные клетки можно идентифицировать у некоторых превертебральных вторичноротых (например, морских ежей). [39] Они связывают антиген с рецепторами распознавания образов (PRR) врожденной иммунной системы . У бесчелюстных рыб два подтипа лимфоцитов используют вариабельные рецепторы лимфоцитов (VLR) для связывания антигена. [40] Разнообразие создается путем перестройки сегментов ДНК на основе LRR , опосредованной цитозиндезаминазой . [41] Нет никаких доказательств существования генов, активирующих рекомбинацию (RAG), которые перестраивают сегменты генов Ig и TCR у челюстных позвоночных.
Эволюция AIS, основанная на молекулах Ig, TCR и MHC, как полагают, возникла в результате двух основных эволюционных событий: переноса транспозона RAG (возможно, вирусного происхождения) и двух полных дупликаций генома . [38] Хотя молекулы AIS хорошо сохранились, они также быстро эволюционируют. Тем не менее, сравнительный подход обнаруживает, что многие черты довольно единообразны во всех таксонах. Все основные черты AIS возникли рано и быстро. У бесчелюстных рыб есть другая AIS , которая полагается на перестройку генов для генерации разнообразных иммунных рецепторов с функциональной дихотомией, которая параллельна молекулам Ig и TCR. [42] Врожденная иммунная система , которая играет важную роль в активации AIS, является важнейшей защитной системой беспозвоночных и растений .
Иммунитет может быть приобретен либо активно, либо пассивно. Иммунитет приобретается активно, когда человек подвергается воздействию чужеродных веществ, и иммунная система реагирует. Пассивный иммунитет — это когда антитела передаются от одного хозяина к другому. Как активно приобретенный, так и пассивно приобретенный иммунитет может быть получен естественным или искусственным путем.