

Кальциевый канал L-типа (также известный как дигидропиридиновый канал, или канал DHP ) является частью семейства высоковольтно-активируемых потенциал-зависимых кальциевых каналов . [2] «L» означает «длительный», что указывает на продолжительность активации. Этот канал имеет четыре изоформы: Cav1.1 , Cav1.2 , Cav1.3 и Cav1.4 .
Кальциевые каналы L-типа отвечают за сопряжение возбуждения- сокращения скелетных , гладких , сердечных мышц и за секрецию альдостерона в эндокринных клетках коры надпочечников . [1] Они также обнаружены в нейронах, и с помощью кальциевых каналов L-типа в эндокринных клетках они регулируют нейрогормоны и нейротрансмиттеры . Также было замечено, что они играют роль в экспрессии генов, стабильности мРНК , выживании нейронов, ишемически-индуцированном повреждении аксонов, синаптической эффективности, а также активации и деактивации других ионных каналов. [3]
В сердечных миоцитах кальциевый канал L-типа пропускает внутрь ток Ca2 + ( ICaL ) и запускает высвобождение кальция из саркоплазматического ретикулума путем активации рианодинового рецептора 2 (RyR2) (кальций-индуцированное-высвобождение кальция). [4] Фосфорилирование этих каналов увеличивает их проницаемость для кальция и увеличивает сократимость соответствующих им сердечных миоцитов.
Препараты из группы блокаторов кальциевых каналов L-типа используются в качестве сердечных антиаритмических или антигипертензивных средств в зависимости от того, имеют ли препараты более высокое сродство к сердцу ( фенилалкиламины , такие как верапамил ) или к кровеносным сосудам ( дигидропиридины , такие как нифедипин ). [5]
В скелетных мышцах очень высокая концентрация кальциевых каналов L-типа, расположенных в Т-трубочках . Деполяризация мышц приводит к большим токам ворот, но аномально низкому потоку кальция, что теперь объясняется очень медленной активацией ионных токов. По этой причине мало или совсем не проходит Ca 2+ через мембрану Т-трубочки во время одного потенциала действия.
В 1953 году Пол Фатт и Бернард Кац открыли потенциалзависимые кальциевые каналы в мышцах ракообразных. Каналы демонстрировали различные напряжения активации и свойства проводимости кальция и, таким образом, были разделены на активирующие каналы высокого напряжения (HVA) и активирующие каналы низкого напряжения (LVA). После дальнейших экспериментов было обнаружено, что каналы HVA блокируются производными 1,4-дигидропиридина (DHP). [6] Используя DHP, было обнаружено, что каналы HVA специфичны для определенных тканей и реагируют по-разному, что привело к дальнейшей категоризации каналов HVA на L-тип, P-тип и N-тип . [3] Кальциевые каналы L-типа были секвенированы пептидом, и было обнаружено, что существует 4 вида кальциевых каналов L-типа: α 1 S (скелетные мышцы), α 1 C (сердечные), α 1 D (обнаружены в мозге) и α 1 F (обнаружены в сетчатке). [6] В 2000 году, после проведения дополнительных исследований субъединиц α 1 в потенциалзависимых кальциевых каналах, была использована новая номенклатура, которая назвала кальциевые каналы L-типа CaV1, а ее субъединицы получили названия CaV1.1 , Cav1.2 , CaV1.3 и CaV1.4 . [3] Исследования субъединиц CaV1 продолжают открывать больше информации об их структуре, функции и фармацевтическом применении. [7]
Кальциевые каналы L-типа содержат 5 различных субъединиц: субъединицы α1 (170–240 кДа), α2 (150 кДа), δ (17–25 кДа), β (50–78 кДа) и γ (32 кДа). [8] Субъединицы α2, δ и β нековалентно связаны с субъединицей α1 и модулируют транспорт ионов и биофизические свойства субъединицы α1. Субъединицы α2 и δ находятся во внеклеточном пространстве, тогда как субъединицы β и γ расположены в цитозольном пространстве. [8]
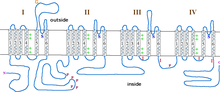
Субъединица α1 представляет собой гетеротетрамер, имеющий четыре трансмембранных области , известные как домены I-IV, которые пересекают плазму шесть раз как α-спирали , называемые S0-S6 (S0 и S1 вместе пересекают мембрану один раз). [3] Субъединица α1 в целом содержит домен, чувствительный к напряжению, пору проводимости и воротный аппарат. [9] Как и большинство потенциалзависимых ионных каналов , α-субъединица состоит из 4 субъединиц. Каждая субъединица образована 6 альфа-спиральными трансмембранными доменами, которые пересекают мембрану (пронумерованы S1-S6). Субъединицы S1-S4 составляют датчик напряжения, в то время как субъединицы S5-S6 составляют селективный фильтр. [10] Для восприятия напряжения клетки спирали S1-S3 содержат много отрицательно заряженных аминокислот, в то время как спирали S4 содержат в основном положительно заряженные аминокислоты с P-петлей , соединяющей спирали S4 и S5. После доменов S1-6 располагаются шесть доменов C, которые состоят из двух мотивов EF-hand (C1-2 и C3-4) и домена Pre-IQ (C5) и домена IQ (C6). На N-конце также имеются два мотива EF-hand . Оба конца N и C находятся в цитозольном пространстве, причем C-конец намного длиннее N-конца. [11]
Известно, что субъединица β имеет четыре изоформы (β1-β4) для регулирования функций канала и связана с α1 через линкер α1 I и II в цитозоле в кармане связывания β α1 (ABP). [7] [12] Каждая изоформа содержит домен src homology 3 (SH3) и домен, подобный гуанилаткиназе (GK), которые разделены доменом HOOK, и тремя неструктурированными областями. [12]
Субъединицы α2 и δ соединены вместе дисульфидными связями (иногда их называют субъединицей α2δ) и взаимодействуют с α1. [7] Они имеют четыре известные изоформы, называемые α2δ-1 до α2δ-2, и содержат домен фон Виллебранда A (VWA) и домен кэша . Область α2 находится во внеклеточном пространстве, в то время как область δ находится в клеточной мембране и, как было замечено, закреплена с помощью якоря гликозилфосфатидилинозитола (GPI). [12]
Субъединица γ имеет восемь изоформ (γ1-γ8) и связана с субъединицей α1 и была обнаружена только в мышечных клетках в каналах CaV1.1 и CaV1.2. [12] О субъединице γ известно немного, но она связана с взаимодействиями в гидрофобных силах. [3]
Открытие поры в кальциевых каналах L-типа происходит в субъединице α1. Когда мембрана деполяризуется, спираль S4 перемещается через линкеры S4 и S5 к цитоплазматическим концам спиралей S5 и S6. Это открывает активационные ворота , которые образованы внутренней стороной спиралей S6 в субъединице α1. [11]
Наиболее распространенным способом аутоингибирования кальциевых каналов L-типа является комплекс Ca 2+ /Cam. [11] Когда пора открывается и вызывает приток кальция, кальций связывается с кальмодулином , а затем взаимодействует с петлей, которая соединяет соседние мотивы EF-hand , и вызывает конформационное изменение в мотиве EF-hand, поэтому он взаимодействует с порой, вызывая быстрое ингибирование в канале. [6] До сих пор ведутся споры о том, где и как взаимодействуют пора и EF-hand. Гидрофобные карманы в комплексе Ca 2+ /Cam также будут связываться с тремя секциями домена IQ , известными как «ароматические якоря». [11] Комплекс Ca 2+ /Cam имеет высокое сродство к кальциевым каналам L-типа, что позволяет ему блокироваться даже при низком количестве кальция в клетке. Пора в конечном итоге закрывается, когда клетка реполяризуется и вызывает конформационное изменение в канале, переводя его в закрытую конформацию.
Одной из наиболее известных характеристик кальциевого канала L-типа является его уникальная чувствительность к 1,4-дигидропиридинам (DHP) . [3] В отличие от других потенциалзависимых кальциевых каналов, кальциевые каналы L-типа устойчивы к ингибиторам ⍵-CT X (GVIA) и ⍵-AG A (IVA). [3]
Хорошо наблюдаемая форма модуляции обусловлена альтернативным сплайсингом . Распространенной формой модуляции от альтернативного сплайсинга является C-концевой модулятор (CTM). Он имеет положительно заряженную α-спираль на C-конце, называемую DCRD, и отрицательно заряженную спираль сразу после мотива IQ (сайт взаимодействия CaM), называемую PCRD. Две спирали могут образовывать структуру, которая конкурентно связывается с CaM, чтобы уменьшить вероятность открытого состояния и более низкое кальций-зависимое ингибирование (CDI). [7]
Альтернативный сплайсинг также наблюдается на β-субъединицах для создания различных изоформ , чтобы придать каналам различные свойства из-за пальмитоилирования [6] и редактирования РНК . [7] Другие формы модуляции на β-субъединице включают увеличение или уменьшение экспрессии субъединицы. Это связано с тем, что β-субъединицы увеличивают вероятность открытия канала, активность в плазматической мембране и противодействуют убиквитинированию канала . [6]
L-тип кальциевых каналов также модулируются рецепторами, сопряженными с G-белком , и адренергической нервной системой . [6] Протеинкиназа А (PKA), активируемая каскадом рецепторов, сопряженных с G-белком, может фосфорилировать L-тип кальциевых каналов после того, как каналы образуют сигнальный комплекс с белками, закрепляющими A-киназу (AKAP) , для увеличения тока кальция через канал, увеличивая вероятность открытого состояния и ускоряя период восстановления. Активированная фосфолипаза С (PLC) из рецепторов, сопряженных с G-белком, может расщеплять полифосфоинозитиды, чтобы уменьшить ток кальция канала на 20% -30%. [7]
Было замечено, что адренергическая нервная система модулирует кальциевые каналы L-типа путем расщепления C-концевого фрагмента, когда β-адренергический рецептор стимулируется для увеличения активации каналов. [6]
В данной статье использован текст из Национальной медицинской библиотеки США , являющийся общественным достоянием .