В органической химии реакция Михаэля или присоединение Михаэля 1,4 представляет собой реакцию между донором Михаэля ( енолятом или другим нуклеофилом ) и акцептором Михаэля (обычно α,β-ненасыщенным карбонилом ) с образованием аддукта Михаэля путем создания углерод-углеродной связи на β-углероде акцептора . [1] [2] Она относится к более широкому классу сопряженных присоединений и широко используется для мягкого образования углерод-углеродных связей. [3]
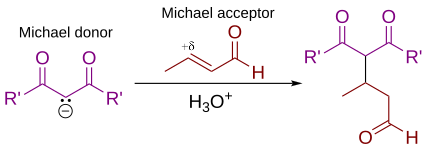
Реакция присоединения Михаэля является важным атомно-экономным методом для диастереоселективного и энантиоселективного образования связей C–C, и существует множество асимметричных вариантов [4] [5] [6]
В этой общей схеме присоединения Михаэля один или оба заместителя R и R' на нуклеофиле (доноре Михаэля) представляют собой электроноакцепторные заместители, такие как ацильные , циано , нитро или сульфоновые группы, которые делают соседний метиленовый водород достаточно кислотным для образования карбаниона при реакции с основанием , B:. Для алкена (акцептора Михаэля) заместитель R" обычно представляет собой карбонил , что делает соединение α,β-ненасыщенным карбонильным соединением (либо еноном , либо еналем ), или R" может быть любой электроноакцепторной группой.
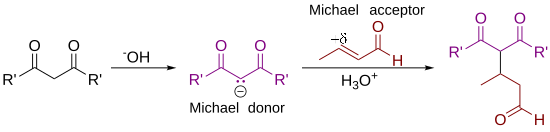
Первоначально Артур Майкл определил [ 7] [8], что реакция представляет собой присоединение енолята кетона или альдегида к α,β-ненасыщенному карбонильному соединению по β-углероду. Современное определение реакции Михаэля расширилось и теперь включает нуклеофилы, отличные от енолятов . [9] Некоторые примеры нуклеофилов включают дважды стабилизированные углеродные нуклеофилы, такие как бета-кетоэфиры, малонаты и бета-цианоэфиры. Полученный продукт содержит очень полезный 1,5-диоксигенированный образец. Неуглеродные нуклеофилы, такие как вода, спирты , амины и енамины , также могут реагировать с α,β-ненасыщенным карбонилом в 1,4-присоединении. [10]
Некоторые авторы расширили определение присоединения Михаэля, чтобы по существу ссылаться на любую реакцию 1,4-присоединения α,β-ненасыщенных карбонильных соединений. Другие, однако, настаивают на том, что такое использование является злоупотреблением терминологией, и ограничивают присоединение Михаэля образованием связей углерод-углерод посредством присоединения углеродных нуклеофилов. Термины окса-реакция Михаэля и аза-реакция Михаэля [2] использовались для обозначения 1,4-присоединения кислородных и азотных нуклеофилов соответственно. Реакция Михаэля также была связана с реакциями 1,6-присоединения. [11]
В механизме реакции 1 выступает в качестве нуклеофила: [3]
Депротонирование 1 основанием приводит к карбаниону 2 , стабилизированному его электроноакцепторными группами. Структуры 2a–2c представляют собой три резонансные структуры , которые можно нарисовать для этого вида, две из которых содержат енолят -ионы. Этот нуклеофил реагирует с электрофильным алкеном 3 , образуя 4 в реакции сопряженного присоединения . Наконец, енолят 4 отрывает протон от протонированного основания (или растворителя) , образуя 5 .
Реакция доминирует по орбитальным, а не по электростатическим соображениям. HOMO стабилизированных енолятов имеет большой коэффициент на центральном атоме углерода, в то время как LUMO многих альфа, бета ненасыщенных карбонильных соединений имеет большой коэффициент на бета-углероде. Таким образом, оба реагента можно считать мягкими . Эти поляризованные пограничные орбитали имеют схожую энергию и эффективно реагируют, образуя новую связь углерод-углерод. [12]
Подобно альдольному присоединению , реакция Михаэля может протекать через енол , силиловый енольный эфир в реакции Мукаямы-Михаэля или, что более типично, через енолятный нуклеофил. В последнем случае стабилизированное карбонильное соединение депротонируется сильным основанием (жесткая енолизация) или кислотой Льюиса и слабым основанием (мягкая енолизация). Образующийся енолят атакует активированный олефин с 1,4- региоселективностью , образуя связь углерод-углерод. Это также переносит енолят на электрофил . Поскольку электрофил гораздо менее кислый, чем нуклеофил, быстрый перенос протона обычно переносит енолят обратно на нуклеофил, если продукт енолизуем; однако можно воспользоваться новым локусом нуклеофильности, если подходящий электрофил находится в подвешенном состоянии. В зависимости от относительной кислотности нуклеофила и продукта реакция может быть каталитической по основанию. В большинстве случаев реакция необратима при низкой температуре.
Исследование, проведенное Артуром Майклом в 1887 году в Университете Тафтса, было вызвано публикацией Конрада и Кутцайта 1884 года о реакции этил-2,3-дибромпропионата с диэтилнатриймалонатом, в результате которой образуется производное циклопропана [13] (теперь известно, что это включает две последовательные реакции замещения).
Майклу удалось получить тот же продукт, заменив пропионат этиловым эфиром 2-бромакриловой кислоты , и он понял, что эта реакция может работать только при условии реакции присоединения к двойной связи акриловой кислоты . Затем он подтвердил это предположение, проведя реакцию диэтилмалоната и этилового эфира коричной кислоты, образовав первый аддукт Михаэля: [14]
В том же году Райнер Людвиг Клайзен заявил о приоритете изобретения. [15] Он и Т. Комненос наблюдали продукты присоединения к двойным связям в качестве побочных продуктов ранее в 1883 году, исследуя реакции конденсации малоновой кислоты с альдегидами . [16] Однако, по словам биографа Такаши Токороямы, это заявление необоснованно. [14]
Исследователи расширили область применения реакций Михаэля, включив элементы хиральности через асимметричные версии реакции. Наиболее распространенные методы включают хиральный катализ фазового переноса , например, четвертичные аммониевые соли, полученные из алкалоидов хинхоны ; или органокатализ , который активируется енаминами или иминием с хиральными вторичными аминами, обычно полученными из пролина . [17]
В реакции между циклогексаноном и β-нитростиролом, схематически представленной ниже, основание пролина дериватизируется и действует совместно с протонной кислотой, такой как п -толуолсульфоновая кислота : [18]
Син-присоединение благоприятствует 99% ee . В переходном состоянии, которое, как полагают, отвечает за эту селективность, енамин (образованный между азотом пролина и циклокетоном) и β-нитростирол являются кофациальными с водородной связью нитрогруппы с протонированным амином в боковой группе пролина .
Хорошо известная реакция Михаэля — синтез варфарина из 4-гидроксикумарина и бензилиденацетона, впервые описанный Линком в 1944 году: [19]
Существует несколько асимметричных версий этой реакции с использованием хиральных катализаторов. [20] [21] [22] [23] [24] [25]
Классическими примерами реакции Михаэля являются реакция между диэтилмалонатом (донор Михаэля) и диэтилфумаратом (акцептор Михаэля), [26] реакция диэтилмалоната и мезитилоксида (образование димедона ), [27] реакция диэтилмалоната и метилкротоната, [28] реакция 2-нитропропана и метилакрилата , [29] реакция этилфенилцианоацетата и акрилонитрила [30] и реакция нитропропана и метилвинилкетона . [31]
Классическая тандемная последовательность реакций Михаэля и альдольных реакций — это аннулирование Робинсона .
В реакции присоединения Мукаямы-Майкла нуклеофилом является эфир силилового енола , а катализатором обычно является тетрахлорид титана : [32] [33]

Реакция 1,6-Михаэля протекает посредством нуклеофильной атаки на 𝛿 углерод α,β- , 𝛿 -диненасыщенного акцептора Михаэля. [34] [35] Механизм 1,6-присоединения аналогичен 1,4-присоединению, за исключением нуклеофильной атаки, происходящей на 𝛿 углерод акцептора Михаэля. [35] Однако исследования показывают, что органокатализ часто благоприятствует 1,4-присоединению. [34] Во многих синтезах, где благоприятствовало 1,6-присоединению, субстрат содержал определенные структурные особенности. [35] Исследования показали, что катализаторы также могут влиять на региоселективность и энантиоселективность реакции 1,6-присоединения. [35]
Например, на изображении ниже показано добавление этилмагнийбромида к этилсорбату 1 с использованием медного катализатора с обратным лигандом иосифосом ( R,S )-(–)-3. [35] Эта реакция дала продукт 1,6-присоединения 2 с выходом 0%, продукт 1,6-присоединения 3 с выходом приблизительно 99% и продукт 1,4-присоединения 4 с выходом менее 2%. Этот конкретный катализатор и набор условий реакции привели к в основном региоселективному и энантиоселективному 1,6-Михаэлевскому присоединению этилсорбата 1 к продукту 3 .

Реакция Михаэля используется в качестве механистического шага многими ковалентными ингибиторными препаратами. Такие противораковые препараты, как ибрутиниб, озимертиниб и роцилетиниб, имеют функциональную группу акриламида в качестве акцептора Михаэля. Донор Михаэля в препарате реагирует с акцептором Михаэля в активном центре фермента . Это жизнеспособное лечение рака, поскольку целевой фермент ингибируется после реакции Михаэля. [36]
Все реакции полимеризации имеют три основных этапа: инициирование, распространение и завершение. Этап инициирования — это присоединение Михаэля нуклеофила к мономеру . Полученный вид подвергается присоединению Михаэля с другим мономером, причем последний действует как акцептор. Это удлиняет цепь, образуя другой нуклеофильный вид, который действует как донор для следующего присоединения. Этот процесс повторяется до тех пор, пока реакция не будет погашена обрывом цепи. [37] Исходный донор Михаэля может быть нейтральным донором, таким как амины , тиолы и алкоксиды или алкильные лиганды, связанные с металлом. [38]
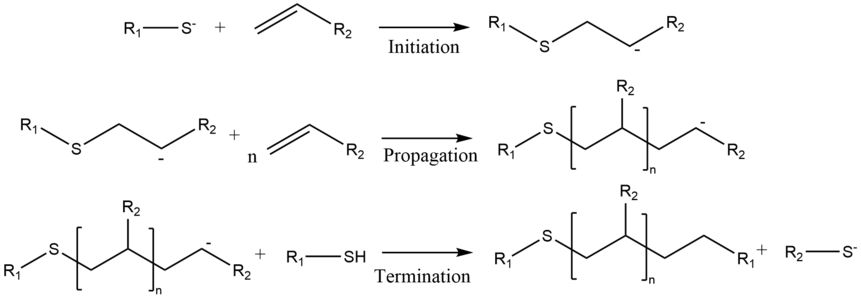
Линейные ступенчатые полимеризации роста являются одними из самых ранних применений реакции Михаэля в полимеризациях. Для синтеза разнообразных полимеров использовался широкий спектр доноров и акцепторов Михаэля. Примерами таких полимеров являются поли(амидоамин), поли(аминоэфир), поли(имидосульфид ) , поли( эстерсульфид ), поли(аспартамид), поли(имидоэфир) , поли(аминохинон ) , поли(енонсульфид) и поли(енаминкетон ) .
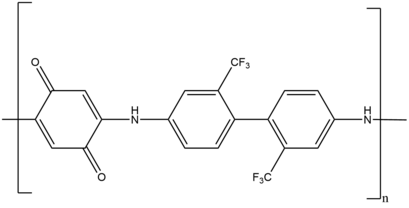
Например, линейная полимеризация ступенчатого роста производит окислительно-восстановительный активный поли(аминохинон), который служит в качестве антикоррозионного покрытия на различных металлических поверхностях. [39] Другой пример включает в себя сетевые полимеры , которые используются для доставки лекарств, высокопроизводительных композитов и покрытий. Эти сетевые полимеры синтезируются с использованием двойной цепной системы роста, фотоиндуцированного радикального и ступенчатого роста с добавлением Михаэля.

{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )