

В органической химии карбоксилат — это сопряженное основание карбоновой кислоты , RCOO − (или RCO−2). Это анион , ион с отрицательным зарядом .
Карбоксилатные соли — это соли , имеющие общую формулу M(RCOO) n , где M — металл, а n равно 1, 2,.... Карбоксилатные эфиры имеют общую формулу RCOOR′ (также пишется как RCO 2 R′ ), где R и R′ — органические группы.
Карбоксилатные ионы могут быть образованы путем депротонирования карбоновых кислот. Такие кислоты обычно имеют p K a менее 5, что означает, что они могут быть депротонированы многими основаниями, такими как гидроксид натрия или бикарбонат натрия . [1] : 271–2
Карбоновые кислоты легко диссоциируют на карбоксилат-анион и положительно заряженный ион водорода (протон), гораздо легче, чем спирты (на алкоксид -ион и протон), поскольку карбоксилат-ион стабилизируется резонансом . Отрицательный заряд, который остается после депротонирования карбоксильной группы, делокализован между двумя электроотрицательными атомами кислорода в резонансной структуре. Если группа R является электроноакцепторной группой (такой как –CF 3 ), основность карбоксилата будет еще больше ослаблена. [1] : 264–5
Эта делокализация электрона означает, что оба атома кислорода менее сильно отрицательно заряжены: положительный протон, следовательно, менее сильно притягивается обратно к карбоксилатной группе после того, как он ушел; следовательно, карбоксилатный ион более стабилен и менее основен в результате резонансной стабилизации отрицательного заряда. Напротив, алкоксидный ион, однажды образованный, будет иметь сильный отрицательный заряд, локализованный на его одиночном атоме кислорода, который будет сильно притягивать любые близлежащие протоны (действительно, алкоксиды являются очень сильными основаниями). Из-за резонансной стабилизации карбоновые кислоты имеют гораздо более низкие значения p K a (и, следовательно, являются более сильными кислотами), чем спирты . Например, значение p K a уксусной кислоты составляет 4,8, в то время как этанол имеет ap K a 16. Следовательно, уксусная кислота является гораздо более сильной кислотой, чем этанол. Это, в свою очередь, означает, что для эквимолярных растворов карбоновой кислоты или спирта в воде карбоновая кислота будет иметь гораздо более низкий pH . [1] : 263–7
Соли карбоновых кислот с атомом водорода в альфа- положении рядом с карбоксилатной группой могут быть преобразованы в дианионы с сильными основаниями, такими как диизопропиламид лития . Они реагируют с алкилгалогенидами, давая производные: [1] : 474
Карбоксилатные ионы являются хорошими нуклеофилами . Они реагируют с алкилгалогенидами с образованием сложных эфиров . Следующая реакция показывает механизм реакции. [1] : 398–9
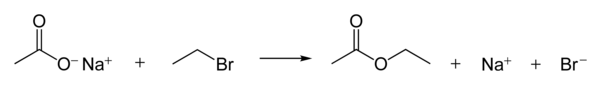
Нуклеофильность карбоксилат-ионов намного слабее, чем у гидроксид- и алкоксид -ионов, но сильнее, чем у галогенид- анионов (в полярном апротонном растворителе , хотя существуют и другие эффекты, такие как растворимость иона).
В отличие от восстановления сложного эфира, восстановление карбоксилата отличается из-за отсутствия уходящей группы и относительно богатого электронами атома углерода (из-за отрицательного заряда на атомах кислорода). При небольшом количестве кислоты реакция происходит с литийалюминийгидридом , изменяя LAH в кислоту Льюиса AlH 3 в процессе, преобразуя оксианион в 4 связи Al–O. [1] : 1212
Этот список предназначен для случаев, когда есть отдельная статья для аниона или его производных. Все другие органические кислоты должны быть найдены по их родительской карбоновой кислоте.