Реакция Цудзи-Троста (также называемая аллильным алкилированием Троста или аллильным алкилированием ) представляет собой катализируемую палладием реакцию замещения , в которой участвует субстрат, содержащий уходящую группу в аллильной позиции. Палладиевый катализатор сначала координируется с аллильной группой, а затем подвергается окислительному присоединению , образуя π -аллильный комплекс. Этот аллильный комплекс затем может быть атакован нуклеофилом , что приводит к замещенному продукту. [1]

Эта работа была впервые предпринята Дзиро Цудзи в 1965 году [2] и позднее адаптирована Барри Тростом в 1973 году с введением фосфиновых лигандов. [3] Область применения этой реакции была расширена до многих различных нуклеофилов на основе углерода, азота и кислорода, многих различных уходящих групп, многих различных лигандов на основе фосфора, азота и серы и многих различных металлов (хотя палладий по-прежнему предпочтительнее). [4] Введение фосфиновых лигандов привело к улучшению реакционной способности и многочисленным стратегиям асимметричного аллильного алкилирования. Многие из этих стратегий обусловлены появлением хиральных лигандов , которые часто способны обеспечивать высокую энантиоселективность и высокую диастереоселективность в мягких условиях. Эта модификация значительно расширяет полезность этой реакции для многих различных синтетических приложений. Способность образовывать связи углерод-углерод, углерод-азот и углерод-кислород в этих условиях делает эту реакцию весьма привлекательной как для медицинской химии, так и для синтеза природных продуктов.
В 1962 году Смидт опубликовал работу по катализируемому палладием окислению алкенов до карбонильных групп. В этой работе было установлено, что палладиевый катализатор активировал алкен для нуклеофильной атаки гидроксида . [ 5] Получив представление из этой работы, Цудзи выдвинул гипотезу, что подобная активация может иметь место для образования углерод-углеродных связей. В 1965 году Цудзи сообщил о работе, которая подтвердила его гипотезу. Реагируя димер хлорида аллилпалладия с натриевой солью диэтилмалоната , группа смогла образовать смесь моноалкилированного и диалкилированного продукта. [6]

Масштаб реакции расширялся лишь постепенно, пока в 1973 году Трост не совершил следующий большой прорыв. Пытаясь синтезировать ациклические гомологи сесквитерпенов, Трост столкнулся с проблемами в первоначальной процедуре и не смог алкилировать свои субстраты. Эти проблемы были преодолены добавлением трифенилфосфина в реакционную смесь.

Эти условия затем были проверены для других субстратов, и некоторые из них привели к «по сути мгновенной реакции при комнатной температуре». Вскоре после этого он разработал способ использования этих лигандов для асимметричного синтеза. [7] Неудивительно, что это подстегнуло многие другие исследования этой реакции и привело к важной роли, которую эта реакция теперь играет в синтетической химии.
Начиная с нульвалентных видов палладия и субстрата, содержащего уходящую группу в аллильной позиции, реакция Цудзи-Троста протекает через каталитический цикл , описанный ниже.

Сначала палладий координируется с алкеном, образуя комплекс η 2 π -аллил- Pd 0 Π . Следующий шаг - окислительное присоединение , в котором уходящая группа вытесняется с инверсией конфигурации и создается η 3 π -аллил- Pd II (также называемый ионизацией). Затем нуклеофил присоединяется к аллильной группе, восстанавливая комплекс η 2 π -аллил-Pd 0. По завершении реакции палладий отделяется от алкена и может снова начать каталитический цикл . [8]
Используемые нуклеофилы обычно генерируются из предшественников (пронуклеофилов) in situ после их депротонирования основанием. [9] Затем эти нуклеофилы подразделяются на «жесткие» и «мягкие» нуклеофилы, используя парадигму для описания нуклеофилов, которая в значительной степени основана на pKas их сопряженных кислот . «Жесткие» нуклеофилы обычно имеют сопряженные кислоты с pKas больше 25, в то время как «мягкие» нуклеофилы обычно имеют сопряженные кислоты с pKas меньше 25. [10] Этот дескриптор важен из-за влияния, которое эти нуклеофилы оказывают на стереоселективность продукта. Стабилизированные или «мягкие» нуклеофилы инвертируют стереохимию π - аллильного комплекса. Эта инверсия в сочетании с инверсией в стереохимии, связанной с окислительным добавлением палладия, дает чистое сохранение стереохимии. С другой стороны, нестабилизированные или «жесткие» нуклеофилы сохраняют стереохимию π -аллильного комплекса, что приводит к чистой инверсии стереохимии. [11]

Эта тенденция объясняется путем изучения механизмов нуклеофильной атаки. «Мягкие» нуклеофилы атакуют углерод аллильной группы, тогда как «жесткие» нуклеофилы атакуют металлический центр с последующим восстановительным элиминированием. [12]
Фосфиновые лиганды, такие как трифенилфосфин или лиганд Троста , использовались для значительного расширения области действия реакции Цудзи–Троста. Эти лиганды могут модулировать свойства палладиевого катализатора, такие как стерическая масса , а также электронные свойства. Важно, что эти лиганды также могут привносить хиральность в конечный продукт, что позволяет проводить эти реакции асимметрично, как показано ниже.
Энантиоселективная версия реакции Цудзи-Троста называется асимметричным аллильным алкилированием Троста (Trost AAA) или просто асимметричным аллильным алкилированием (AAA). Эти реакции часто используются в асимметричном синтезе. [13] [14] [15] Первоначально реакция была разработана с палладиевым катализатором, поддерживаемым лигандом Троста , хотя с тех пор подходящие условия значительно расширились. Энантиоселективность может быть придана реакции на любом из этапов, кроме декомплексирования палладия из алкена, поскольку стереоцентр уже установлен в этой точке. Было концептуализировано пять основных способов использования этих этапов и получения энантиоселективных условий реакции. Эти методы энантиодискриминации были ранее рассмотрены Тростом:
Предпочтительный метод энантиодискриминации во многом зависит от интересующего субстрата, и в некоторых случаях на энантиоселективность могут влиять несколько из этих факторов.
Сообщалось, что многие различные нуклеофилы эффективны для этой реакции. Некоторые из наиболее распространенных нуклеофилов включают малонаты , еноляты , первичные алкоксиды , карбоксилаты , феноксиды , амины , азиды , сульфонамиды , имиды и сульфоны .
Спектр уходящих групп также был расширен и теперь включает ряд различных уходящих групп, хотя наиболее широко используются карбонаты , фенолы , фосфаты , галогениды и карбоксилаты .
Недавние исследования продемонстрировали, что сфера действия «мягких» нуклеофилов может быть расширена за счет включения некоторых пронуклеофилов, которые имеют гораздо более высокие значения pKas, чем ~ 25. Некоторые из этих «мягких» нуклеофилов имеют значения pKas вплоть до 32, [16] и даже более основные пронуклеофилы (~ 44) действуют как мягкие нуклеофилы с добавлением кислот Льюиса , которые помогают облегчить депротонирование. [17] Улучшенный диапазон pKa «мягких» нуклеофилов имеет решающее значение, поскольку эти нуклеофилы являются единственными, которые были исследованы [18] [19] для энантиоселективных реакций до самого недавнего времени [20] (хотя неэнантиоселективные реакции «жестких» нуклеофилов были известны уже некоторое время [21] ). Увеличивая сферу применения пронуклеофилов, действующих как «мягкие» нуклеофилы, эти субстраты также можно включать в энантиоселективные реакции с использованием ранее описанных и хорошо охарактеризованных методов.

Основываясь на реакционной способности трифенилфосфинового лиганда, структура лигандов, используемых для реакции Цудзи-Троста, быстро стала более сложной. Сегодня эти лиганды могут содержать фосфор, серу, азот или некоторую комбинацию этих элементов, но большинство исследований сосредоточены на моно- и дифосфиновых лигандах. Эти лиганды можно дополнительно классифицировать на основе природы их хиральности, при этом некоторые лиганды содержат центральную хиральность на атомах фосфора или углерода, некоторые содержат биарильную аксиальную хиральность , а другие содержат планарную хиральность . Дифосфиновые лиганды с центральной хиральностью появились как эффективный тип лиганда (особенно для процедур асимметричного аллильного алкилирования), и лиганд Троста является одним из таких примеров. [22] Лиганды фосфинооксазолины (PHOX) использовались в AAA, особенно с нуклеофилами на основе углерода. [23]
Реакционный субстрат также был расширен до алленов . В этом специфическом расширении кольца реакция AAA также сопровождается перегруппировкой Вагнера-Мейервейна : [24] [25]
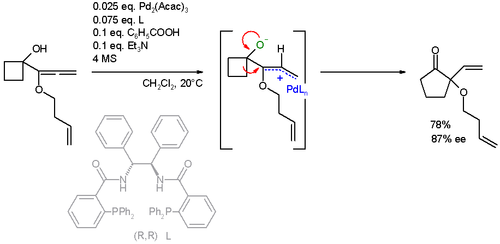
Способность образовывать связи углерод-углерод, углерод-азот и углерод-кислород энантиоселективно в мягких условиях делает асимметричное аллильное алкилирование Троста чрезвычайно привлекательным для синтеза сложных молекул.
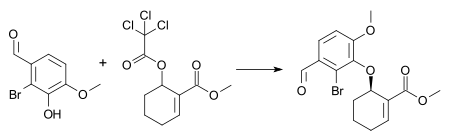
Примером этой реакции является синтез промежуточного продукта в комбинированном общем синтезе галантамина и морфина [26] с 1 моль% [димера хлорида пи-аллилпалладия], 3 моль% ( S,S ) лиганда Троста и триэтиламина в дихлорметане при комнатной температуре . Эти условия приводят к образованию (−)-энантиомера арильного эфира с химическим выходом 72% и энантиомерным избытком 88% .
Другая реакция Цуджи-Троста использовалась на начальных стадиях синтеза (−)- неотиобинуфаридина . Эта недавняя работа демонстрирует способность этой реакции давать высокодиастереоселективные (10:1) и энантиоселективные (97,5:2,5) продукты из ахирального исходного материала с небольшим количеством катализатора ( 1% ). [27]

Помимо практического применения этой реакции в медицинской химии и синтезе натуральных продуктов, недавние работы также использовали реакцию Цудзи-Троста для обнаружения палладия в различных системах. Эта система обнаружения основана на нефлуоресцентном датчике , полученном из флуоресцеина (датчики с большей длиной волны также были недавно разработаны для других применений [28] ), который становится флуоресцентным только в присутствии палладия или платины. Эта способность чувствительности палладия/платины обусловлена реакцией Цудзи-Троста. Датчик содержит аллильную группу с флуоресцеином, функционирующим как уходящая группа. Образуется π -аллильный комплекс, и после атаки нуклеофила флуоресцеин высвобождается, что приводит к резкому увеличению флуоресценции. [29] [30]

Этот простой, высокопроизводительный метод обнаружения палладия путем мониторинга флуоресценции показал свою полезность при мониторинге уровней палладия в металлических рудах , [31] фармацевтических продуктах , [32] и даже в живых клетках . [33] С учетом постоянно растущей популярности палладиевого катализа этот тип быстрого обнаружения должен быть очень полезен для снижения загрязнения фармацевтических продуктов и предотвращения загрязнения окружающей среды палладием и платиной.