В органической химии электрофильное ароматическое галогенирование является типом электрофильного ароматического замещения . Эта органическая реакция типична для ароматических соединений и является очень полезным методом добавления заместителей в ароматическую систему.
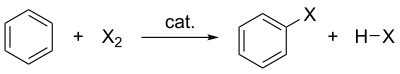
Некоторые типы ароматических соединений, такие как фенол , будут реагировать без катализатора , но для типичных производных бензола с менее реакционноспособными субстратами в качестве катализатора требуется кислота Льюиса . Типичные катализаторы на основе кислот Льюиса включают AlCl 3 , FeCl 3 , FeBr 3 и ZnCl 2 . Они работают, образуя высокоэлектрофильный комплекс , который атакуется бензольным кольцом.
Механизм реакции хлорирования бензола такой же, как и бромирования бензола. Бромид железа(III) и хлорид железа(III) инактивируются, если реагируют с водой, в том числе с влагой воздуха. Поэтому их получают путем добавления железных опилок к брому или хлору. Вот механизм этой реакции:
Механизм иодирования немного отличается: иод (I 2 ) обрабатывается окислителем, таким как азотная кислота, для получения электрофильного иода («I + », вероятно, IONO 2 ). Другие условия иодирования включают I 2 , HIO 3 , H 2 SO 4 и N -иодосукцинимид, H 2 SO 4 . [1] [2] Эти условия являются успешными для высокодеактивированных аренов, включая нитроароматические соединения.
В серии исследований был использован мощный реагент, полученный с использованием смеси йода и йодата калия, растворенных в концентрированной серной кислоте . Здесь йодирующим агентом является трийодный катион I 3 + , а основанием - HSO 4 − . В этих исследованиях были исследованы как кинетика реакции, так и препаративные условия йодирования сильно дезактивированных соединений, таких как бензойная кислота и 3-нитробензотрифторид. [3] [4]
Хотя электрофильное фторирование возможно с использованием реагентов F2 / N2 ( 10%), XeF2 или NF, таких как Selectfluor , эти методы используются редко из-за образования изомерных смесей и продуктов полифторирования. [5] Хотя смеси также образуются в случае других ароматических галогенирований, фторароматические соединения часто чрезвычайно сложно отделить от их нефторированных, полифторированных и/или изомерных аналогов.
Начальный этап галогенирования ароматических соединений отличается от этапа галогенирования алкенов тем, что алкены не требуют катализатора для повышения электрофильности галогена. Образование иона арениума приводит к временной потере ароматичности , которая имеет более высокую энергию активации по сравнению с образованием иона галония в алкенах. Другими словами, алкены более реакционноспособны и не нуждаются в ослаблении связи Br–Br или Cl–Cl.
Если кольцо содержит сильно активирующий заместитель, такой как –ОН, –ОР или амины , катализатор не нужен, например, при бромировании п -крезола : [6]
Однако если использовать катализатор с избытком брома, то образуется трибромид.
Галогенирование фенолов происходит быстрее в полярных растворителях в щелочной среде из-за диссоциации фенола, при этом феноксидные ионы более восприимчивы к электрофильной атаке, поскольку они более богаты электронами.
Хлорирование толуола хлором без катализатора требует также полярного растворителя, такого как уксусная кислота . Селективность перехода от орто к пара низкая: [7]
При замене растворителя на тетрахлорметан реакция не происходит . Напротив, когда реагентом является 2-фенилэтиламин , можно использовать относительно неполярные растворители с исключительной орто- региоселективностью из-за промежуточного образования хлорамина , что позволяет проводить внутримолекулярную реакцию .
Пищевой краситель эритрозин можно синтезировать путем йодирования другого красителя, называемого флуоресцеином :
Эту реакцию стимулирует гидрокарбонат натрия . [8]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )